儿童型滤泡性淋巴瘤9例临床病理及分子遗传学分析
2020-07-20裴晓音李文才王冠男张丹丹张延平赵武干
裴晓音,李文才,王冠男,张丹丹,张延平,赵武干
儿童型滤泡性淋巴瘤(paediatric-type follicular lymphoma, PTFL)是WHO(2016)造血与淋巴组织肿瘤分类指出的滤泡性淋巴瘤(follicular lymphoma, FL)的一个特殊亚型,其临床表现、病理特征、免疫表型及遗传学均与普通FL有所不同,且预后较好[1-2]。本文收集郑州大学第一附属医院诊断的9例PTFL,对其临床病理及分子遗传学特征进行分析总结,以提高对该疾病的认识。
1 材料与方法
1.1 临床资料收集2015年1月~2019年12月郑州大学第一附属医院病理科诊断的9例PTFL,按WHO(2016)造血与淋巴组织肿瘤分类修订版标准诊断。收集患者相应的临床资料并进行随访。
1.2 免疫组化及分子检测手术切除标本均经10%中性福尔马林固定,石蜡包埋,常规4 μm厚切片,行HE染色,并进行CD3、CD20、CD21、CD10、BCL-2、BCL-6、MUM1、Ki-67等免疫组化染色及Ig基因、BCL-2、IRF4基因检测。
2 结果
2.1 临床特征9例患者均为男性,中位年龄15(8~34)岁。8例患者为头颈部单发淋巴结肿大,1例为头颈部多发淋巴结肿大;所有患者均无发热、消瘦及体重下降等B症状。5例患者确诊后未予治疗,2例患者接受了化疗。随访时间2~47个月,7例患者均无瘤生存,2例失访(表1)。
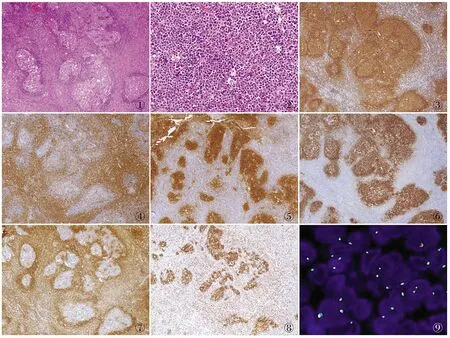
2.2 病理检查低倍镜下淋巴结被膜完整,结构被部分破坏,边缘可见正常淋巴结组织,可见大的、不规则的滤泡状结构(图1),这些滤泡套区变薄甚至消失,其生发中心没有极向,无明显明、暗区之分,可见星空现象(图2)。高倍镜下,其生发中心主要由中等大小比较一致的母细胞组成,细胞胞质少,核圆形或卵圆形,核仁不明显,核分裂象可见。其内还有巨噬细胞及滤泡树突细胞等成分。
2.3 免疫表型9例PTFL肿瘤细胞CD20均阳性(图3),CD3阴性(图4),8例CD10(图5)及BCL-6阳性,CD21标记显示滤泡树突细胞网,部分扩大或被破坏(图6),6例BCL-2阴性(图7),3例MUM1阳性,Ki-67增殖指数均≥30%(图8)。
2.4 Ig基因重排分析9例PTFL均显示Ig基因存在单克隆性重排。
2.5 FISH检测结果例3~5行FISH检测BCL-2基因未见断裂,也未见其基因拷贝数改变(图9)。例7、8行FISH检测,结果显示IRF4基因未见断裂。
3 讨论
FL约占所有淋巴瘤的20%,是成人期常见的恶性淋巴瘤,少见于儿童和青少年,文献报道发生于儿童的FL在组织学、免疫表型、分子遗传学及生物学行为上均有别于成人[2-3]。WHO(2008)造血与淋巴组织肿瘤分类中将PTFL作为FL的一个变异型被提出,随着对其认识的不断加深,发现其具有独特的临床病理和分子遗传学特征,故WHO(2016)造血与淋巴组织肿瘤分类中将其正式命名为PTFL。但国内相关病例报道较少,张帆等[4]报道了首例国内儿童FL,随后国内相继报道PTFL合计20余例,故本文回顾性分析9例PTFL的临床病理特征并结合相关文献进行复习。
表1 9例PTFL的临床病理资料
①②③④⑤⑥⑦⑧⑨
PTFL是一种少见的淋巴结滤泡性淋巴瘤,主要发生于儿童和青年,偶可发生于成人。目前文献报道的发病中位年龄15~18岁,40岁以上者少见[5]。PTFL存在显著的男性优势。大多数患者表现为头颈部无痛性淋巴结肿大,如颈部、颏下、颌下、耳后等部位,无发热、盗汗、体重减轻等B症状[1,6]。
组织学上表现为淋巴结结构至少部分破坏,通常为膨胀性的大滤泡结构,无弥漫性成分,肿瘤性滤泡套区变薄,生发中心扩大,没有极向,主要由中等大小的母细胞组成[2];肿瘤细胞为生发中心B细胞来源,故表达成熟B细胞标记(CD20、CD79α和PAX-5)及生发中心标记(CD10和BCL-6),BCL-2一般为阴性(少数可弱阳性),MUM1多为阴性,Ki-67增殖指数常>30%[7]。CD21可显示扩大的滤泡树突细胞(follicular dendritic cell, FDC)网。遗传学上Ig基因重排阳性,无BCL-2、BCL-6及IRF4基因重排[8]。本组9例患者在临床特点、病理形态、免疫表型及遗传学方面均与上述特征基本相符。
对PTFL进行遗传学分析的报道较少,目前可知,PTFL缺乏经典FL常见的t(14, 18)染色体易位,以及CREBBP、EZH2、KMT2D等组蛋白修饰基因的突变[9]。文献报道PTFL最常见的遗传学畸变是TNFRSF14、MAP2K1和IRF8等基因的突变[5,10-11]。
在实际临床工作中,PTFL的诊断和鉴别诊断较为困难,应注意与其它淋巴组织增生性病变进行鉴别。(1)伴IRF4重排的大B细胞淋巴瘤:也是WHO(2016)提出的新分类,主要发生于儿童和年轻人,无明显性别优势,主要累及头颈部淋巴结及Waldeyer环;组织学表现为中等~大的肿瘤细胞形成弥漫性、滤泡性或弥漫与滤泡性同时存在的结构,当其呈滤泡性生长时需与PTFL鉴别,伴IRF4重排的大B细胞淋巴瘤肿瘤细胞较常见到小的嗜碱性核仁,有丝分裂少见,星空现象缺乏;免疫表型上肿瘤细胞成熟B细胞标记(CD20、CD79α和PAX5)阳性,BCL-6阳性,IRF4/MUM1通常弥漫强阳性,PRDM1(也称为BLIMP1)通常阴性,约66%病例肿瘤细胞表达CD10和BCL-2;遗传学上通常具有IRF4重排[12]。(2)反应性滤泡增生性病变:组织学上一般淋巴结结构保存,滤泡数量增多,滤泡结构正常,极向存在,星空现象较明显[8];免疫表型上,T淋巴细胞标记、B淋巴细胞标记与BCL-2抗体表型为正常型,滤泡区B细胞标记阳性、BCL-2阴性,滤泡间区T细胞标记阳性,与PTFL较难鉴别;遗传学上Ig基因重排阴性。(3)儿童淋巴结边缘区淋巴瘤:多发于男童,男女比约为20∶1,主要发生于头颈部淋巴结,约90%的病例为Ⅰ期;组织学类似于成人淋巴结边缘区淋巴瘤,滤泡边缘区细胞增生,部分可见滤泡植入现象,常见进行性转化生发中心,肿瘤细胞主要由中~小细胞组成,胞质丰富、淡染,核圆形,核仁小,可有中心母细胞、免疫母细胞及浆细胞混杂存在;免疫表型上,肿瘤细胞表达CD20、CD79α,50%与CD43共表达,不表达CD10和BCL-6,大部分病例表达BCL-2;遗传学上Ig基因重排阳性[13]。(4)FL:主要发生于成人,中位年龄59岁,多数患者诊断时已有广泛播散,不可治愈,且常见复发,并可能向弥漫大B细胞淋巴瘤转化;少数高级别FL与PTFL组织学形态上较难鉴别,免疫表型上高级别FL肿瘤细胞常表达BCL-2、BCL-6和CD10;遗传学上,70%~95%的病例有t(14;18)(q32;q21),BCL-2基因易位至14号染色体重链基因旁,引起BCL-2基因的过表达。
PTFL预后较好,大多数数据表明,局部病变的患者单纯手术切除后不需要化疗或放疗。对于分期稍晚的患者化疗后,随访2年无瘤生存率约94%[14]。本组除2例患者失访外,余7例患者目前均无瘤生存。PTFL目前尚无明确的最佳治疗方案,建议根据患者年龄、临床分期采取个体化的治疗方案,避免过度治疗。
