结肠癌中HRH3表达对细胞增殖的影响
2020-07-20朱剑军
朱剑军,吴 昊
结肠癌的发病率和病死率均高居消化系统恶性肿瘤首位[1]。结肠癌的发生、发展是一个涉及多基因参与、多步骤的癌变过程。近年来,越来越多的文献报道组胺与恶性肿瘤的发生、发展密切相关[2-3]。组胺能够显著增强乳腺癌细胞的放疗敏感性,提示组胺能够作为一种潜在的抗癌佐剂,提高肿瘤患者的放疗效果[2]。作为一种具有生理活性的小分子物质,组胺通过与组胺受体结合,传递信号,在不同类型细胞中发挥不用作用[2]。组胺激活组胺1型受体,促进细胞增殖、胚胎发育和肿瘤生长[4]。激活组胺1型受体和组胺4型受体活性能够显著增强乳腺癌细胞的放疗敏感性[2],提示组胺受体蛋白家族可能是治疗恶性肿瘤的一组潜在作用靶点。组胺受体3(histamine receptor 3, HRH3)是一种7次跨膜蛋白,属于G蛋白偶联受体家族[5]。HRH3基因定位于染色体20q13.3,蛋白质由445个氨基酸组成,相对分子质量为48.6 KD。有研究报道HRH3与肝细胞肝癌、胆管细胞型肝癌、乳腺癌、前列腺癌等恶性肿瘤的生长与转移有关[5-7]。但截至目前,关于HRH3在结肠癌生长过程中的作用尚未见相关报道。本实验采用转染siRNA片段的方式靶向沉默HRH3基因在结肠癌细胞中的表达,CCK-8和EdU法监测肿瘤细胞生长和增殖活性,qRT-PCR和Western blot法分析相关信号通路改变,明确HRH3基因在结肠癌细胞恶性增殖过程中的功能作用,探讨相关分子机制,从而为阐明结肠癌的发病机制提供理论基础,为结肠癌治疗提供潜在作用靶点。
1 材料与方法
1.1 试剂DMEM培养液、胎牛血清(Hyclone公司,美国),CCK-8(碧云天公司,中国),EdU细胞增殖检测试剂盒(锐博公司,中国),Lipofectamine 2000、TRIzol Reagent(Invitrogen,美国),cDNA合成试剂盒、TB Green Advantage qPCR Premix(Takara公司,日本),HRH3抗体、c-Myc抗体和CDKN1A抗体(Abcam公司,美国),β-actin抗体、二抗(三鹰公司,中国)。
1.2 细胞培养常规培养结肠癌Ls174T细胞和SW480细胞。用含10%胎牛血清的DMEM培养液于37 ℃、5%CO2细胞培养箱中培养。
1.3 siRNA转染常规培养结肠癌细胞,将细胞接种于6孔板。24 h后,待细胞处于对数生长期时,进行细胞转染。转染步骤按照Lipofectamine 2000说明书进行。本课题实验分3组:空白对照组(只加Lipofectamine)、阴性对照组(si-NC组,转染阴性对照siRNA片段)、si-HRH3组(转染si-HRH3片段)。si-HRH3片段正义链序列5′-GGAGGAGAAAUGUGC ACUCAU-3′,反义链序列3′-CCUCCUCUUUACACGU GAGUA-5′。siRNA片段和阴性对照序列由上海吉码公司合成。
1.4 qRT-PCR常规培养结肠癌细胞,细胞转染siRNA片段48 h后进行实时荧光定量PCR实验。提取RNA、cDNA第一条链的合成步骤参照试剂盒说明书进行。采用TB Green qPCR Premix完成PCR扩增实验。扩增程序如下:95 ℃预变性10 min;95 ℃ 10 s,58 ℃ 10 s,72 ℃ 10 s,共计40个循环;最后72 ℃延伸10 min。溶解曲线条件按照常规程序进行。采用2-△△Ct算法计算目的基因的相对表达水平。HRH3引物、c-Myc引物和CDKN1A引物序列见表1。
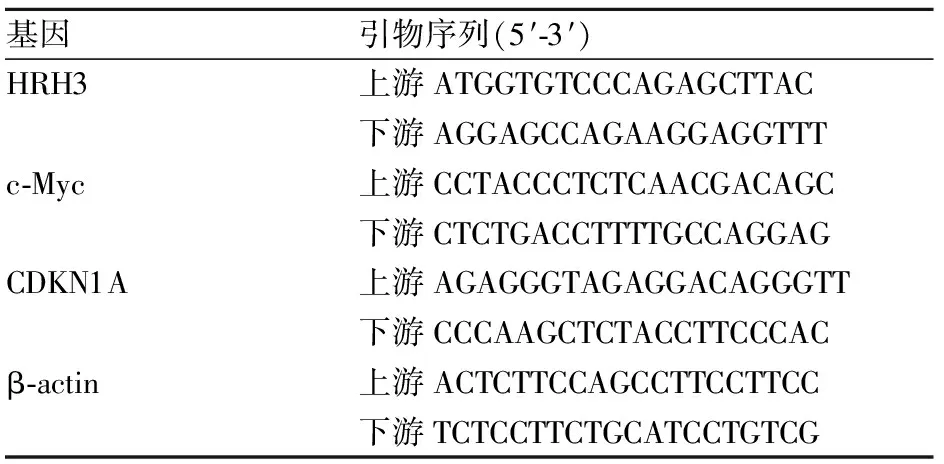
表1 qRT-PCR引物序列
1.5 Western blot常规培养结肠癌细胞,细胞转染siRNA片段72 h后进行 Western blot实验。RIPA裂解液裂解细胞,提取细胞总蛋白。BCA试剂盒进行蛋白定量。后续按照常规步骤进行SDS-PAGE垂直电泳、转膜、封闭。常温封闭1 h后,一抗孵育过夜。TBST冲洗后,二抗常温孵育1 h。ECL发光液检测蛋白条带。HRH3和CDKN1A抗体工作浓度1∶1 000;c-Myc抗体工作浓度1∶2 000;二抗工作浓度1∶10 000。
1.6 CCK-8实验常规培养结肠癌细胞。转染siRNA片段6 h后将细胞接种于96孔细胞培养板。接种时间记为0 h。在0 h、24 h、48 h、72 h、96 h这5个时间点检测细胞的生长状态。CCK-8溶液孵育1 h后,于酶标仪450 nm处检测。
1.7 EdU实验常规培养结肠癌细胞。转染siRNA片段48 h后进行EdU细胞增殖检测实验。加入适量EdU工作液,孵育2 h。后续经多聚甲醛固定、冲洗、EdU反应、Hoechst染色等步骤完成实验。最后用倒置荧光显微镜拍照。
2 结果
2.1 转染siRNA对结肠癌细胞中HRH3表达的影响采用转染siRNA片段的方法沉默HRH3基因表达。在结肠癌Ls174T和SW480细胞中,与阴性对照组相比,转染si-HRH3片段48 h后,si-HRH3组HRH3 mRNA表达水平降低,分别为82%±4.10%和75%±2.33%,差异均有统计学意义(P均<0.01,图1)。与空白对照组相比,阴性对照组HRH3 mRNA表达无显著变化(P>0.05)。Western blot结果进一步显示,与阴性对照组相比,转染si-HRH3片段72 h后,Ls174T和SW480细胞中HRH3蛋白水平均显著降低(图2)。上述研究表明,转染si-HRH3能够显著沉默结肠癌细胞中HRH3表达水平。
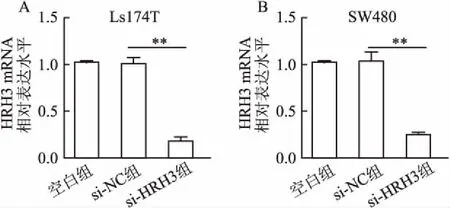
图1 转染si-HRH3对结肠癌细胞中HRH3 mRNA表达水平的影响:A.Ls174T细胞;B.SW480细胞;**P<0.01
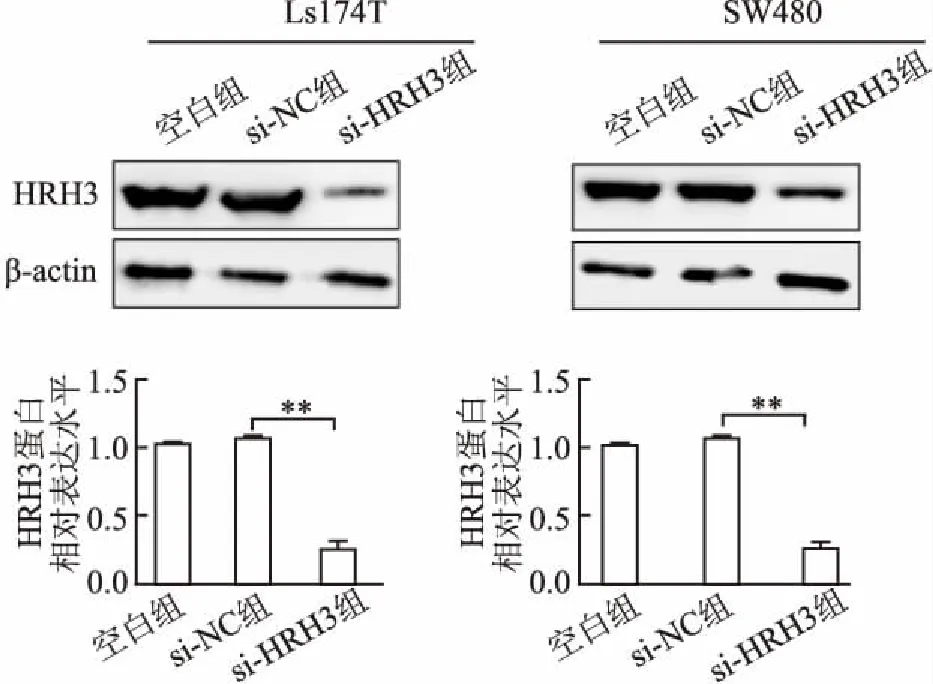
图2 转染si-HRH3对HRH3蛋白表达水平的影响:**P<0.01
2.2 HRH3对结肠癌细胞生长的影响为研究HRH3表达对结肠癌细胞生长的影响,本实验首先通过CCK-8实验检测沉默HRH3后对结肠癌细胞生长的影响,结果显示,在Ls174T和SW480细胞中,与阴性对照组相比,转染si-HRH3片段后96 h,si-HRH3组细胞生长抑制率分别为39.00%±2.25%和35.54%±3.51%,其差异具有统计学意义(P均<0.01,图3)。沉默HRH3后,结肠癌Ls174T和SW480细胞的生长明显减慢。为进一步验证HRH3对结肠癌细胞增殖的影响,本实验采用EdU实验检测结果表明,在Ls174T细胞中,阴性对照组细胞的增殖率为52.68%±1.33%,si-HRH3组细胞增殖率为23.11%±0.89%,其差异具有统计学意义(P<0.01,图4)。在SW480细胞中,阴性对照组与si-HRH3组的细胞增殖率分别为53.69%±2.57%、17.14%±1.46%,差异有统计学意义(P<0.01,图4)。上述实验结果表明,沉默HRH3表达能够有效抑制结肠癌细胞的恶性生长。
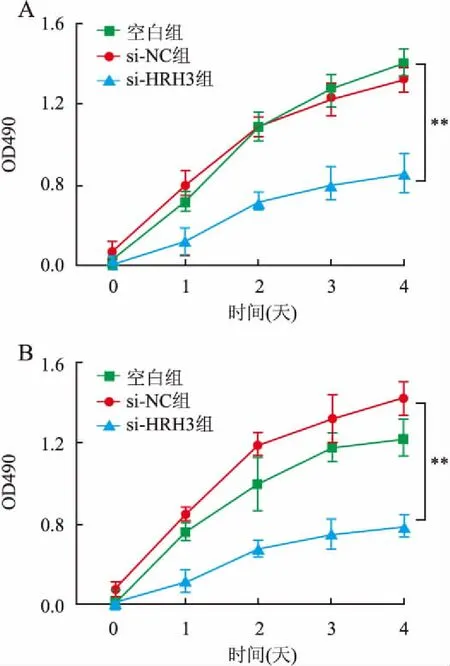
图3 沉默HRH3对结肠癌细胞生长的影响:A.Ls174T细胞;B.SW480细胞;**P<0.01
2.3 沉默HRH3对细胞增殖关键分子表达水平的影响为深入研究沉默HRH3抑制结肠癌细胞增殖的具体分子作用机制,本实验采用qRT-PCR和Western blot法检测沉默HRH3后c-Myc和CDKN1A的表达水平。qRT-PCR实验结果发现,在Ls174T和SW480细胞中,与阴性对照组相比,si-HRH3组c-Myc mRNA表达水平均显著降低,分别为35.11%±1.52%和24.65%±1.80%,其差异均有统计学意义(P=0.025,P=0.030);与阴性对照组相比,si-HRH3组CDKN1A mRNA表达水平显著升高,分别为56.73%±1.44%和55.39%±3.14%,其差异均具有统计学意义(P=0.0093,P=0.015,图5)。与qRT-PCR结果一致,Western blot实验结果显示,沉默HRH3后,c-Myc蛋白水平降低(P<0.01),CDKN1A蛋白水平升高(P<0.01,图6)。上述研究结果表明,HRH3可能通过调控c-Myc和CDKN1A表达水平,影响结肠癌细胞的恶性增殖。
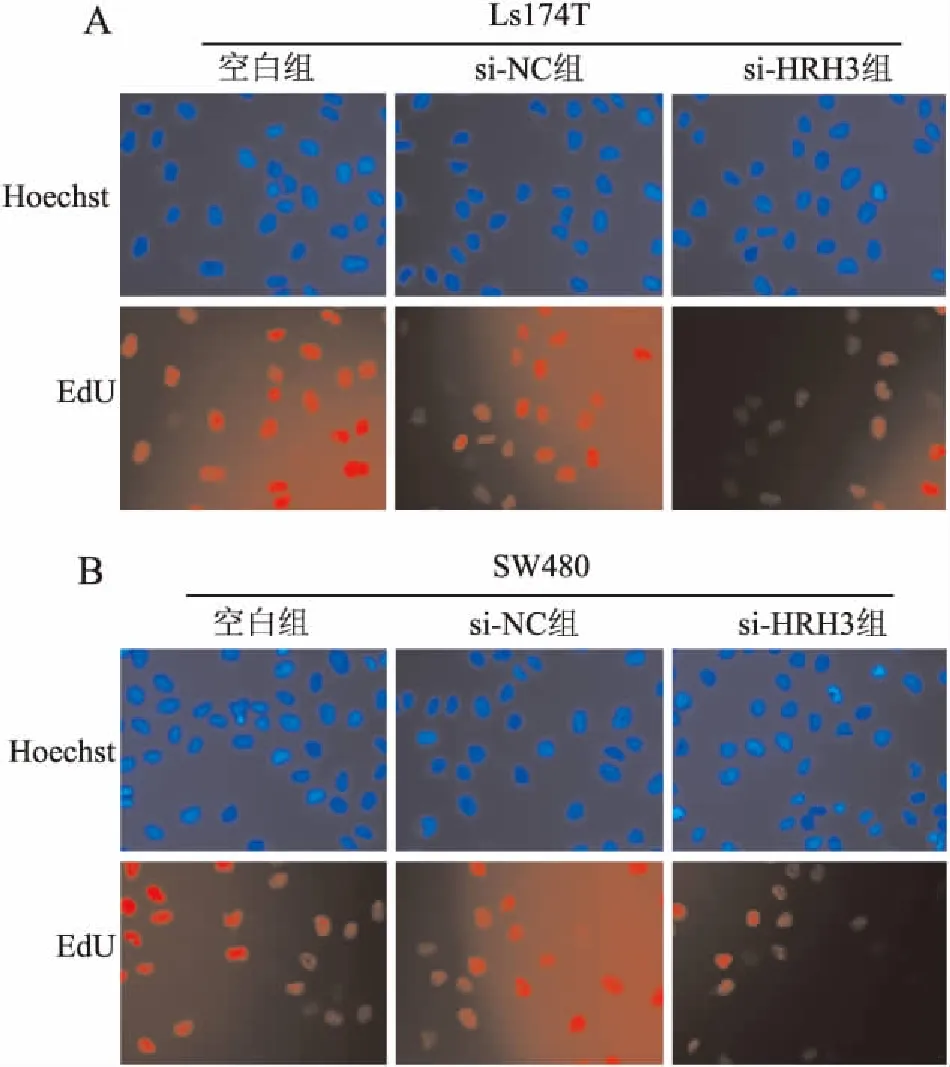
图4 沉默HRH3对结肠癌细胞增殖的影响:A.Ls174T细胞;B.SW480细胞
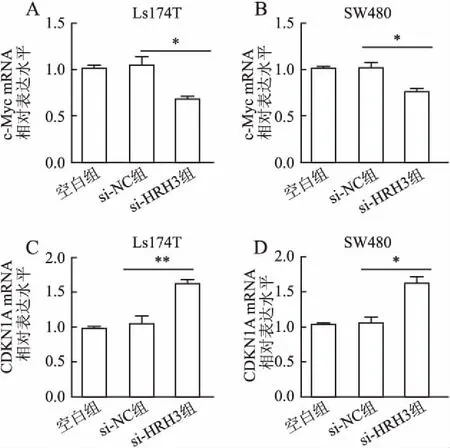
图5 沉默HRH3对c-Myc和CDKN1A mRNA表达的影响:A.Ls174T细胞中c-Myc mRNA的表达;B.SW480细胞中c-Myc mRNA的表达;C.Ls174T细胞中CDKN1A mRNA的表达;D.SW480细胞中CDKN1A mRNA的表达;*P<0.05,**P<0.01

图6 沉默HRH3对c-Myc和CDKN1A蛋白水平的影响**P<0.01
3 讨论
结肠癌是一种常见的消化系统肿瘤,2018年全球新增结肠癌109万余例,新增死亡55万余例,其发病率居所有恶性肿瘤第三位,病死率高居所有恶性肿瘤第二位[1]。肿瘤的发生、发展与肿瘤微环境密切相关[8]。肿瘤微环境是由肿瘤细胞、间质细胞和其它非细胞成分(包括细胞因子、趋化因子等生理活性物质)共同组成[8]。组胺作为肿瘤环境中的重要一员,由组氨酸脱氢酶催化L-组氨酸脱羧形成,主要储存于肥大细胞和嗜碱性粒细胞[3]。近年来,越来越多的研究证实,组胺和组胺受体在炎症和恶性肿瘤形成过程中发挥重要作用[9]。
HRH3表达异常与多种恶性肿瘤的发生、发展密切相关[5,7]。Lin等[7]报道HRH3在恶性胶质瘤中呈高表达,抑制HRH3能够显著抑制恶性胶质瘤细胞生长、侵袭和上皮-间质转化。Chen等[6]研究发现,抑制HRH3后前列腺癌的生长能力和侵袭活性减弱,细胞凋亡增加。本课题组前期研究发现,HRH3在肝细胞肝癌中呈显著高表达,且激活HRH3后,肝癌细胞的增殖和迁移能力显著升高[5]。与上述报道一致,本实验通过转染siRNA片段沉默HRH3表达发现,沉默HRH3后结肠癌细胞生长减慢,细胞增殖活性显著降低,提示HRH3在结肠癌的发生进展过程中发挥促癌作用。然而,Francis等[10]在胆管细胞型肝癌细胞中发现,HRH3激动剂能够显著抑制肝癌细胞生长,提示HRH3在胆管细胞型肝癌细胞中发挥抑癌作用。基于此,作者推测HRH3在不同类型恶性肿瘤的发生进展过程中发挥不同作用,其作用机制有待深入研究。
目前,HRH3促进恶性肿瘤增殖和迁移的作用机制尚未完全阐明。Lin等[7]在神经胶质瘤中发现,HRH3通过调控PI3K/Akt和MEK/ERK信号通路,影响上皮-间质转化关键分子的表达,如E-cadherin、ZO-1、vimentin和N-cadherin等,进而促进恶性胶质瘤细胞的侵袭转移。Francis等[10]报道,HRH3通过调控PKCα依赖的ERK1/2去磷酸化抑制胆管细胞型肝癌细胞生长,提示ERK信号通路参与HRH3介导的胆管细胞型肝癌细胞生长。PI3K/Akt、MEK/ERK等信号通路通过激活下游靶基因,如c-Myc、CDKN1A等,在促进细胞生存和细胞周期进展方面发挥重要作用[11-14]。c-Myc在多种恶性肿瘤中异常高表达,且c-Myc表达水平与肿瘤细胞恶性增殖活性密切相关[15]。本实验通过qRT-PCR和Western blot实验检测沉默HRH3后c-Myc的表达水平,结果显示,沉默HRH3后,c-Myc mRNA和蛋白水平均显著降低,提示HRH3可能通过激活c-Myc信号通路,促进结肠癌细胞恶性生长。
细胞周期失调是导致肿瘤细胞恶性增殖的一个重要始动因素[16]。Bai等[11]报道Akt通过调控CDK抑制因子CDKN1A,促进肿瘤细胞生存。本实验发现,沉默HRH3后,CDKN1A mRNA和蛋白水平均显著升高,提示HRH3可能通过调控CDKN1A表达水平,导致细胞周期紊乱,最终促进结肠癌细胞恶性增殖。然而,HRH3也能通过调控其它信号途径影响肿瘤细胞生存[6]。例如,Chen等[6]在前列腺癌细胞中研究发现,敲除HRH3后,雄激素受体(androgen receptor, AR)表达水平降低,提示HRH3可能通过AR途径抑制前列腺癌细胞生长、侵袭,促进细胞凋亡。上述研究结果提示HRH3可能通过激活不同信号通路,促进恶性肿瘤的发生、进展。
综上所述,沉默HRH3表达后,结肠癌细胞的增殖活性减弱,c-Myc表达降低,CDKN1A表达升高。基于此,推测HRH3可能通过调控c-Myc和CDKN1A转录表达,促进结肠癌细胞恶性增殖。但是,HRH3是如何调控c-Myc和CDKN1A表达,PI3K/Akt、MAPK/ERK等信号途径在HRH3介导的结肠癌细胞增殖过程中发挥怎样的作用,这些问题有待进一步深入探讨。
