响应面法优化大黄花鱼肉蛋白水解工艺及多肽抗氧化性研究
2020-07-20宁诗文崔珊珊尚宏丽
宁诗文,崔珊珊,尚宏丽
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
生物活性肽是对人体特定生理具有调节功能的多功能化合物总称[1]。生物活性肽中抗氧化肽具有清除体内自由基、提高免疫力等生理功能特性。其重要来源为植物源和动物源两类物质。海洋生物蛋白不但资源丰富而且优质,是生物活性肽重要来源之一。
大黄花鱼是我国主要经济鱼类[2]。大黄花鱼体色金黄,肉质鲜嫩,其优质蛋白含量高达7.6%,是宴席佳肴中的上品。大黄花鱼肉蛋白是酶解制备安全性高、价格低廉生物活性肽的优质原料。目前在我国,大黄花鱼以鲜食为主[3],产品的附加值低,蛋白利用率相对较低,这严重限制了大黄鱼养殖产业的发展,产量受到了一定影响,所以开展大黄花鱼肉蛋白精深加工和高附加值的生物活性肽生产尤为必要。近年来,有报道从鲤鱼[4]、金枪鱼[5]、罗非鱼[6]、鲢鱼[7]等多种水产品中水解制备抗氧化肽,但是对抗氧化肽进行SDS-PAGE鉴定分析和抗氧化功能同步研究很少。鱼蛋白制备抗氧化肽,蛋白类成分在水解过程中,其分子量大小、结构及抗氧化活性等品质和功效都可能受到一定影响,以往研究中鱼蛋白制备抗氧化肽未见相关报道。因此本研究从四种蛋白酶中,筛选出最佳蛋白酶,通过响应面法优化大黄花酶解工艺,同时对酶解产物利用SDS-PAGE电泳进行鉴定分析,并研究其酶解产物的抗氧化活性,旨在对大黄花鱼肉蛋白水解物制备天然安全抗氧化肽以及蛋白成分分析提供一定实验依据,同时也为大黄花鱼肉的高附加值开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
大黄花鱼 锦州市海鲜批发市场;碱性蛋白酶(20万U·g-1)、木瓜蛋白酶(10万U·g-1)、胃蛋白酶(1万U·mg-1)、中性蛋白酶(2万U·g-1) 浙江一诺生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH,为AR) 天津永大化工试剂有限公司;邻二氮菲、无水乙醇、三氯乙酸(TCA)、氯化钾(为AR) 天津市风船化学试剂科技有限公司;冰乙酸、甲醇(均为AR) 沈阳试剂厂;重蒸水、三蒸水 实验室自制。
FA1004电子天平 力辰科技;320型pH计 深圳市怡华新电子有限公司;HH-4数显恒温水浴锅 上海力辰邦西仪器科技有限公司;80-2高速离心机 江苏省金坛新瑞仪器制造有限公司;752型紫外分光光度计 上海恒平仪器有限公司;164-5050电泳仪 美国伯乐Bio-Rad。
1.2 实验方法
1.2.1 大黄花鱼肉蛋白酶解工艺 将新鲜的大黄花鱼去鳞、去皮、洗净沥干,取鱼肉,绞肉机绞碎成肉浆[8]。根据酶的最适pH配制磷酸盐缓冲液,放置于冰箱4 ℃冷藏,将冰磷酸盐溶液加入到鱼糜浆中,形成固液比为1∶2 (m/v)的大黄花鱼鱼肉蛋白悬浮液,加入一定量的蛋白酶进行酶解反应,调节恒温振荡水浴锅在一定的温度。酶解一定时间后,放置在90 ℃水浴10 min使酶失活,4000 r/min离心10 min,取上清液到EP管中待用[9],所得上清液即酶解液。


表1 酶解作用条件Table 1 Conditions of enzymatic hydrolysis

1.2.3.1 酶用量对大黄花鱼肉蛋白酶解效果的影响 称取25 g鱼糜,按1.2.1节的方法进行酶解。按照酶用量为0、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%分别加入到大黄花鱼肉蛋白悬浮液中,在pH7.0、酶解温度40 ℃、底物浓度20%、酶解时间6 h的条件下酶解。
1.2.3.2 酶解温度对大黄花鱼肉蛋白酶解效果的影响 称取25 g鱼糜,按1.2.1节的方法进行酶解。将酶解温度控制在40、45、50、55、60、65、70 ℃,在pH7.0、底物浓度20%、酶用量0.5%、酶解时间6 h的条件下酶解。
1.2.3.3 底物浓度对大黄花鱼肉蛋白酶解效果的影响 称取25 g鱼糜,按1.2.1节的方法进行酶解。将底物浓度控制在5%、10%、15%、20%、25%、30%,在pH7.0、酶用量0.5%、酶解时间6 h、酶解温度40 ℃的条件下酶解。
1.2.3.4 酶解时间对大黄花鱼肉蛋白酶解效果的影响 称取25 g鱼糜,按1.2.1节的方法进行酶解。在酶解时间0~10 h之间,pH7.0、底物浓度20%、酶用量0.5%、酶解温度40 ℃的条件下,每1 h取样一次。
1.2.4 Box-Behnken响应面优化酶解法工艺条件 选择酶解时间、酶解温度和底物浓度为三个自变量,以蛋白酶解液的还原力为响应值,对酶解法大黄花鱼肉蛋白工艺条件参数进行优化。试验因素水平编码如表2所示[11]。

表2 响应面试验的因素及水平设计Table 2 Factors and levels of response surface test
1.2.5 大黄花鱼肉蛋白酶解液指标测定
1.2.5.1 酶解液DH的测定 计算公式如下:
总氮量和游离氨基氮两指标测定分别采用GB 5009.5-2010凯氏定氮法[12]和GB/T 5009.39-2003甲醛滴定法[13]进行测定。

1.2.5.3 酶解液还原力分光光度法测定 实验分别配制0.2 mol/L,pH6.6磷酸盐缓冲液、1%铁氰化钾溶液;10%三氯乙酸溶液;0.1%的三氯化铁溶液。各取2.0 mL磷酸盐缓冲液、酶解液和铁氰化钾溶液混匀,50 ℃水浴反应20 min,然后加入2 mL 10%(w/v)三氯乙酸(TCA)溶液,混合均匀后以3000 r/min离心10 min后,取上清液1.0 mL,分别加入1.0 mL蒸馏水、0.5 mL三氯化铁溶液,室温下反应静置10 min,在700 nm处测定吸光值。以2.0 mL蒸馏水代替酶解液作为空白对照[15]。酶解液的吸光值越高,表示酶解液的还原力越强。
1.2.6 大黄花鱼肉蛋白酶解液SDS-PAGE分析 按1.2.1中酶解液的处理方法在优化得到的最优工艺下酶解。将酶解液与2×loading buffer 1∶1混合后置于1.5 mL离心管中,点样前沸水浴煮沸4 min。按照SDS不连续电泳法,用10%分离凝胶和5%浓缩凝胶进行试验,上样量为20 μL[16]。
1.2.7 大黄花鱼肉蛋白多肽的超滤分离及其分离组分体外抗氧化性测定
1.2.7.1 多肽的超滤分离 将上述最优工艺方法制备所得的大黄花鱼肉蛋白多肽经0.45 μm微孔滤膜过滤,并采用超滤膜超滤分离,截留的分子量为30、10、5 kDa。得到四个不同分子量组分为:YCP-Ⅰ(<5 kDa,Yellow Croaker Protein的缩写)、YCP-Ⅱ(5~10 kDa)、YCP-Ⅲ(10~30 kDa)、YCP-Ⅳ(>30 kDa),进行冷冻干燥。用蒸馏水分别配制浓度为5、10、15、20 mg/mL的多肽溶液,分别测定各组分DPPH自由基清除能力、还原力以及Cu2+的金属螯合能力。
1.2.7.2 自由基清除能力(DPPH·)的测定 将2 mL 0.1 mmol/L的DPPH-乙醇溶液与1 mL最优工艺下的酶解液混合,将混合物在室温下黑暗放置30 min,再于3500 r/min离心10 min,空白组用乙醇代替DPPH,对照组用蒸馏水代替样品[17],波长517 nm的吸光度读数为A1。
式中:A1是酶解液的吸光度;A2是空白组的吸光度;A3是对照组的吸光度。
1.2.7.3 还原力的测定 试验方法同1.2.5.3。
1.2.7.4 金属Cu2+螯合能力的测定 选取邻苯二酚紫(PV)作为对Cu2+进行螯合反应时的指示剂。取2 mmol/L CuSO4溶液l mL、1 mL 10%吡啶与20 μL 10% PV制成混合物,再加入1 mL大黄花鱼鱼肉蛋白酶解液,待溶液蓝色消失,在632 nm波长处测定吸光度值[18]。用蒸馏水代替样品为空白组。以螯合能力表示,计算公式为:

式中:A1为样品酶解液的吸光度;A2为空白组的吸光度。
1.3 数据处理
数据处理选用SPSS 21.0软件进行方差分析(ANOVA),P<0.05为差异性显著。所有指标检测均测定三次取平均值。
2 结果与分析
2.1 最适用酶的筛选结果


图1 四种蛋白酶对蛋白DH、酶解液 还原力以及清除力的影响Fig.1 Effects of four proteases on DH,reductive power of enzymatic hydrolysate and scavenging power
2.2 中性蛋白酶单因素实验结果

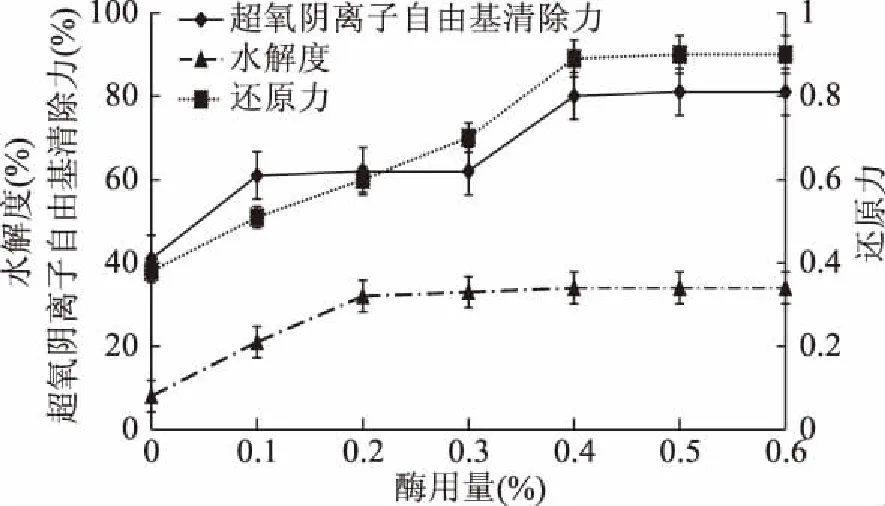
图2 酶用量对酶解效果的影响Fig.2 Effect of enzyme dose on enzymatic hydrolysis
2.2.2 酶解温度对大黄花鱼肉蛋白酶解效果的响 温度对酶的催化反应有很大影响,酶的较高催化活性只能维持在一定的温度范围内[22]。由图3可知,酶解温度在45 ℃时,三种指标出现最高值。在酶解温度60 ℃后,三个指标显著下降(P<0.05),说明酶的构象已经发生变化,酶活性降低导致与底物的反应效率降低。因此,选择45 ℃为适宜的酶解温度。

图3 酶解温度对酶解效果的影响Fig.3 Effect of hydrolysis temperature on hydrolysis effect


图4 底物浓度对酶解效果的影响Fig.4 Effect of substrate concentration on hydrolysis effect

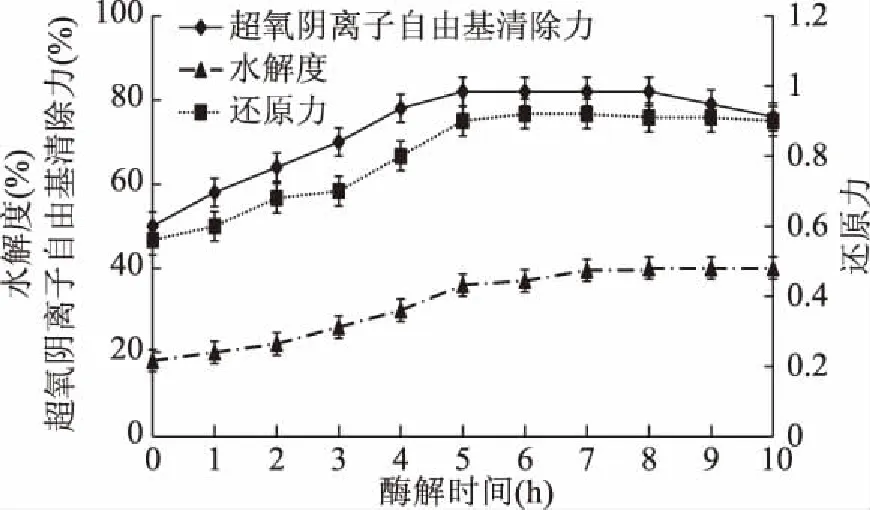
图5 酶解时间对酶解效果的影响Fig.5 Effect of enzymatic hydrolysis time on enzymatic hydrolysis effect
2.3 响应面对酶解工艺的优化试验结果
2.3.1 方差和回归分析 Box-Behnken试验设计的因素水平及结果如表3所示。

表3 响应面试验设计与结果Table 3 Experimental designs and results for response surface analysis
使用Design-Expert响应面设计软件,对因素和水平进行设计后,测定所有设定组响应值,拟合和优化出以响应值为函数的二次多元回归方程为:
Y=0.92+0.041A-0.017B+0.088C-0.027AB+0.063AC-6.750×10-3BC-0.089A2-0.031B2-0.11C2
许多研究表明,抗氧化剂的活性与其还原力呈正相关,因此常通过测定物质的还原力评估其潜在的抗氧化活性[24]。方程中,Y表示还原力预测值,A表示酶解时间编码值、B表示酶解温度编码值、C表示底物浓度编码值。
从表4的方差分析可以看出:模型的P<0.0001,说明以还原力建立的回归模型的显著性表现为极显著;失拟项(P=0.2954)不显著,说明回归方程拟合程度较高;调整回归系数R2=0.9868,表明回归方程模型建立合理;一次项A、C对还原力的影响极显著(P<0.01),B表现为显著(P<0.05);在交互作用中,AC表现为极显著(P<0.01),AB表现为显著(P<0.05);二次项A2、C2表现为极显著(P<0.01),B2表现为显著(P<0.05),综上所述,利用该模型来测酶解的时间、温度和底物浓度对还原力的影响是可行的。

表4 回归模型的方差分析Table 4 Analysis of variance for the fitted regression model
2.3.2 响应面图谱分析 三维图谱和等高线图能够更加直观地研究交互因素间的相互作用情况。绘制出响应面交互作用曲线图如图6~图8。

图6 酶解时间和酶解温度对酶解液还原力影响的三维曲面图和等高线图Fig.6 Response surface plot and contour plot of influence of hydrolysis time and hydrolysis temperature on reducing ability

图7 酶解时间和底物浓度对酶解液还原力影响的三维曲面图和等高线图Fig.7 Response surface plot and contour plot of influence of hydrolysis time and substrate concentration on reducing ability

图8 酶解温度和底物浓度对酶解液还原力影响的三维曲面图和等高线图Fig.8 Respouse surface plot and contour diagram of the effect of enzymatic hydrolysis temperature and substrate concentration on the reducing power of enzymatic hydrolysis solution
从图6中可以看出,等高线呈椭圆型,表明酶解温度与酶解时间两者交互作用显著。当酶解时间小于5 h时,等高线密集,表明酶解时间对还原能力影响显著(P<0.05);酶解时间曲线在6~7 h较为平稳,此时等高线稀疏,说明随着酶解时间的不断增加,影响还原力的值越来越小。
由图7可以看出,随着3D图变化趋势的剧烈增加,其颜色加深坡度变陡[25],表明酶解时间与底物浓度的交互作用显著(P<0.05)。酶解时间和底物浓度在0水平时,酶解液的还原力为较大值,并且保持不变;当酶水解时间和底物浓度低于0水平时,酶解液的还原能力随着两者的增加而增加,且上升趋势明显。
从图8可以看出,等高线在底物浓度大于20%时稀疏,而酶解温度在45 ℃左右的等高线密度平均,根据回归方程中交互项呈现显著性的情况,综合分析,二者与还原力的交互作用不明显。

2.4 大黄花鱼肉蛋白酶解液SDS-PAGE分析
大黄花鱼肉中蛋白质主要由肌球蛋白和肌动蛋白构成的肌原纤维蛋白组成[26]。大黄花鱼肉蛋白酶解液SDS-PAGE分析图如图9所示,图中各条泳道分别显示未酶解的鱼肉蛋白与加了中性蛋白酶处理后的鱼肉蛋白在1、3、5、7 h的蛋白分子量变化情况。泳道1为未酶解鱼肉全蛋白,其中肌原纤维蛋白中肌球蛋白和肌动蛋白分布在14~98 kDa之间,其中肌动蛋白约在42 kDa处、原肌球蛋白约在70 kDa处、肌球蛋白轻链分布在28 kDa之下,与李强等[27]报道鱼肉蛋白分子分布相似。酶解1 h,泳道2中蛋白分布与对照组全蛋白无明显变化,这说明大黄花鱼肌原纤维蛋白稳定性较好。酶解3和5 h后,泳道3和4中肌动蛋白部分亚基条带消失,表明大分子蛋白在酶水解过程中逐渐被水解成小分子蛋白,而酶解7 h后,泳道5中肌动蛋白部分完全消失,新增了一条约15 kDa蛋白条带和一条约6 kDa蛋白条带,原肌球蛋白水解为原肌球蛋白轻链分子量约27 kDa蛋白条带,这也说明大黄花鱼肌动蛋白酶解变性较肌球蛋白酶解变性快速。因此,随着时间增长,中性蛋白酶能够有效酶解大黄花鱼肉蛋白。

图9 SDS-PAGE电泳图Fig.9 SDS-PAGE electrophoresis figure注:M-标准蛋白;1-未酶解鱼肉全蛋白; 2-酶解1 h的鱼肉蛋白;3-酶解3 h的鱼肉蛋白; 4-酶解5 h的鱼肉蛋白;5-酶解7 h的鱼肉蛋白。
2.5 四个分离组分多肽的体外抗氧化活性
2.5.1 各组分多肽的DPPH·清除力 各组分多肽的DPPH·清除力如图10所示。各组分多肽均表现出一定的清除DPPH·能力,且都随着多肽浓度的增加而显著升高(P<0.05)。DPPH·清除力决定其抗氧化能力,且值越大表明该肽段的抗氧化能力越强[28]。分子量越小的肽段表现出的抗氧化能力越强。当多肽浓度为20 mg/mL时,YCP-Ⅰ(<5 kDa)其DPPH·清除力达到85.11%。
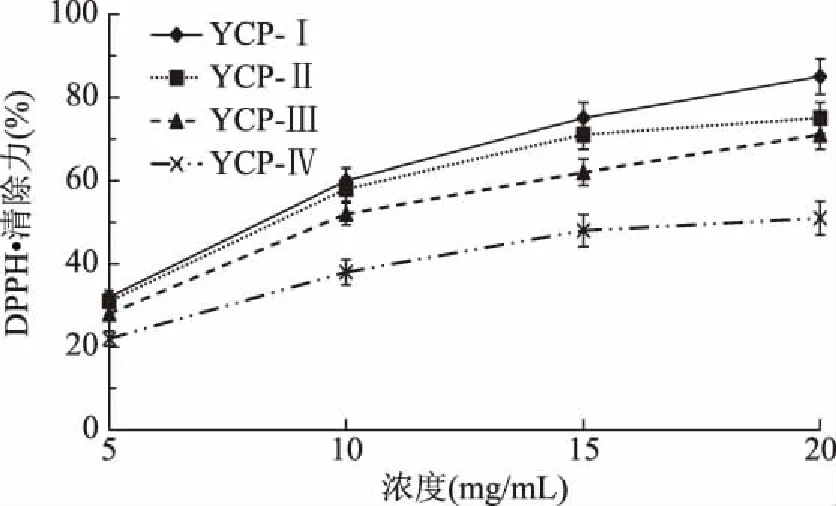
图10 四个不同分子量组分多肽的DPPH·清除力Fig.10 DPPH· scavenging power of four peptides with different molecular weight components
2.5.2 各组分多肽的还原力 由图11可知,各组分的还原力都随多肽浓度的增加而显著升高(P<0.05),且都具有一定的还原力。当多肽浓度为20 mg/mL时,YCP-Ⅰ(<5 kDa)的还原力为0.875,YCP-Ⅳ(>30 kDa)的还原力为0.371,说明分子量越小的肽段表现出的还原力越强。

图11 四个不同分子量组分多肽的还原力Fig.11 Reduction force of four peptides with different molecular weight components
2.5.3 各组分多肽鳌合Cu2+能力 由图12可知,随着多肽浓度的增大,各组分对Cu2+均有一定的螯合作用。这可能是由于对其起作用的组成肽协同效应的活动结果[29]。但是随着多肽浓度的增加,在5~10 mg/mL时各组分对Cu2+的螯合能力逐渐增强,在10~20 mg/mL之间鳌合能力增加不明显。这可能是因为,肽的裂解可以增强与金属离子的结合,因为酸性和碱性氨基酸的分支中羧基和氨基的浓度增加,从而从系统中去除预氧化金属离子。综合上述结果,多肽的抗氧化能力与其分子量密切相关,且分子量小的抗氧化活性高。

图12 四个不同分子量组分多肽鳌合Cu2+能力Fig.12 Cu2+binding ability of four polypeptides with different molecular weight components
3 结论

