禽蛋黄过敏原Gal d 6的重组表达、纯化鉴定
2020-07-20黄伦辉鲍会静张嘉懿李军普崔亚琼李柳栩刘运德李会强
黄伦辉,鲍会静,张嘉懿,李军普,崔亚琼,李柳栩,刘运德,李会强
(1.天津医科大学医学检验学院,天津 300203; 2.天津市南开医院医学诊断实验室,天津 300100; 3.天津市儿童医院检验科,天津 300074)
全世界已有超过10亿人患有过敏性疾病,预计于2050年患病人群将达到40亿[1]。鸡蛋过敏(HEA)是第二大类常见的食物过敏,婴儿患病率的比例高达9%,而其他主要食物过敏比例,如花生和芝麻分别为3%、0.8%[2-3]。食物过敏直接影响患者及其家人的生活质量,弱化了儿童对社会的融入感[4]。当过敏发生时,患者往往很快表现为轻度荨麻疹、恶心、腹痛和/或呕吐、更严重的呼吸窘迫、低血压/或死亡[5]。鸡蛋是许多食品和其他蛋制品中的主要成分,在人们日常饮食中很难避免鸡蛋[6]。
鸡蛋过敏原集中分布在蛋黄和蛋清上,蛋清过敏原、卵粘蛋白(OVM)(Gal d 1、约11%)、卵清蛋白(OVA)(Gal d 2、约54%)、卵转铁蛋白(Gal d 3,约12%)和溶菌酶(Gal d 4,约3%)已被确定为鸡蛋过敏的主要变应原[7-9],目前鸡蛋过敏的诊断基本只是基于蛋清蛋白。但已有9.1%被诊断为鸡蛋过敏的儿童通过食物口服激发试验证明了对轻微蛋清污染的蛋黄过敏[10],蛋黄过敏越来越受到人们的重视。血清白蛋白(Gal d 5)和YGP42(Gal d 6)是蛋黄的主要过敏原,Gal d 5 天然易获取而Gal d 6 天然蛋白难以获得[11-13]。最近大量研究表明被诊断为鸡蛋过敏的儿童对鸡蛋蛋黄是敏感的[14-16]。
单组分诊断(component-resolved diagnosis)即利用过敏单组分或重组表达的过敏原分子作为已知抗原来检测相应特异性IgE抗体(sIgE),与食物天然提取蛋白相比,可以有效减少混合抗原所产生的彼此干扰,避免杂蛋白引起的交叉反应,提高诊断价值,已应用于临床诊断中[17-18]。本文主要重组表达了蛋黄过敏原Gal d 6 蛋白,通过免疫学鉴定其过敏活性。这不仅对于禽蛋单组分诊断研究具有重要意义,同时也有利于禽蛋过敏的精细分化,禽蛋的摄入和过敏病程的管理[10]。
1 材料与方法
1.1 材料与仪器
质粒载体pET28a 购自安徽通用生物公司;BL21(DE3)感受态 由本实验室保存;质粒提取试剂盒、限制性内切酶XbaI,XhoI 均购自大连宝生物公司;镍柱(Invitrogen)、鼠抗人His单抗(sigma)、生物素标记的鼠抗人IgE抗体(Sigma)、HRP 标记的链霉亲和素(Sigma)等试剂 均购自上海生物工程股份有限公司;鸡蛋过敏阳性血清24例 临床诊断依据包括:典型的临床过敏史,血清总IgE>100 kU/L,鸡蛋sIgE>0. 35 kUA/L 等;阴性对照血清8 例 来自无任何鸡蛋过敏史的体检人群。
Gel Doc XR+凝胶成像仪、PowerPace Basic垂直电泳仪 Bio-rad;Allegra-64R低温高速冷冻离心机 Beckman;HHS-21-8恒温水浴锅 上海添时科学仪器;SYC-2102水平摇床 Crystal;DHP-9011电热恒温培养箱 上海一恒科学仪器;KS-250C超声破碎仪 宁波海曙科生超声设备有限公司;Synergy2多功能酶标仪 Bio-Tek。
1.2 实验方法
1.2.1 构建基因表达载体 通过NCBI网址查询获得蛋黄Gal d 6的基因序列(P87498,1628-1912 aa),由安徽通用生物公司合成该基因并构建重组质粒pET-28a-Gal d 6。将收到含有重组质粒的E.coliTop10进行增菌实验。培养条件是37 ℃,220 r/min过夜培养。
1.2.2 琼脂糖凝胶电泳 次日用质粒提取试剂盒提取质粒,将获取到的重组质粒进行XbaI/XhoI双酶切,(25 μL酶切体系:载体质粒8 μL,XbaI/XhoI各1 μL,10xBSA 2.5 μL,10X NEB Buffer 2.5 μL,H2O 10 μL)。然后调节2%胶浓度(0.2 g琼脂糖粉溶于20 mL的TAE溶液中),电压120 V,时间35 min,作琼脂糖凝胶电泳,安徽通用公司Sanger法测序。
1.2.3 基因的转化、诱导表达 将测序正确重组质粒转染感受态细胞BL21(DE3),挑取3个转化单一菌落分别接种于5 mL LB液体培养基(卡那霉素终浓度10 μg/mL),37 ℃,220 r/min振荡培养过夜;按1∶100的比例稀释过夜菌,转接50 μL过夜培养物于5 mL LB培养基中,37 ℃,220 r/min振荡培养至OD600 nm=0.6左右;取出1 mL不添加诱导剂作为对照组,试验组加入IPTG至终浓度1 mmol/L,37 ℃继续培养2 h。将对照组和实验组菌体离心,弃上清,重悬于100 μL PBS(pH7.4)缓冲液;冰浴条件下,超声波破碎大肠杆菌。将未诱导菌液,诱导全菌液、上清、沉淀与5倍上样缓冲液分别按比例混匀,沸水浴5 min,SDS-PAGE检测。
1.2.4 表达条件优化 目标蛋白主要在包涵体中表达,也存在可溶性表达。通过探索蛋白的表达条件,最终加大上清可溶性蛋白的含量,以便实现下一步实验的进行。所以设置不同的IPTG浓度、温度、诱导时间。最后确定表达条件进行纯化。
1.2.5 蛋白纯化 取100 μL binding buffer(50 mmol/L NaH2PO4,500 mmol/L NaCl,10 mmol/L咪唑,8 mol/L尿素,pH8.0)110 μL重悬的上清与镍柱在4 ℃混匀1 h,离心(3 min,4000 r/min)取上清液作为流出液F;加200 μL washing buffer(50 mmol/L NaH2PO4,500 mmol/L NaCl,20 mmol/L咪唑,8 mol/L尿素pH8.0),离心(3 min,4000 r/min)留取两次分别作W1,W2;再加50 μL Elution buffer(50 mmol/L NaH2PO4,500 mmol/L NaCl,250 mmol/L咪唑,8 mol/L尿素pH8.0),离心留取四次分别作E1、E2、E3、E4。作SDS-PAGE检测。所有步骤均在4000 r/min,3 min条件进行。
1.2.6 蛋白透析复性 根据纯化结果将收集的洗脱液E1E2E3E4加入到处理过的截留分子量是10 kD的透析袋中,扎紧透析袋两端;将透析袋整体浸没于2 L PBS缓冲液,在4 ℃条件下透析;换3次液后将样品取出。
1.2.7 测定复性蛋白浓度 将复性蛋白用BCA法测定浓度。利用标准品绘制标准曲线(Y=0.000588X+0.14(R2=0.984)),用透析液调零。按A液∶B液=50∶1,96孔板两个复孔每孔加10 μL蛋白和200 μL AB液,先加样品,尽量不要起泡,避光。37 ℃孵育30 min,于562 nm处检测验吸光度,得到相应浓度。
1.2.8 与过敏血清结合活性鉴定 用CBS(碳酸盐缓冲液)稀释Gal d 6蛋白浓度至0.5 μg/well作为包被质量并做复孔以减小误差,37 ℃水浴锅温浴3 h后,4 ℃过夜。用PBST洗板3次拍干,每孔加200 μL含 2%甘氨酸的聚乙烯醇(PVA),置37 ℃ 封闭2 h,用PBST洗3次拍干;用PBST将24份鸡蛋过敏患者血清和8份正常对照血清按1∶10稀释,100 μL/well,37 ℃孵育2 h,PBST洗涤五次拍干;每孔加100 μL 1∶2000稀释的HRP标记的抗人IgE,置37 ℃孵育1 h,PBST洗板5次后拍干;每孔加入HRP的底物A和B各50 μL,避光显色15 min。最后终止反应,用酶标仪检测OD450 nm。
将获得的纯化rGal d 6蛋白进行SDS-PAGE电泳,然后以250 mA、60 min电转至PVDF膜上,转膜完成后,用含2% BSA的TBST于37 ℃封闭2 h,封闭完用TBST漂洗3次,每次10 min;用含2% BSA的TBST稀释1∶50的鸡蛋过敏患者混合血清(取5个鸡蛋过敏阳性患者血清混合)于4 ℃孵育过夜;洗后,加入含2% BSA的TBST稀释的生物素标记的羊抗人IgE 抗体(1∶5000)和以含5% BSA的TBST稀释的HRP 标记的链霉亲和素(1∶50000),37 ℃孵育1 h,用TBST漂洗3次,每次10 min;最后用ECL曝光,检测rGal d6蛋白的免疫活性。
1.3 数据处理
用GraphPad Prism 6.0软件对ELISA结果进行统计分析。P值<0.05为统计学意义。
2 结果与分析
2.1 重组表达载体pET28a-Gal d 6的酶切、测序结果
图1A图是pET28a示意图,红色标出是酶切位点连接位置,前后各有一个His标签。将表达载体pET28a-Gal d6用XhoⅠ和XbaI进行双酶切鉴定,琼脂糖凝胶电泳结果显示第二列红色标注小片段与插入片段大小基本一致(图1B),将测序结果与标准序列比对基本一致,证明表达重组质粒pET28a-Gal d 6构建成功。

图1 表达载体pET28a-Gal d 6酶切鉴定Fig.1 Identification of pET28a-Gal d 6 plasmid digested with restriction enzyme
2.2 表达条件优化
为了提高目的蛋白的表达量,分别从培养时间,培养温度,诱导剂浓度进行优化。图2a、2b和2c是0.5、1、2 mmol/L IPTG浓度下,分别在25和37 ℃条件下进行1、2、4 h培养,红色框处为目的条带位置。固定诱导剂浓度,培养时间2 h最佳,培养温度是37 ℃略高于25 ℃,结合不同浓度和上清产量发现在0.5 mmol/L IPTG是最优诱导浓度。所以经优化最佳诱导条件是培养温度为37 ℃,IPTG浓度为0.5 mmol/L,培养时间为2 h。

图2 表达条件的优化Fig.2 Optimization of expression conditions注:M:Maker,B:未诱导全菌,T:诱导全菌,S:诱导菌体上清。 图a、b、c分别为IPTG浓度为0.5、1、2 mol/L的条件下,当温度为25、37 ℃时培养1、2、4 h时目的蛋的表达情况。
2.3 蛋白的表达纯化
根据SDS-PAGE,选取目的蛋白表达量最高的单克隆进行甘油保菌并进行接下来的实验。因为rGal d 6在pET-28a条件优化中虽在上清中表达量有所提高,仍以包涵体为主要存在形式,
所以采取变性再复性的方式进行纯化。图3为rGal d 6表达纯化的SDS-PAGE结果图。在34~43 kD有一明显单一条带就是目的条带,高纯度。通过抗His标签抗体鉴定复性后蛋白见图B,有单一条带,验证为目的蛋白。经BCA法定量,复性蛋白体积为2 mL,浓度为4.55 mg/mL,这是培养500 mL产生的蛋白,换成产率就是收获量每升菌液可收获重组蛋白约9.1 mg。

图3 重组蛋白Gal d6表达纯化SDS-PAGE分析结果Fig.3 SDS-PAGE analysis of recombinant protein Gal d6 expression and purification注:M:蛋白分子量maker;1:未诱导菌体; 2:诱导全菌;3:诱导菌体上清;4:F;5、6:W1,W2; 7、8、9、10:E1、E2、E3、E4;11:复性蛋白。
2.4 活性鉴定结果
为验证rGal d6的免疫学活性,以rGal d6为包被抗原,24例鸡蛋过敏患者单例血清中的sIgE为探针,进行ELISA检测,结果见图4。鸡蛋过敏患者血清组要高于正常阴性对照血清组,P值为0.0127<0.05有统计学意义。说明rGal d6可与鸡蛋过敏患者血清中的sIgE反应,阳性反应率达到68%。

图4 rGal d6与血清sIgE的反应性分析Fig.4 Reactivity analysis of rGal d6 and sera sIgE注:positive:鸡蛋过敏患者阳性血清; negative:非过敏人群血清。
将纯化复性后的重组蛋白与5例混合阳性血清反应,结果见图5。产生单一条带,证明表达蛋白具有免疫活性。
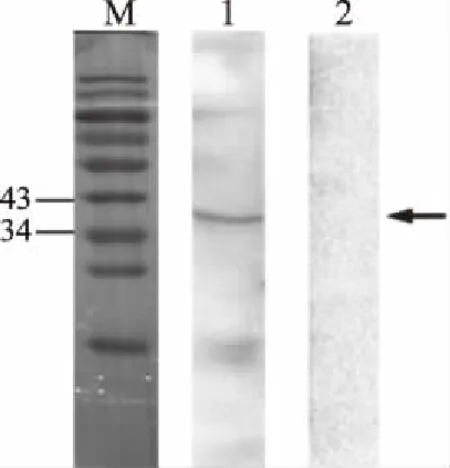
图5 rGal d 6 Western blot结果图Fig.5 Western blot analysis of recombinant protein Gal d 6注:M:蛋白分子量maker;1.阳性血清;2.阴性血清。
3 讨论与结论
因蛋黄脂类物质丰富,给蛋白纯化带来不小困难,故多年来禽蛋过敏原主要集中在蛋白或蛋清,直到S. Quirce和ALVARO AMO先后报道蛋黄的两个过敏原分别是Gal d 5和Gal d 6[19-20]。应用基因工程方法表达Gal d 5和Gal d 6 抗原[21-23],无论对深入研究蛋黄过敏原表位分析和致敏机制,还是对建立有效的蛋黄过敏sIgE抗体分子诊断方法[24],二者均是非常重要的,特别是对于婴幼儿禽蛋类过敏,准确鉴别蛋黄过敏、还是蛋清过敏,或二者同时过敏,从而选择食用鸡蛋特定部分,对确保营养和健康发育是十分重要的。
本文目的是制备Gal d 6重组蛋白,为建立蛋黄Gal d 6特异性IgE抗体方法提供优质抗原。Gal d 6是卵黄蛋白原-1(VTG-1)前体的C末端部分,在蛋黄中酶促裂解产生成熟蛋白[5]。实验结果显示本研究成功建立较高产量表达Gal d 6 工程菌,每升菌液可收集蛋白量达到9.1 mg,这为工业化制备Gal d 6蛋白具有重要意义。同时,免疫印迹结果显示目的蛋白与过敏血清显示特异性条带;且ELISA结果显示,此蛋白与鸡蛋过敏患者血清阳性反应率高达68%。此结果也说明并非所有禽蛋过敏患者显示对Gal d 6蛋白过敏。总之,本文结果证实重组Gal d 6 具有一定生物活性,可以为建立Gal d 6 sIgE抗体分子检测方法奠定基础,以及对鸡蛋过敏的精细分化,鸡蛋的摄入和过敏进程的管理非常重要。
