基于p38MAPK/Nrf2/HO-1 通路探讨清达颗粒对脂多糖诱导活化的小胶质细胞抗氧化作用研究
2020-07-1723蔡巧燕23沈阿灵2褚剑锋23彭军23
23蔡巧燕23沈阿灵2褚剑锋23彭 军23
高血压是最为常见的心脑血管疾病,它是威胁人类生命健康的重要疾病之一,也是损害人体重要靶器官如心、脑、肾等的元凶。研究表明,在高血压状态下,脑部会出现不同程度的出血性或缺血性损伤等高血压并发症[1],在发生损伤时,体内或细胞内自由基和丙二醛等有害化学基团迅速增多,导致线粒体功能障碍,加重细胞兴奋毒性,促进神经元脂质、蛋白质和 DNA过氧化损伤和炎症反应[2],并进一步造成细胞损伤和坏死以及脑血管病变,最终对大脑皮层造成损伤[1]。因此,抗氧化损伤是防治由高血压引起的脑损伤并发症的重要措施之一。通过抗氧化治疗清除由于脑损伤增多的自由基,并抑制其生成从而减轻活性氧(ROS)在脑内蓄积引起的细胞毒性反应[3],生成抗氧化物质来防御神经元脂质、DNA和蛋白质造成的氧化损伤,起到保护神经细胞的作用,进而减轻脑组织损伤[4]。p38MAPK/Nrf2/HO-1通路被证实与诸多器官的抗氧化应激损伤有关,该通路的下游产物血红素加氧酶(HO-1)是经典的抗氧化剂酶,具有良好的抑制氧化应激及炎症的作用[5]。
清达颗粒(QDG)是由陈可冀院士运用几十年的临床经验方清眩降压汤化裁而成,由天麻、钩藤、黄芩、莲子心4味药物组成,具有清肝热、平肝阳、泄心火之功效。有研究表明清达颗粒可有效控制自发性高血压大鼠血压对心、肾等靶器官的损害[6]。而方中单味药的有效成分如天麻素、黄芩苷、异钩藤碱等均可对细胞炎症反应及氧化损伤有一定的抑制功效[7-10],甲基莲心碱亦对神经细胞有明确的抗氧化应激功效[11]。但是目前对清达颗粒本身潜在的抗氧化应激功效研究尚不充分。本研究拟通过脂多糖(LPS)诱导小鼠脑小胶质细胞株构建细胞炎症反应模型,观察清达颗粒对炎症细胞抗氧化应激的影响,并探究其对p38MAPK/Nrf2/HO-1信号转导通路活化的影响。
1 材料与方法
1.1 药物与细胞株 清达颗粒是由天麻12 g、钩藤10 g、黄芩6 g、莲子心5 g配伍制成的颗粒制剂,由江阴天江药业有限公司生产,批号:CKJ2017001;小鼠小胶质细胞株BV-2,购自中国科学院上海生命科学研究院细胞资源中心。
1.2 实验试剂 RPIM 1640培养基、胎牛血清、EDTA-0.25%胰蛋白酶、双抗(青-链霉素混合液),美国Hyclone公司;LPS,美国Sigma公司;MTT粉末,美国Sigma公司;ROS、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒,南京建成生物科技有限公司;细胞核蛋白质提取试剂盒,生工生物工程股份有限公司;BCA蛋白浓度测定试剂盒,碧云天生物技术公司;p-p38(4511S)、p38(8690S)、TBP(8515S),美国CST公司;Nrf2(16396-1-AP)、HO-1(10701-1-AP),美国proteintech公司;小鼠/大鼠肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号VAL609),NOVUS公司;p38MAP激酶抑制剂(LY2228820,货号A5566),Apexbio公司。
1.3 实验仪器 细胞培养箱、超微量高精度紫外/可见光分光光度计,美国Thermo公司;CaryEclipse荧光分光光度计,美国Varian公司;超净工作台,苏州市安泰仪器设备有限公司;EK800酶标仪,美国基因有限公司;蛋白电泳仪,美国Bio-Red公司。
1.4 清达颗粒母液的制备 称取清达颗粒粉末5 mg,加入磷酸缓冲盐溶液(PBS)溶液至1 mL,置于超声仪器溶解30 min,获得浓度为5 mg/mL的清达颗粒母液,放置于-20 ℃冰箱中保存待用。
1.5 BV-2细胞培养与传代 BV-2小鼠小胶质细胞贴壁培养于含10%胎牛血清(FBS)、1%双抗的RPMI-1640,置于含5%二氧化碳(CO2)、37 ℃恒温培养箱中培养,隔天更换培养液。每隔2 d传代,待细胞处于对数生长期时用于实验。
1.5.1 MTT法检测不同浓度LPS对BV-2细胞的细胞活力影响 BV-2细胞以每孔1.5×105个密度,每孔100 μL,接种于96孔板。在37 ℃、5%CO2培养箱培养18 h,吸去上清液,换成空白培养基孵育4 h。吸去上清液后加入含有LPS (1 μg/mL、3 μg/mL、5 μg/mL、10 μg/mL)的完全培养基,空白对照组则加入完全培养基,继续孵育24 h后,吸去上清液 ,每孔加入0.5 mg/mL MTT 溶液100 μL。37 ℃ 继续培养4 h,弃去上清液,每孔加入100 μL 二甲基亚砜(DMSO)充分振荡 10 min 溶解结晶,用酶标仪在570 nm 处测定吸光度。
1.5.2 MTT法检测不同浓度清达颗粒对BV-2细胞的细胞活力影响 BV-2细胞以每孔1.5×105密度,每孔100 μL,接种于96孔板。在37 ℃、5% CO2培养箱培养18 h,吸去上清液,换成空白培养基孵育4 h。吸去上清液后加入含有清达颗粒(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL、250.00 μg/mL、500.00 μg/mL)的完全培养基中,空白对照组则加入完全培养基中,继续孵育24 h后,吸去上清液,每孔加入0.5 mg/mL MTT 溶液100 μL。37 ℃ 继续培养 4 h,弃去上清液,每孔加入100 μL DMSO 充分振荡 10 min 溶解结晶,用酶标仪在570 nm 处测定吸光度。
1.5.3 MTT法检测清达颗粒对LPS干预的BV-2细胞的细胞活力影响 根据实验结果,选择1 μg/mL LPS以及31.25 μg/mL、62.50 μg/mL、125.00 μg/mL 3个浓度的QDG溶液进行干预实验。BV-2细胞以每孔1.5×105密度,每孔100 μL,接种于96孔板。在37 ℃、5%CO2培养箱培养18h,吸去上清液,换成空白培养基孵育4h。吸去上清液后分别加入清达颗粒(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)和/或1 μg/mL LPS,还有一组加入完全培养基作为空白对照组,继续孵育24 h后,吸去上清液,每孔加入0.5 mg/mL MTT 溶液100 μL。37 ℃ 继续培养 4 h,弃上清液,每孔加入100 μL DMSO 充分振荡 10 min 溶解结晶,用酶标仪在570 nm 处测定吸光度。
1.5.4 ROS含量检测 分为空白对照组,模型组(LPS 1 μg/mL),给药组包括LPS 1 μg/mL+QGD 31.25 μg/mL组、LPS 1 μg/mL+QGD 62.50 μg/mL组、LPS 1 μg/mL+QGD 125.00 μg/mL组,每组3个复孔。将细胞等密度地接种至12孔板中,每孔1 mL,密度大约为 1.5×105个/孔,置于恒温箱继续培养18 h后,将培养基更换为无血清的培养基饥饿4 h,弃去上清液,按照分组加药孵育23 h 30 min,将 12 孔板中的培养基换为含有10 μmol/LDCFH-DA 的PBS继续孵育30 min,之后将PBS吸出,使用胰酶消化细胞,加入培养基终止消化,制成细胞悬液,离心5~10 min收集细胞,用PBS洗涤1次或2次,离心收集细胞沉淀物用PBS重悬后用于荧光分光光度计检测。最佳激发波长485(500±15) nm,最佳发射波长525(530±20) nm。
1.5.5 ELISA检测细胞上清液中TNF-α浓度 分为空白对照组、模型组(LPS 1 μg/mL)、给药组不同剂量亚组即LPS 1 μg/mL+QGD 31.25 μg/mL组、LPS1 μg/mL+QGD 62.50 μg/mL组、LPS 1 μg/mL+QGD 125.00 μg/mL组,每组3个复孔。等密度接种至12孔板,置于恒温箱继续培养18 h 后将培养基更换为空白培养基饥饿4 h,弃去上清液,按照分组加药孵育24 h,吸取上清液,转移至对应的1.5 mL离心管中,按照ELISA试剂盒说明对样本进行处理后采用酶标仪进行读数(波长450 nm),再根据试剂盒提供的换算公式得出结果。
1.5.6 MDA含量测定 分为空白对照组,模型组(LPS 1 μg/mL),给药组(LPS 1 μg/mL+QGD 31.25 μg/mL组、LPS1 μg/mL+QGD 62.50 μg/mL组、LPS 1 μg/mL+QGD 125.00 μg/mL组),每组3个复孔。将细胞等密度地接种至12孔板中,置于恒温箱继续培养18 h 后将培养基更换为无血清的培养基饥饿4 h,弃去上清,按照分组加药孵育24 h,吸取上清液,转移至对应的1.5 mL离心管中,按照试剂盒说明对样本进行处理后采用酶标仪进行读数(波长532 nm)。计算公式为细胞上清液中MDA含量=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度×样本测试前稀释倍数。
1.5.7 GSH-Px含量测定 按空白对照组、模型组(LPS 1 μg/mL)、给药组(LPS 1 μg/mL+QGD 31.25 μg/mL组、LPS1μg/mL+QGD62.50μg/mL组、LPS1 μg/mL+QGD 125.00 μg/mL组)分为5组,每组3个复孔。将细胞等密度地接种至12孔板中,置于恒温箱继续培养18 h 后将培养基更换为无血清的培养基饥饿4 h,弃去上清液,按照分组加药孵育24 h ,吸取上清液,转移至对应的1.5 mL离心管中,按照试剂盒说明对样本进行处理后采用酶标仪进行读数(波长412 nm)。计算公式:培养上清液中GSH-Px活力单位=(非酶管OD值-酶管OD值)/(标准管OD值-空白管OD值)×标准管浓度(20 μmol/L)×稀释倍数×样本测试前稀释倍数。
1.5.8 Western Blot法检测 Nrf2、细胞核内Nrf2、p38、p-p38、HO-1蛋白表达及p38抑制剂(LY2228820)干预LPS诱导的BV-2细胞后HO-1蛋白的表达情况 细胞铺板后汇合度至40%~50%时,吸去上清液,换成空白培养基饥饿4 h,之后将清达颗粒母液(5 mg/mL)化冻后依照实验目的用完全培养基分别稀释至31.25 μg/mL、62.50 μg/mL、125.00 μg/mL 3个干预浓度,并按组分别换液,另外,空白对照组及LPS组则用完全培养基换液,每组3个复孔。再加入QDG 12 h后,除空白对照组外每孔分别加入20 μL脂多糖母液(1 mg/mL)。检测p38、p-p38、Nrf2、HO-1以及细胞核内Nrf2指标的细胞均继续孵育12 h。后用NP-40蛋白裂解液裂解细胞,每5 min震荡1次,裂解15 min,4 ℃下14 000 r/min离心20 min,吸取上清液获取总蛋白。核蛋白则采用细胞核蛋白提取法提取,之后根据BCA蛋白定量结果上样。95 ℃变性5 min,SDS-PAGE 凝胶电泳,湿法转膜,5%脱脂奶粉封闭1 h ,4 ℃一抗孵育过夜,TBST洗5 min×3次,室温孵育二抗1 h,TBST洗5 min×3次,曝光显影,采用 BIO-RAD Image Lab 软件进行灰度值分析。

2 结 果
2.1 不同浓度LPS对BV-2细胞的细胞活力影响 LPS浓度处于1 μg/mL及以下时对 BV-2 细胞不造成毒性,可在此浓度范围内用于后续细胞实验的干预。LPS组(3 μg/mL、5 μg/mL、10 μg/mL)BV-2细胞的细胞活力分别为(85±4)%、(72±2)%、(70±6)%,与空白对照组(100±6)%比较均下降,差异有统计学意义(P<0.05),LPS浓度为1 μg/mL时细胞活力为(91±7)%,与空白对照组比较差异无统计学意义(P>0.05)。详见图1。

与空白对照组比较,*P<0.05。图1 不同浓度LPS对BV-2细胞的细胞活力影响
2.2 不同浓度清达颗粒对BV-2细胞的细胞活力影响 清达颗粒浓度处于125 μg/mL及以下时对BV-2细胞不造成毒性,可在该浓度范围内用于后续细胞实验的干预。清达颗粒组(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)BV-2细胞的细胞活力分别为(100±5)%、(98±10)%、(92±3)%,与空白对照组细胞活力(100±3)%相比差异无统计学意义(P>0.05)。QDG250.00 μg/mL组、500.00 μg/mL组细胞活力分别为(84±7)%、(68±2)%,与空白对照组比较下降,且差异有统计学意义(P<0.05)。详见图2。

与空白对照组比较,*P<0.05。图2 不同浓度清达颗粒对BV-2细胞的细胞活力影响
2.3 清达颗粒对LPS干预的BV-2细胞的细胞活力影响 LPS(1 μg/mL)与清达颗粒(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)共同干预时对BV-2细胞不造成毒性。LPS组的BV-2细胞活力为(106±3)%,与空白对照组细胞活力(100±2)%比较,差异无统计学意义;LPS+QDG组(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)细胞活力分别为(107±2)%、(122±2)%、(109±3)%,与LPS组相比差异无统计学意义,LPS+QDG 62.5 μg/mL组与空白对照组比较差异有统计学意义(P<0.05)。详见图3。

与空白对照组比较,*P<0.05。
2.4 清达颗粒对LPS干预的BV-2细胞中ROS含量影响 LPS组BV-2细胞中ROS荧光强度与空白对照组比较升高(P<0.01);LPS+QDG(31.25 μg/mL、62.50 μg/mL)组与LPS组相比下降(P<0.01)。详见图4。

与LPS组比较,*P<0.01;与空白对照组比较,#P<0.01。 图4 清达颗粒对LPS干预的BV-2细胞中释放的ROS荧光强度
2.5 清达颗粒对LPS干预的BV-2细胞上清液中TNF-α浓度影响 LPS组BV-2细胞上清液中TNF-α浓度与对照组比较升高(P<0.01);LPS+QDG组(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)与LPS组相比下降(P<0.01)。详见表1。


组别样本量(份)TNF-α浓度(pg/mL)MDA(nmol/mL)GSH-Px活力单位空白对照组3326.00±6.121.30±0.3017.07±1.22LPS组31 428.00±12.12②2.00±0.02①11.38±1.41①LPS+QDG 31.25 μg/mL组3 985.10±50.01④1.33±0.20③8.33±3.35LPS+QDG 62.50 μg/mL组3909.34±8.87④1.26±0.11③20.32±5.63④LPS+QDG 125.00 μg/mL组3849.74±8.34④1.89±0.2519.51±3.22④
与空白对照组比较,①P<0.05,②P<0.01;与LPS组比较,③P<0.05,④P<0.01。
2.6 清达颗粒对LPS干预的BV-2细胞上清液中MDA含量的影响 LPS组的BV-2细胞上清液中MDA含量与空白对照组比较升高(P<0.05);LPS+QDG(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)组与LPS组相比均下降(P<0.05)。详见表2。
2.7 清达颗粒对LPS干预的BV-2细胞中GSH-Px含量的影响 LPS组的BV-2细胞上清液中GSH-Px活力单位与空白对照组比较降低(P<0.05);LPS+QDG组(62.50 μg/mL、125.00 μg/mL)与LPS组相比上升(P<0.01)。详见表3。
2.8 清达颗粒对LPS干预的BV-2细胞的Nrf2、细胞核内Nrf2、p38、p-p38、HO-1蛋白表达的影响以及p38抑制剂作用下清达颗粒干预LPS诱导的BV-2细胞HO-1蛋白表达的影响 LPS组BV-2细胞中p-p38蛋白的表达与空白对照组比较下降(P<0.05);LPS+QDG组(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)与LPS组相比上升(P<0.05)。详见图5。
LPS组BV-2细胞核中Nrf2蛋白的表达与空白对照组比较降低(P<0.05);LPS+QDG组(31.25 μg/mL、125.00 μg/mL)与LPS组相比上升(P<0.05)。详见图6。
LPS组BV-2细胞中HO-1蛋白的表达与空白对照组比较降低(P<0.05);LPS+QDG组(31.25 μg/mL、62.50 μg/mL、125.00 μg/mL)与LPS组相比上升(P<0.05)。详见图7。
LPS组的BV-2细胞中HO-1蛋白表达与空白对照组比较降低(P<0.05);LY2228820+LPS组的BV-2细胞中HO-1蛋白表达与LPS组比较降低(P<0.05);LY2228820+LPS+QDG(62.50 μg/mL)组与LPS+QDG(62.50 μg/mL)组相比下降(P<0.05);LY2228820+LPS+QDG(62.50 μg/mL)组与LY2228820+LPS组相比明显升高(P<0.05)。详见图8。
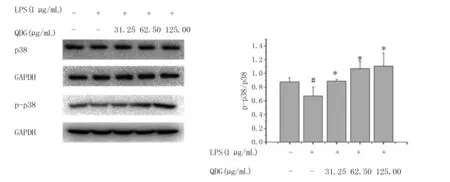
与LPS组比较,*P<0.05;与空白对照组比较,#P<0.05。 图5 清达颗粒对LPS干预的BV-2细胞中p38、磷酸化p38蛋白表达的影响
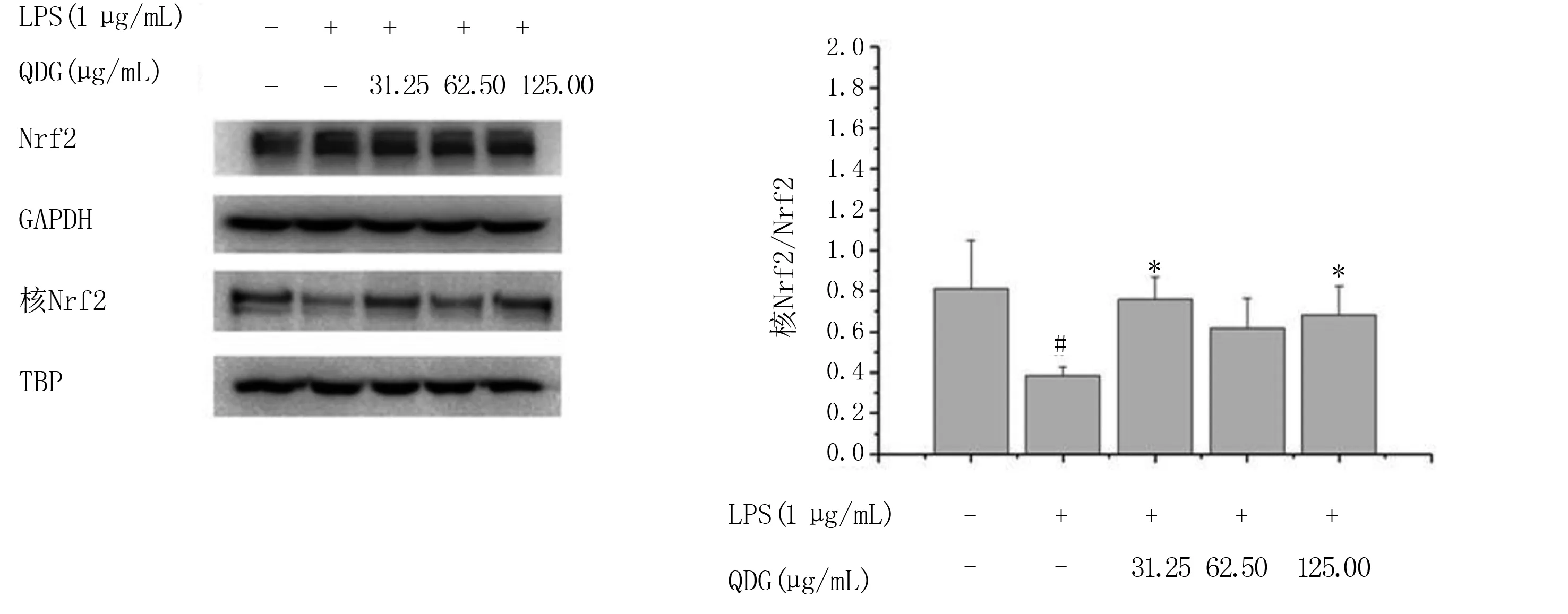
与LPS组比较,*P<0.05;与空白对照组比较,#P<0.05。图6 清达颗粒对LPS干预的BV-2细胞中Nrf2以及细胞核中Nrf2蛋白表达的影响

与LPS组比较,*P<0.05;与空白对照组比较,#P<0.05。图7 清达颗粒对LPS干预的BV-2细胞中HO-1蛋白表达的影响
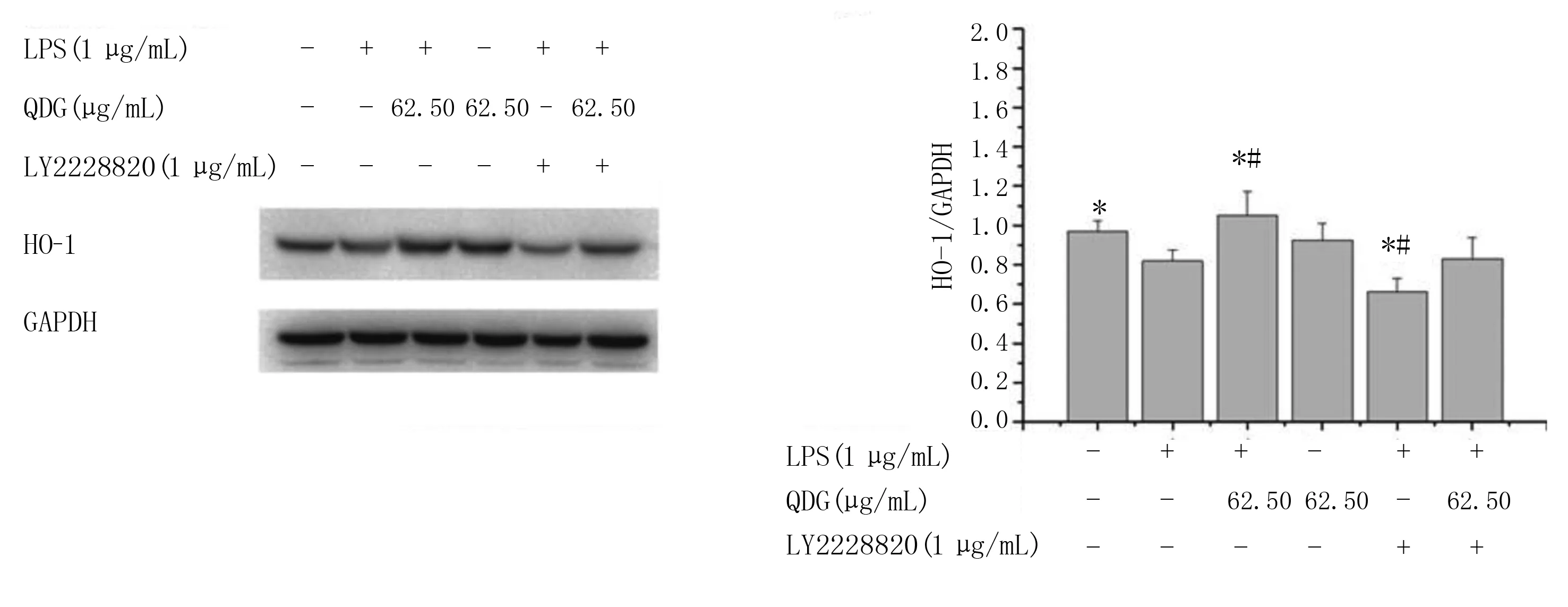
与LPS组比较,*P<0.05;与空白对照组比较,#P<0.05。 图8 p38抑制剂干预后清达颗粒对LPS干预的BV-2细胞中HO-1蛋白表达的影响
3 讨 论
高血压可引起多种靶器官损害,高血压性脑损伤即为其诸多并发症之一。近年来研究表明,当人体处于高血压状态下,体内会释放更多的ROS,产生大量自由基、脂质过氧化物等有害化学基团,机体无法及时清除它们,氧化代谢平衡被打乱,从而进入氧化应激状态[12]。脑部相较其他器官此种现象更为严重[13],脑内神经细胞因有害化学基团堆积而产生细胞毒性,构成细胞的物质如脂质、蛋白、DNA、RNA出现损伤,线粒体功能出现障碍,造成细胞损伤和坏死,进而损伤神经及脑血管,最终可造成大脑皮层的损害[1]。不仅如此,因高血压所释放的ROS也会激活如p53、NF-κB等多种信号通路导致细胞凋亡[14]。由此可见,高血压所致的氧化应激损伤是造成脑损伤的重要原因之一。
小胶质细胞是脑内的一种神经胶质细胞。当高血压等疾病造成脑内ROS大量释放时,小胶质细胞会因其刺激过度活化,释放大量氧自由基等有害化学基团以及大量有神经毒性的炎症介质,加重炎症及氧化应激,形成恶性循环,加剧颅脑损伤[15]。因此,本研究中将小胶质细胞作为研究对象,通过抗氧化治疗避免小胶质细胞过度活化,进而减轻脑损伤。
清达颗粒可有效控制自发性高血压大鼠血压,并减轻其靶器官损害的功效已被证实。褚剑锋等[6]研究表明,自发性高血压大鼠经清达颗粒灌胃3周后血压已明显低于对照组,8周后肾小球固缩、心肌纤维肿胀等靶器官损伤均有显著改善。杨美玲等[16]研究指出清达颗粒可降低血管紧张素Ⅱ(AngⅡ)诱导的高血压小鼠血压,并改善其肾脏损伤。除此之外,清达颗粒中单味药的有效成分如天麻素、黄芩苷、异钩藤碱等对LPS诱导的细胞炎症反应及氧化损伤也有一定的抑制功效[7-10]。而莲子心的有效成分甲基莲心碱可减轻高糖培养的肾小管上皮细胞氧化应激损伤[11]。但是目前对清达颗粒本身潜在的抗炎、抗氧化应激功效尚未被广泛研究。因此,本课题选用BV-2小鼠小胶质细胞系,采用LPS构建细胞炎症反应模型,观察清达颗粒对炎症细胞抗氧化应激的影响。实验结果表明清达颗粒可以显著抑制活化的小胶质细胞释放如ROS、TNF-α及MDA等细胞毒性物质,并一定程度促进抗氧化酶如GSH-Px的产生及释放,起到了抗氧化应激的作用。
中草药作为抗氧化剂清除自由基对抗氧化应激及炎症损伤的报道屡见不鲜,不仅如此,部分中草药的有效成分可通过激活抗氧化信号通路,生成内源性抗氧化酶以抑制氧化应激损伤。其中p38MAPK/Nrf2/HO-1信号传导通路被证实与脑等重要器官的抗氧化应激损伤有关,该通路的激活减轻了氧化应激带来的损伤,进而保护了脑等重要脏器[17]。在氧化应激时,产生的ROS经由p38MAPK信号通路使稳定状态下的转录因子Nrf2磷酸化,解除与keap-1的结合而转位至细胞核,在细胞核与一种重组蛋白形成异二聚体并同抗氧化元件相结合,从而启动HO-1基因的转录。HO-1是经典的内源性抗氧化酶,具有良好的抑制氧化应激及炎症的作用,而该信号通路除了具有保护重要脏器的作用外,还对神经系统有保护作用[5]。该通路是否是清达颗粒抗氧化作用可能的干预通路目前尚未被研究证实。本实验研究发现清达颗粒可促使活化的BV-2细胞内 p38 蛋白磷酸化,转位进入细胞核的Nrf2增多,并产生更多的 HO-1。除此之外,运用 p38MAPK 激酶抑制剂(LY2228820)进行干预后HO-1蛋白的表达量明显减少。本实验结果表明清达颗粒可能通过 p38MAPK/Nrf2/HO-1信号转导通路起到一定程度的抗氧化应激作用。此外,清达颗粒还可能作用于其他 MAPK 信号通路或其他抗氧化信号通路和靶点,进而诱导HO-1基因表达。
目前清达颗粒对脑细胞氧化应激调控是否存在其他作用靶点或信号通路仍值得继续研究,本实验为进一步阐明清达颗粒对脑细胞氧化应激的调控机制以及清达颗粒对高血压靶器官保护提供了一定的实验依据。
