IKKα对缺血再灌注损伤小鼠的保护作用及其对M1与M2型巨噬细胞的影响
2020-07-17波1张金盈
陈 波1,张金盈,马 平
心肌缺血再灌注(IR)损伤被认为是以自身免疫反应为特征的炎性疾病[1]。核转录因子-κB(NF-κB)超家族核转录因子参与免疫细胞的分化以及多种细胞(包括心肌细胞)的炎症反应[2]。研究表明,NF-κB在急性缺血再灌注损伤期间具有心脏保护作用,延迟激活NF-κB可增强肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)和白细胞介素-6(IL-6)的表达从而诱发慢性炎症[3]。IKK复合物是NF-κB信号通路的中枢调节因子,IKKα是IκB激酶(IKK)复合物的主要成员,研究显示,IKKα对于巨噬细胞表型的活化有显著影响,并且当巨噬细胞缺乏IKK时趋向于分泌促炎因子[4]。因此,探讨IKKα在心肌I/R损伤中的作用以及在心肌IR过程中IKKα对巨噬细胞表型的影响尤为重要。本研究采用IKKα条件性基因敲除小鼠探讨IKKα对缺血再灌注损伤小鼠的保护作用,以及IKKα在心肌I/R损伤后对M1/ M2巨噬细胞的极化作用。
1 材料与方法
1.1 药品与试剂 兔抗小鼠诱导型一氧化氮合酶(iNOS,Boster PB0283)、抗表型标记物(Arg1,Bioss bs-0465R)、抗IL-1β(Bioss bs-4947R)等一抗、tublin抗体均购自美国Cayman Chemical公司;抗辣根酶标记山羊抗兔 IgG(生产批号: ZB-2303)购自北京中杉金桥公司;PV-6000免疫组化试剂盒及DAB显色液均购自北京中杉生物技术有限公司。
1.2 实验仪器 彩色多普勒超声心动图仪(GE Vivid 7,USA),生理记录仪及RM6280多导生物信号处理系统(浙江医科大学医疗仪器实验厂);光学显微镜及其成像系统(LEICA DMIRB,Germany);漩涡混匀器(德国LEICA公司);Shan-don325 型石蜡切片机(英国Shandon公司);Genios多功能酶标仪购自瑞士Tecan公司;BIO-RAD电泳、转膜系统购自美国BIO-RAD公司;ChemiDoc TM XRS+凝胶成像仪器购自美国BIO-RAD公司。
1.3 实验动物 C57BL/6-IKKα条件性基因敲除小鼠(mIKKα-/-)为mIKKα-/-组,同窝出生的年龄、性别匹配的小鼠IKKαflox/flox,6~8周,体质量为20~25 g作为对照,记为IKKαflox/flox组,均购自Jackson Laboratory公司。大鼠均无自发性心肌病及炎症性疾病。
1.4 方法
1.4.1 缺血再灌注小鼠模型(MIRI)的制备 mIKKα-/-组(9只)与IKKαflox/flox组(9只)小鼠再分为假手术组(Sham组,3只)与MIRI模型组(6只)。C57BL/6-IKKα条件性基因敲除小鼠(mIKKα-/-)及同窝出生的年龄性别匹配的对照组小鼠各9只,各自分为MIRI模型组(6只)和假手术组(3只),MIRI模型组操作:经腹腔注射10%乌拉坦麻醉(1 mL/100 g),采用仰卧位固定小鼠,并使用针型电极插入四肢皮下记录标准肢体Ⅱ导联心电图。于胸骨左缘 3~4肋间采用左胸正中旁切口开胸,暴露心脏,在左心室与肺动脉干之间结扎左冠状动脉前降支,同时在结扎线与血管之间穿一直径2 mm、长5 mm的硅胶管,结扎30 min; 然后剪断缝合线,取出硅胶管,再灌注观察。Sham组仅分离前降支,不结扎。以收紧结扎线后动物的心电图标准导联 ST-T段抬高,放松后抬高的ST-T下降1/2以上为MIRI模型建立成功[5]。
1.4.2 小鼠心脏超声及血流动力学检测 以上4组小鼠分别在心肌再灌注3 d和7 d(MIRI模型组心肌再灌注3 d和7 d后分别记为IR 3 d组与IR 7 d组)后,腹腔注射2%戊巴比妥麻醉,行心脏形态和功能检测。测量指标包括左心室舒张末期内径(LVIDd)、舒张期室间隔厚度(IVSD)、左室射血分数(EF)、左室室壁心肌纤维缩短率(FS)。
1.4.3 小鼠心肌组织病理学检测 以上4组小鼠分别于心肌再灌注3 d和7 d后处死,取左心室部分心肌,10%甲醛固定后进行常规组织切片,HE及Masson染色,进行病理学观察,通过BI- 2000医用图像分析系统计算心肌组织梗死面积及胶原附着面积(梗死面积/视野面积、胶原面积/视野面积)。
1.4.4 小鼠心肌组织炎性因子表达检测 采用免疫组织化学法检测各组小鼠心肌组织中炎性因子白细胞介素-12A(IL-12A) (1∶100, ab131039, Abcam)、TNF-α(1∶500,bs-2081R, Bioss)、白细胞介素-10(IL-10),1∶100, bs-0698R, Bioss), CD68 (1∶500, ab125212, Abcam)相对表达量。SP法检测心肌组织中以上因子的表达,已知阳性片为阳性对照,PBS缓冲液代替一抗为阴性对照,采用Fromowitz半定量分析评分法对免疫组化结果进行半定量评分(0~7)[6]。
1.4.5 小鼠M1/M2型巨噬细胞表型标记物检测[7]采用 Western Blot 法检测各组小鼠心肌组织中诱导型氧化氮合酶(iNOS)、表型标记物(Arg1)蛋白相对表达量[8-9]。心肌组织低温研磨破碎,裂解,提取总蛋白,BCA蛋白定量,SDS-聚丙烯酰胺凝胶电泳,转膜,封闭,依次与一抗、二抗孵育,化学发光法获取条带,扫描胶片后用IPP 6.0 软件进行目的条带的灰度分析,计算上述蛋白的相对表达量。
采用实时荧光定量PCR法检测小鼠心肌组织中M1型巨噬细胞iNOS、TNF-α、IL-1β mRNA的表达量以及促M2巨噬细胞因子[肿瘤坏死因子-β(TGF-β)、IL-10]、M2巨噬细胞Arg1 mRNA的表达量。RIzol试剂提取各组小鼠心肌组织总RNA,进行逆转录。取2 μL进行PCR扩增,5 μL PCR扩增产物进行琼脂糖凝胶电泳,紫外线投射仪下观察电泳条带,系统分析各目的基因和参比基因GAPDH的条带灰度值。

2 结 果
2.1 各组小鼠心脏超声及血流动力学指标检测结果 与IR 3 d时及Sham组比较,IKKαflox/flox及mIKKα-/-模型组IR7 d后LVIDd升高(P<0.05);与Sham组、IR 3 d时及IKKαflox/flox模型组IR7 d后比较,mIKKα-/-模型组IR7 d后EF与FS均降低(P<0.05)。表明mIKKα-/-小鼠巨噬细胞IKKα基因的缺乏加剧了心肌缺血后的心室重构。详见图1。

与IR 3 d及Sham组比较,*P<0.05; 与IKKαflox/flox模型组IR 7 d比较,#P<0.05; 与Sham组,IR 3 d及IKKαflox/flox模型组IR 7 d比较,△ P< 0.05。n=3。
2.2 各组小鼠心肌组织病理学检测结果 HE染色结果显示:mIKKα-/-小鼠IR3 d后心肌炎症细胞浸润面积明显大于IKKαflox/flox组;Masson染色结果显示:mIKKα-/-小鼠IR7 d后心肌纤维化面积明显大于IKKαflox/flox组;并且mIKKα-/-小鼠心肌间质充血、出血明显,血管明显扩张,局灶性心肌出血,片状心肌肌纤维断裂,广泛的心肌细胞水肿、变性,心肌断裂坏死较为严重。详见图2。mIKKα-/-小鼠IR3 d及7 d心肌梗死面积及胶原附着面积明显大于IKKαflox/flox组(P<0.05)。表明mIKKα-/-小鼠巨噬细胞IKKαflox/flox基因的缺乏加剧了心肌缺血后心肌细胞的病变。详见图3。
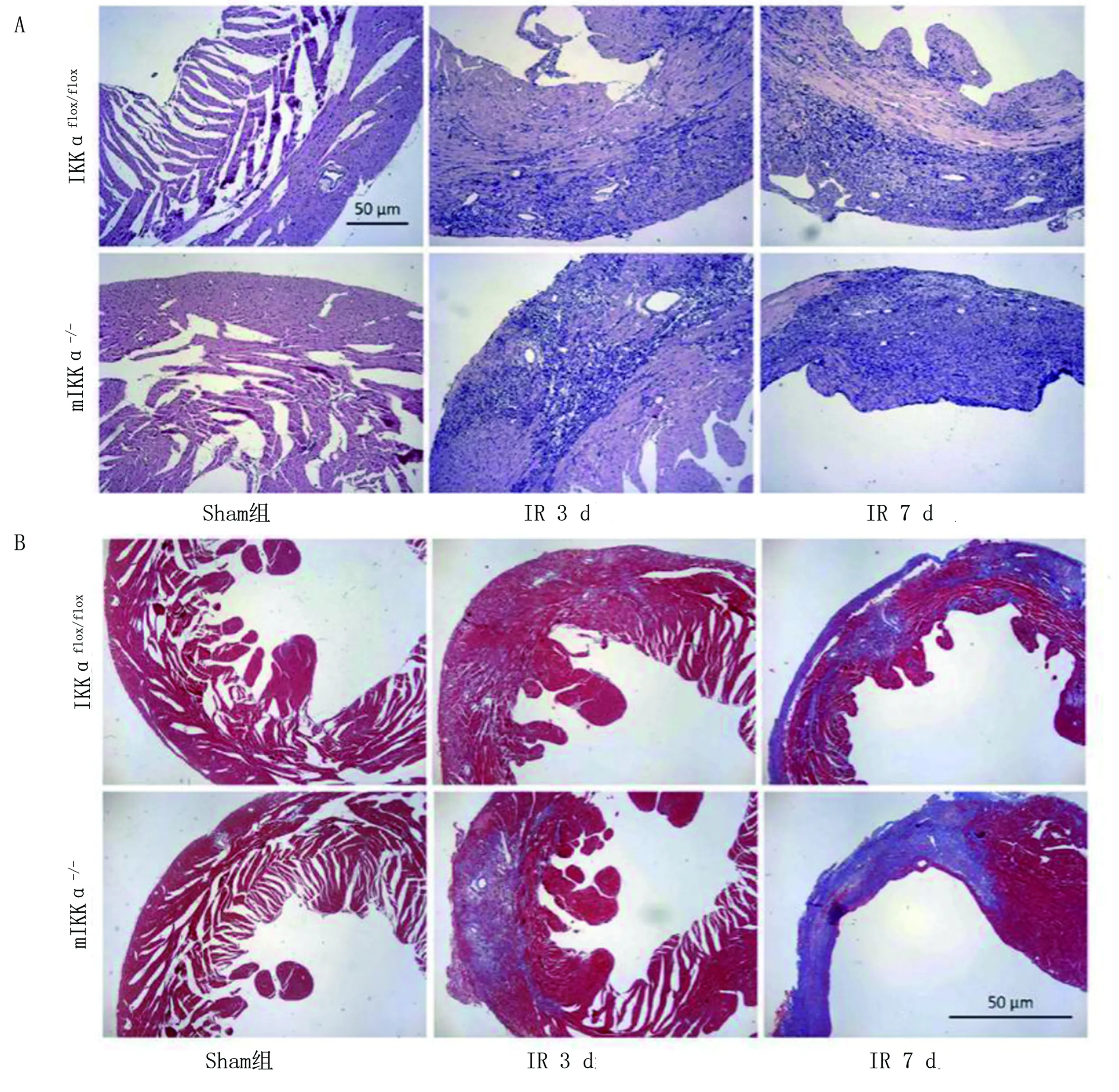
图2 各组小鼠心肌组织病理学切片结果(×400)
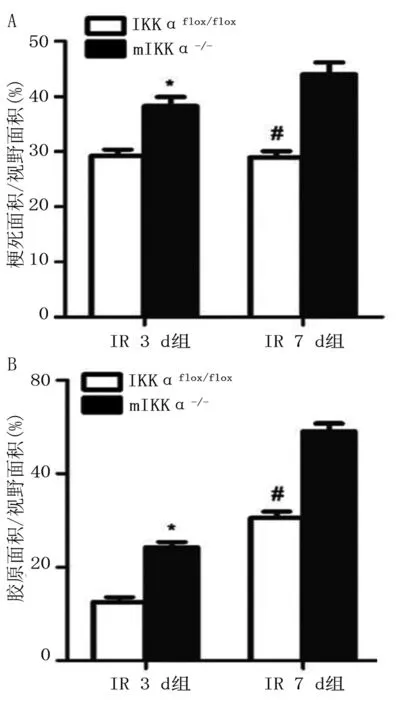
与IKKαflox/flox IR 3 d比较,*P<0.05;与mIKKα-/- IR 7 d比较,#P< 0.05。n=3。
2.3 各组小鼠心肌组织中炎性因子免疫组化检测结果 与Sham组比较,IKKαflox/flox及mIKKα-/-模型组IL-12A、IL-10、CD68阳性区域评分均升高(P<0.05),与IKKαflox/flox模型组比较,mIKKα-/-模型组小鼠心肌细胞的促炎因子(IL-12A、TNF-α)的表达量升高,两者病理学阳性区域评分在造模后比较差异有统计学意义(P<0.05),但抗炎因子IL-10的表达差异无统计学意义(P>0.05);由CD68免疫组化检测结果可知,IKKαflox/flox及mIKKα-/-模型组心肌组织中均有大量巨噬细胞聚集,并且在炎症浸润区域中mIKKα-/-组的巨噬细胞数量明显高于IKKαflox/flox组。表明mIKKα-/-小鼠IKKα基因缺陷诱导的心肌炎症反应可能与心肌巨噬细胞聚集有关。详见图4、图5。

图4 各组小鼠心肌组织炎性因子免疫组化检测病理切片结果(×400)
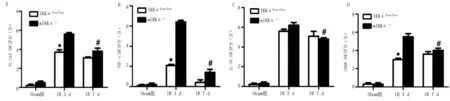
与mIKKα-/-IR 3 d比较,*P<0.05; 与 IKKαflox/flox IR 7 d比较, #P<0.05。n=3。
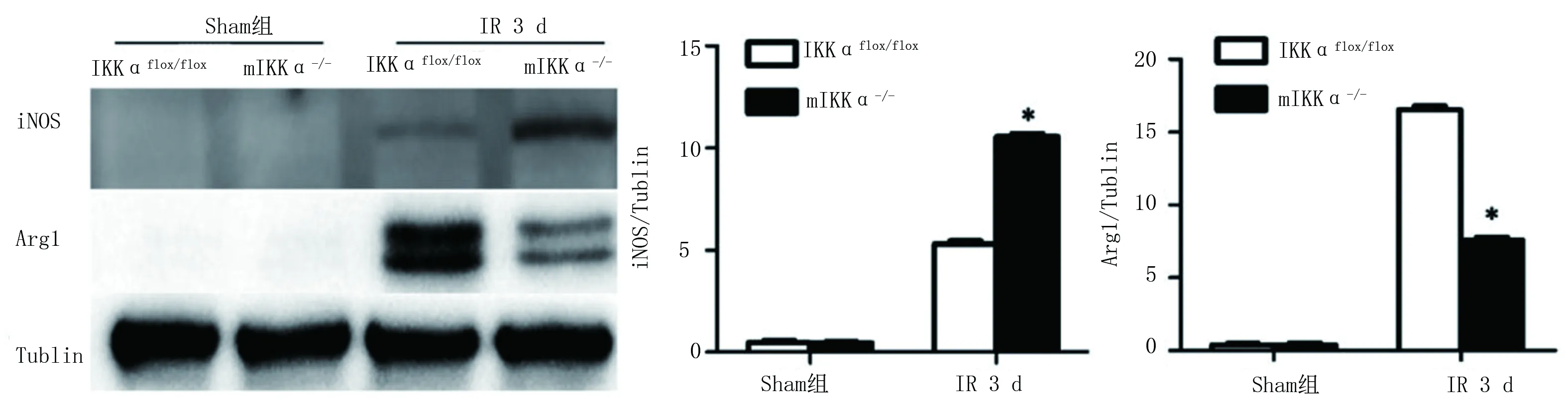
2.4 各组小鼠心肌组织M1、M2型巨噬细胞表型标记物检测结果 各组小鼠心肌组织中M1型巨噬细胞表型标记物iNOS蛋白及M2型巨噬细胞表型标记物Arg1蛋白的表达如图6所示,Sham组小鼠两种蛋白的表达比较差异无统计学意义(P>0.05);mIKKα-/-组小鼠iNOS蛋白的表达量高于IKKαflox/flox组小鼠,Arg1蛋白的表达量低于IKKαflox/flox组小鼠(P<0.05)。各组小鼠心肌组织中M1、M2型巨噬细胞表型标记物mRNA的表达量如图7所示,与IKKαflox/flox组小鼠比较,mIKKα-/-组小鼠M1型巨噬细胞表型标记物(iNOS、TNF-α、IL-1β)mRNA的表达量增加,M2型巨噬细胞Arg1mRNA的表达量降低(P<0.05),促M2巨噬细胞极化因子(TGF-β、IL-10)差异无统计学意义(P>0.05)。表明在小鼠心肌组织中敲除IKKα基因会诱导M1型巨噬细胞的活化和抑制M2型巨噬细胞的活化,因此,IKKα基因可能调节巨噬细胞聚集并向M1型活化。
3 讨 论
本研究证实,IKKα是巨噬细胞活化的内在正调节剂,并且保护心脏免受心肌IR损伤。通过基因敲除小鼠证明,巨噬细胞缺乏IKKα,心肌IR损伤后炎症反应及心室重构将更加严重。但值得注意的是,这种对心肌IR损伤的保护作用与巨噬细胞对M1表型的活化有关,但对于其具体机制有待于进一步研究,靶向作用于IKKα可能有效预防心肌IR损伤。
IκB激酶复合物(IKKα、IKKβ和IKKγ)在NF-κB途径中起关键作用,NF-κB途径涉及多种细胞(包括心肌细胞)的炎症反应及免疫细胞的分化[8-9]。研究显示,IKKα的表达量在IR小鼠模型升高,但IKKβ或IKKγ的表达差异无统计学意义。IKKγ是IKK复合物稳定性调节剂,KKβ是NF-κB经典途径的重要因子,但到目前为止,对IKKγ及IKKβ在心肌IR损伤或心肌梗死中的作用无相关研究报道,因此,有待后续开展IKKβ和IKKγ在心血管疾病中的相关研究。
IR损伤是组织器官暂时性缺血随后恢复灌注时的病理状态,恢复缺血性器官的血供对于防止组织不可逆损伤至关重要,但再灌注可能导致局部和全身炎症反应,与此同时,各种细胞因子持续产生和释放会加剧早期组织炎症损伤[10]。本研究结果显示,组织损伤程度与炎性因子的增加具有一定的相关性,与同窝小鼠野生型IKKαflox/flox相比,mIKKα-/-小鼠显示出较为严重的炎症损伤和纤维化,并且心肌组织的恢复较为缓慢。IKKαflox/flox与mIKKα-/-小鼠在建立IR模型第3天时均无心功能不全,但mIKKα-/-小鼠心脏功能IR 7 d后,FS和EF显示明显降低,这可能归因于在IR后形态及功能变化时的代偿反应。
中性粒细胞聚集和巨噬细胞迁移在IR后的心肌损伤中有重要作用。巨噬细胞参与IR损伤期间的先天性和适应性免疫,并且在免疫应答的起始和效应阶段起关键作用。M1巨噬细胞在某些病原体诱导的免疫反应中必不可少,同时会对机体组织产生过度的免疫损伤[11]。相比之下,M2巨噬细胞在组织稳态和修复方面具有强大的抗炎特性。本研究结果显示,mIKKα-/-小鼠心肌组织中CD68等验证因子表达增加,这意味着有大量的巨噬细胞聚集,与此同时,心肌M1巨噬细胞标记物iNOS的上调和M2巨噬细胞标记物Arg1的下调表明IR损伤后第3天mIKKα-/-组巨噬细胞趋于活化为M1型,促炎因子IL-12A和TNF-α显著增加,从而使心肌组织的炎症反应更加严重,对于抗炎因子IL-10的差异可能与由于IR后心肌中巨噬细胞残留的保护作用有关。
综上所述,IKKα对缺血再灌注损伤小鼠的炎症反应具有保护作用,该作用可能与IKKα调节心肌巨噬细胞聚集并向M1型巨噬细胞活化有关。
与 IKKαflox/flox IR 3 d组比较,*P<0.05。n=3。
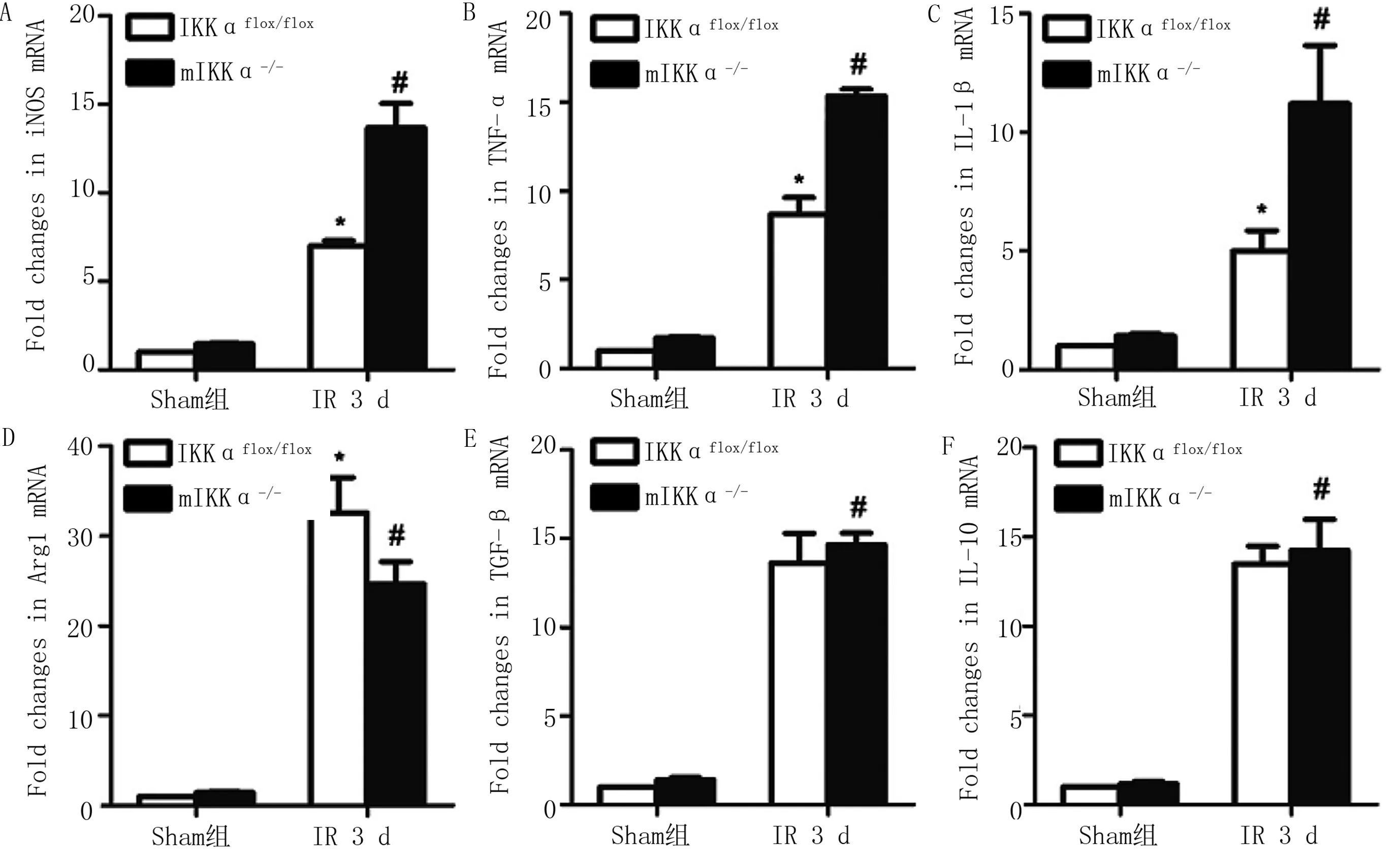
与 mIKKα-/- IR 3 d比较,*P<0.05; 与Sham组比较,#P< 0.05。n=3。
