猪流行性腹泻病毒RT-LAMP检测方法的建立与应用
2020-07-16栗云鹏张启龙高晓龙程汝佳吴惠明宋彦军韦海涛周德刚
吴 迪,王 林,栗云鹏,杜 鹃,张 玮,张启龙,高晓龙,程汝佳, 王 培,李 蕊,吴惠明,宋彦军,韦海涛,周德刚
(北京市动物疫病预防控制中心,北京 102629)
猪流行性腹泻(Pofrcine epidemic diarrhea, PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)引起猪的一种以严重腹泻、呕吐、脱水为主要临床特征的高度接触性消化道传染病[1]。猪流行性腹泻多发于12月份至翌年4月份,在夏季也可发生[2]。各种年龄的猪都易感,哺乳仔猪、架子猪或育肥猪的发病率可达100%[3],尤其哺乳仔猪受害最严重,病死率平均为50%[4]。PEDV为线性单股正链RNA,基因组全长27~33 kb,病毒的结构蛋白由M、S、sM和N基因编码,非结构蛋白由ORF3编码。PEDV毒株M基因十分保守,可以针对该基因设计引物进行研究[5]。
2013-2015年倪建强等[6]对全国17个省的44个猪场开展了生猪腹泻回溯性调查,发现连续3年内共24个养殖场发生腹泻,采集发病猪进行检测均为PEDV阳性。2015-2016年王恩宇[7]对全国20个省的78个规模化养猪场进行流行病学调查,共检出243份PEDV阳性样品。数据表明猪流行性腹泻病毒仍是猪病毒性腹泻的主要病原,是危害养猪业及经济效益的重要因素。
环介导等温扩增(LAMP)方法是由日本学者Notomi在2000年公开发明的一种适用于基因诊断的恒温核酸扩增技术[8],该方法能在等温(60~65 ℃)条件下,短时间内进行大量的核酸扩增,是一种“简便、快速、精确、廉价”的基因扩增方法[9]。与常规PCR相比,该方法不需要模板的热变性、温度循环、电泳及紫外观察等过程,具有简单、快速、特异性强等特点[10]。LAMP的特征是针对靶基因上的六个区域设计四条引物,利用链置换型DNA聚合酶在恒温条件下进行扩增反应[11],通过添加钙黄绿素可以肉眼观察到阳性样品出现黄绿色荧光。本研究建立的基于钙黄绿素可视化LAMP检测PEDV的方法,经过一系列优化试验,对特异性、灵敏性、应用仪器设备与临床样品检测进行摸索试验,建立了一种猪流行性腹泻病毒 LAMP目视法检测技术,以期应用于PEDV现场快速诊断。
1 材料与方法
1.1 试验材料 核糖核酸扩增试剂盒(生产批号:87001)、荧光目视检测试剂盒(生产批号:94001)购自荣研生物科技有限公司。PEDV CV777株、PEDV AJ1102株、PEDV ZJ08株购自哈尔滨维科生物技术有限公司;猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(PoRV)由北京中科基因技术有限公司馈赠;猪瘟(CSFV)活疫苗C株购自广东永顺生物制药股份有限公司;猪繁殖与呼吸综合征病毒(PRRSV)R98株、猪伪狂犬病毒(PRV)Bartha-K61株购自瑞普(保定)生物药业有限公司。PEDV实时荧光RT-PCR检测试剂盒(生产批号:PED20190911P)购自北京世纪元亨动物防疫技术有限公司。
1.2 仪器设备 Loopamp®实时浊度测定仪器购置于荣研生物科技有限公司。荧光定量PCR仪ABI Quant Studio7购自赛默飞世尔科技(中国)有限公司,TGuide S32全自动核酸提取纯化仪购自天根生化科技有限公司,移液器购自德国Eppendorf公司。水浴锅购自德国WIGGENS。金属浴由北京兰伯瑞生物技术有限责任公司提供。
1.3 引物设计与合成 根据GenBank已发表的PEDV基因序列,包括经典毒株CV777(GenBank: AF353511.1)、PEDV变异毒株AJ1102(GenBank: JX188454.1)、PEDV变异毒株AH2012(GenBank:KC210145.1)、PEDV变异毒株JXNC1302(GenBank:KJ526109.1)、PEDV变异毒株FJ-CL(GenBank:KJ646593.1)、PEDV变异毒株FJ-ZP(GenBank:KJ646609.1)、PEDV变异毒株GD-1(GenBank:JX647847.1),通过多序列比对鉴定保守区域,运用在线生物软件(http:∥primerexplorer.jp/),通过调整Tm值、GC含量、dG临界值、扩增长度和片段区域等参数值,设计3组适用于RT-LAMP的特异性外引物和内引物,分别编号为引物组1、引物组2、引物组3,引物序列见表1-表3。通过实验筛选出最佳的外引物和内引物后,在此引物组的基础上设计最佳的环引物,最终得到最佳引物组合引物组1。最佳引物组1在PEDV M基因组中位置见图1,扩增序列201 bp,FIP引物是由(F2+F1c)引物组合,BIP引物是由(B2+B1c)引物组合。引物由赛默飞世尔科技(中国)有限公司合成。
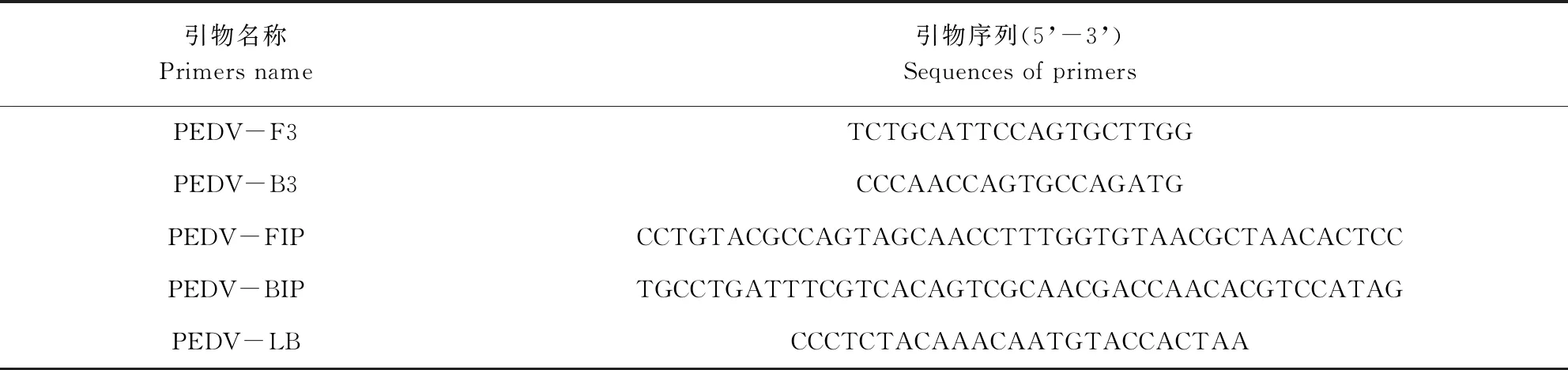
表1 引物组1序列Tab 1 Sequences of primers
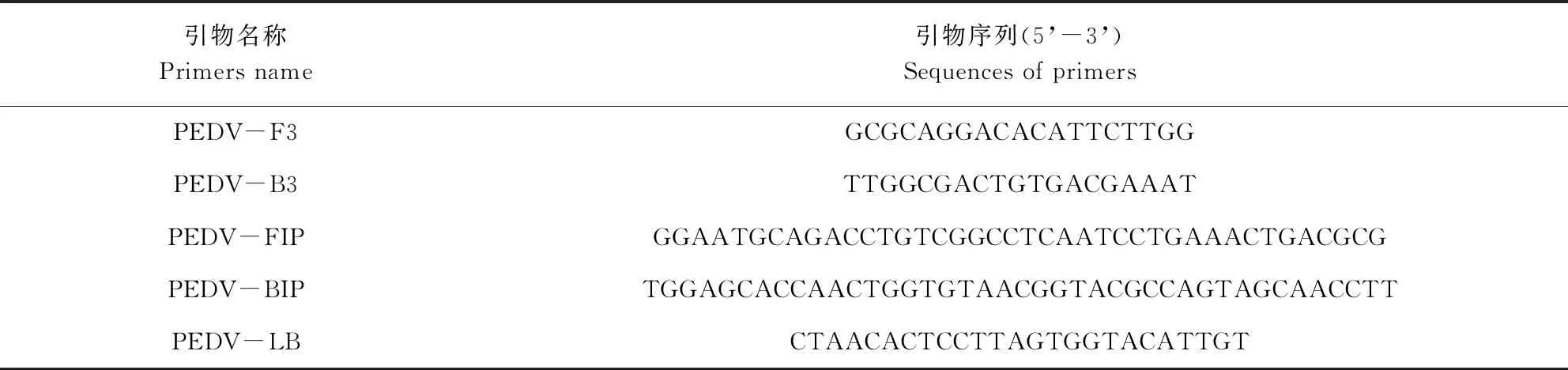
表2 引物组2序列Tab 2 Sequences of primers
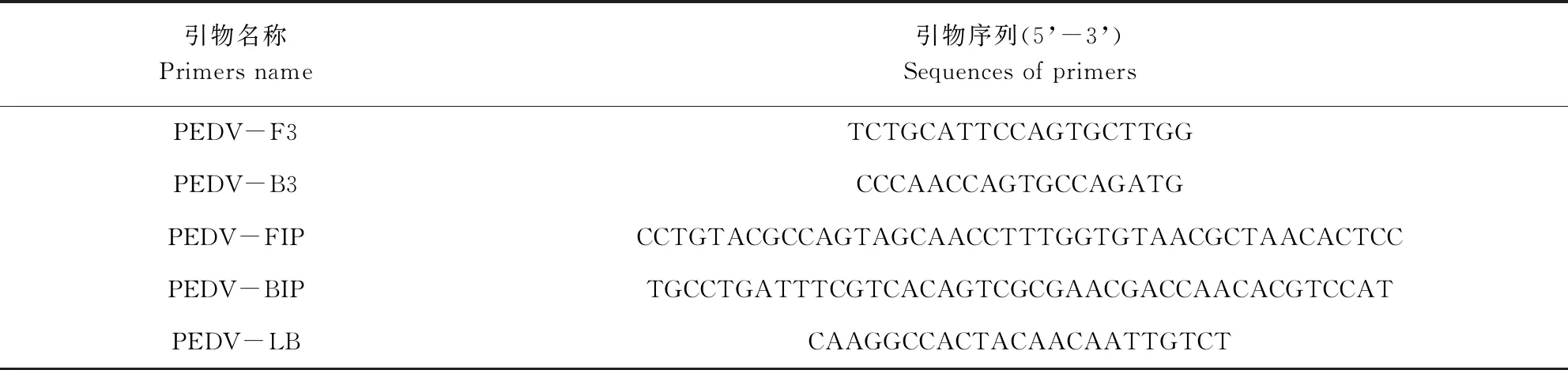
表3 引物组3序列Tab 3 Sequences of primers
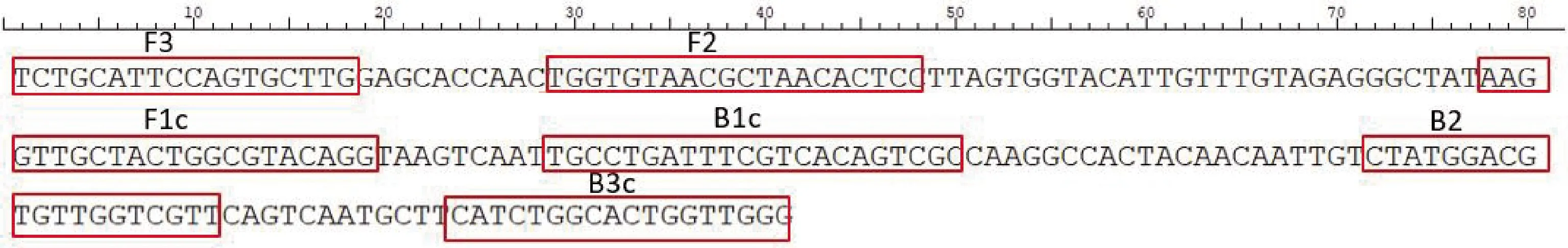
c表示反向互补序列c represents reverse complementary sequence图1 引物组1在PEDV M基因组中位置Fig 1 Position of primer group 1 in PEDV M genome
1.4 PEDV质粒合成与核酸提取 通过比对PEDV经典毒株与变异毒株的M基因保守序列,设计合成一段681 bp的PEDV质粒,质粒由赛默飞世尔科技(中国)有限公司合成。对TGEV、PoRV、CSFV活疫苗C株、PRRSV R98株、PRV Bartha-K61株进行核酸提取,-20 ℃保存备用。
1.5 LAMP反应体系的建立与优化 本研究建立的RT-LAMP反应体系25 μL,包含RT-LAMP预混液18 μL(2×反应缓冲液12.5 μL、5 μmol/L的外引物PEDV-F3 1 μL、5 μmol/L的外引物PEDV-B3 1 μL、40 μmol/L的内引物PEDV-FIP 1 μL、40 μmol/L的内引物PEDV-BIP 1 μL、20 μmol/L的环引物PEDV-LB 1 μL、无RNA酶的蒸馏水0.5 μL);酶溶液 1 μL;荧光目视检测试剂 1 μL;RNA样品5 μL;扩增反应工作程序为:65 ℃ 120 min。
以PEDV质粒(10 ng/μL)为模板,利用建立的RT-LAMP反应体系在Loopamp仪器上进行扩增,设置60 ℃、63 ℃、65 ℃、68 ℃四个温度进行筛选。
1.6 特异性试验 以提取的PEDV CV777株、PEDV AJ1102株、PEDV ZJ08株、CSFV、PoRV、TGEV、PRRSV R98株、PRV Bartha-K61株核酸为模板进行LAMP检测,评价建立的可视化RT-LAMP检测方法的特异性。
1.7 灵敏度试验 将合成的PEDV质粒经微量核酸蛋白检测仪测定,浓度为10 ng/μL,按公式“拷贝数=(6.02×1023copies/mol×10ng/μL×10-9)/ (681bp×660g/mol) ”计算PEDV质粒的拷贝数为1.34×1010copies/μL,将质粒浓度稀释到2×104copies/μL,按1∶10倍比稀释,进行RT-LAMP可视化检测方法的灵敏度研究。同时,与市售的猪流行性腹泻病毒荧光定量PCR检测试剂盒进行比对,比较两种检测方法的灵敏性差异。
1.8 不同恒温设备对LAMP检测结果的影响 将浓度为2×104copies/μL的PEDV质粒按1∶10倍比稀释,稀释到2×10-2copies/μL。分别在水浴锅、金属浴、PCR仪器3种不同恒温设备进行RT-LAMP可视化检测反应,设置反应条件均为65 ℃ 45 min,比较不同恒温设备对试验结果产生的影响。
1.9 临床样品检测 用已建立的可视化RT-LAMP检测方法与实时荧光定量RT-PCR方法同时检测已知背景的30份临床样品(其中22份为阴性样品,8份为阳性样品),比对两种检测方法的符合率。
2 结果与分析
2.1 引物组合的筛选 对设计出的3组引物,分别为引物组1、引物组2、引物组3,利用PEDV质粒为模板,进行LAMP浊度仪检测,浊度仪扩增曲线如图2所示,由图可知,产生扩增速率曲线的时间:引物组1>引物组2>引物组3,所以引物组1 LAMP扩增效果最佳。
2.2 温度范围的筛选 以PEDV质粒(10 ng/μL)为模板,利用建立的RT-LAMP反应体系在Loopamp仪上进行扩增,设置60 ℃、63 ℃、65 ℃、68 ℃五个温度进行最佳温度的筛选,结果如图3所示:A为在60 ℃条件下,PEDV质粒在31 min出现扩增曲线;B为在63 ℃条件下,PEDV质粒在25 min出现扩增曲线;C为在65 ℃条件下,PEDV质粒在22 min出现扩增曲线;D为在68 ℃条件下,PEDV质粒在42 min出现扩增曲线。由此可见,在65 ℃条件下,PEDV质粒出扩增曲线时间最快,效果最好。
2.3 灵敏度试验 通过倍比稀释PEDV质粒(2×104copies/μL~2×10-2copies/μL),对本研究建立的RT-LAMP可视化快速检测方法与荧光RT-PCR检测试剂盒进行灵敏度比对。图4为可视化RT-LAMP检测方法对引物组1进行RT-LAMP的检测结果,可以看出,可视化LAMP检测方法可检出到2 copies/μL。图5为Real-time PCR检测结果,可以看出,猪流行性腹泻病毒实时荧光RT-PCR检测试剂盒可以检出到20 copies/μL。
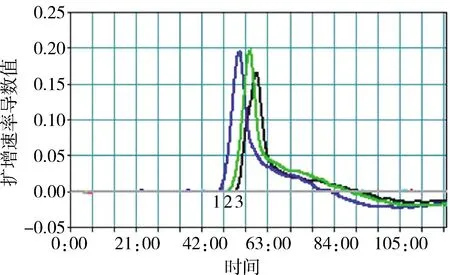
1:引物组1+PEDV质粒模板组合;2:引物组2+PEDV质粒模板组合;3:引物组3+PEDV质粒模板组合1: primer group 1 + PEDV plasmid template combination;2: primer group 2 + PEDV plasmid template combination;3: primer group 3 + PEDV plasmid template combination图2 浊度仪扩增速率曲线Fig 2 Amplification rate curve of turbidimeter
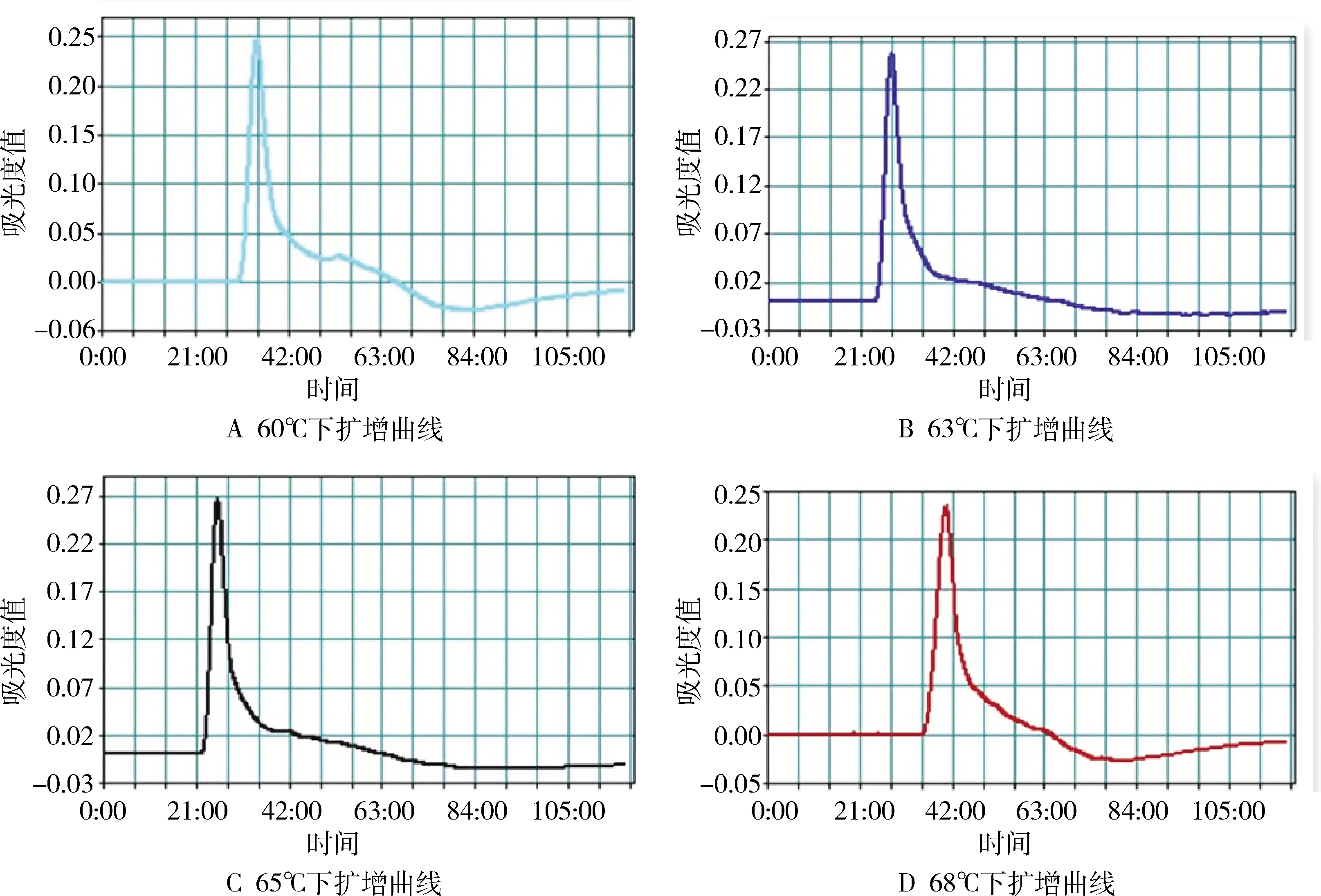
图3 不同温度条件下产生的扩增曲线Fig 3 Amplification curve under different temperature conditions

1-7:不同稀释浓度质粒(2×104 copies/μL~2×10-2 copies/μL);8:阴性对照1-7: plasmids with different dilutions (2×104copies/μL ~ 2×10-2 copies/μL); 8: negative control图4 PEDV灵敏度试验检测结果Fig 4 Detection results of PEDV sensitivity test
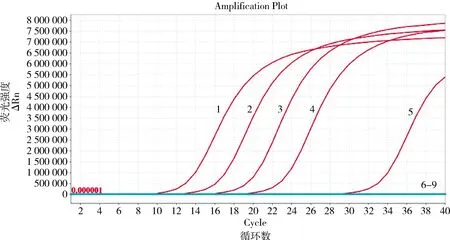
1:阳性对照;2-5:不同稀释浓度质粒(2×104 copies/μL~20 copies/μL);6-8:不同稀释浓度质粒(2 copies/μL~2×10-2 copies/μL);9:阴性对照1: positive control; 2-5: plasmids with different dilutions (2×104 copies/μL ~ 20 copies/μL);6-8: plasmids with different dilutions (2 copies/μL ~ 2×10-2 copies/μL); 9: negative control图5 PEDV荧光定量PCR检测结果Fig 5 Detection results of PEDV by fluorescence quantitative PCR
2.4 特异性试验 本研究的引物组合制备的试剂盒特异性检测结果见图6。从图中可以看出,本研究建立的LAMP可视化检测方法特异性良好,可以检出PEDV经典株与变异株,与TGEV、PoRV、CSFV、PRV、PRRSV R98株无交叉反应。

1:PEDV CV777株;2:PEDV AJ1102株;3:PEDV ZJ08株;4:TGEV;5:PoRV;6:CSFV;7:PRV;8:PRRSV R98株图6 试剂盒特异性检测结果Fig 6 Test results of kit specificity
2.5 不同设备对LAMP检测结果的影响 分别在水浴锅、金属浴、PCR仪器3种不同设备进行PEDV稀释质粒的LAMP可视化检测反应,3种设备设定温度65 ℃,时间45 min,结果见图7-图9。可以看出,使用水浴锅与金属浴可以检测到2 copies/μL,使用PCR仪器可以检测到20 copies/μL。
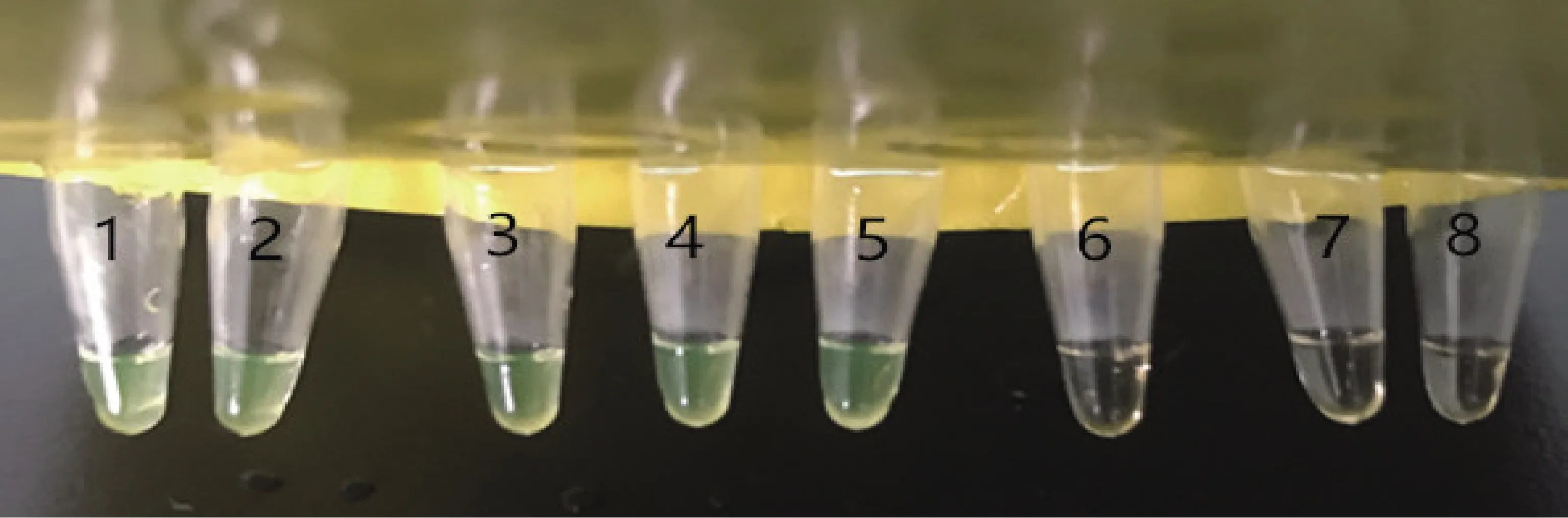
1-7:不同稀释浓度质粒(2×104 copies/μL~2×10-2 copies/μL);8:阴性对照1-7: plasmids with different dilutions (2×104copies/μL ~ 2×10-2 copies/μL); 8: negative control图7 水浴锅LAMP检测结果Fig 7 LAMP test results of water bath
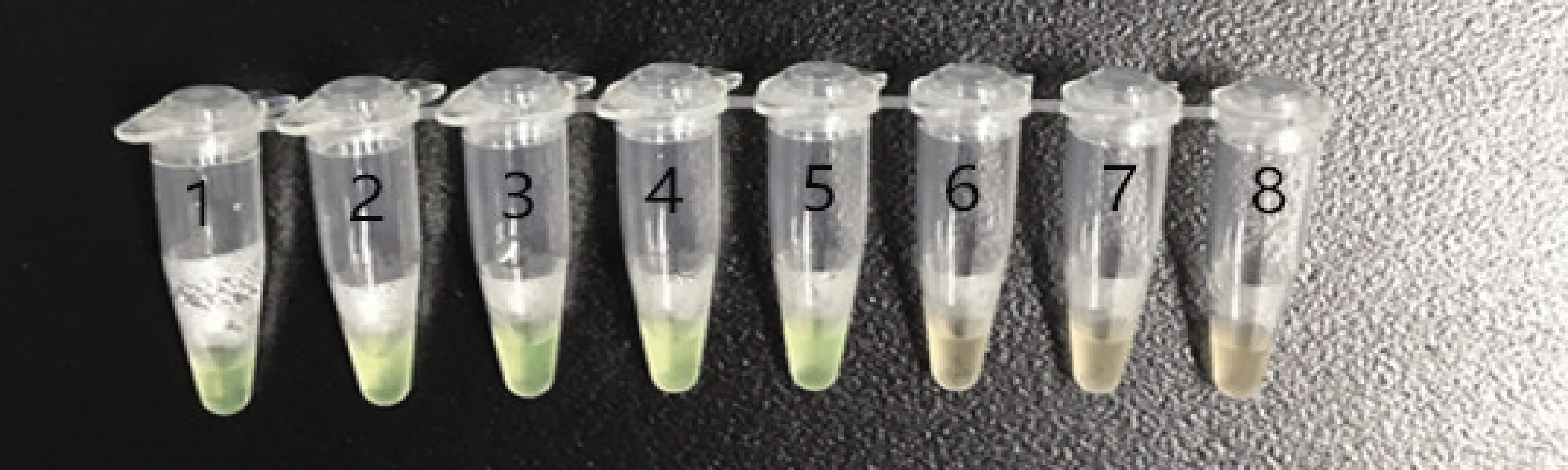
1-7:不同稀释浓度质粒(2×104 copies/μL~2×10-2 copies/μL);8:阴性对照1-7: plasmids with different dilutions (2×104copies/μL ~ 2×10-2 copies/μL); 8: negative control图8 金属浴LAMP检测结果Fig 8 LAMP test results of metal bath
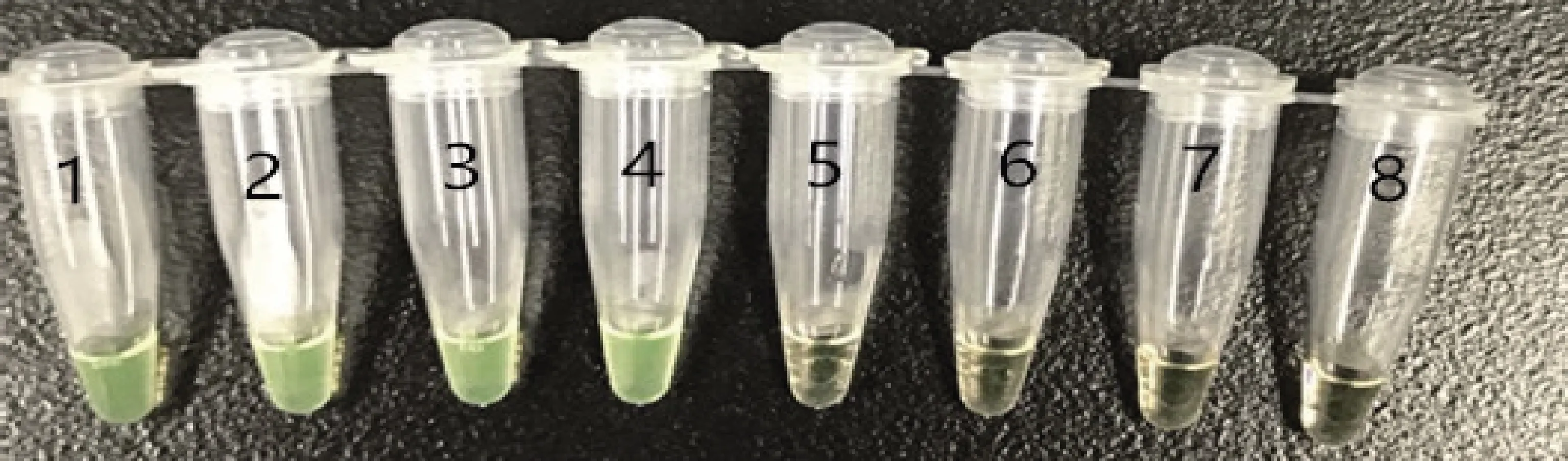
1-7:不同稀释浓度质粒(2×104 copies/μL~2×10-2 copies/μL);8:阴性对照1-7: plasmids with different dilutions (2×104copies/μL ~ 2×10-2 copies/μL); 8: negative control图9 PCR LAMP检测结果Fig 9 LAMP test results of PCR
2.6 LAMP可视化临床检测试验 用已建立的可视化RT-LAMP检测方法与实时荧光定量RT-PCR方法同时检测已知背景的30份临床样品(其中22份为阴性样品,8份为阳性样品),比对两种检测方法的符合率,结果见表4。可以看出,建立的RT-LAMP方法与荧光定量RT-PCR方法检测结果一致,符合率为100%。

表4 RT-LAMP与荧光定量RT-PCR方法检测结果Tab 4 Detection results of RT-LAMP and quantitative RT-PCR
3 讨论与结论
目前对于PEDV的检测,常用的检测技术包括病毒的分离鉴定、PEDV抗原检测以及常规RT-PCR、套式RT-PCR与实时荧光RT-PCR等方法[12]。近年来虽然有一些研究者针对PEDV开发了基于LAMP的检测方法,但上述方法中依然存在着检测灵敏度相对较低、无法实现对不同流行毒株同时检测的不足,而且检测结果需要通过跑胶查看[13],由于LAMP反应可在15~60 min内实现109~1010倍的扩增,大大增加了实验室发生气溶胶污染的风险,严重制约着在实际检测中的应用。本研究建立的PEDV RT-LAMP可视化快速检测方法在LAMP技术的基础上添加了钙黄绿素荧光染料,无需后续的电泳检测,在观察结果时无需开盖,可直接通过颜色变化进行肉眼判定,提高了检测的灵敏度与安全性,避免了假阳性的出现[14]。
建立的PEDV RT-LAMP可视化检测方法在水浴锅、金属浴、PCR仪器3种恒温设备均可通过肉眼观察颜色变化做出阳性判断,说明本研究建立的方法对仪器设备使用要求不高,即具备恒温条件即可,为今后在临床现场快速检测提供了便捷条件。在水浴锅与金属浴中可检测到2 copies/μL,在荧光定量PCR仪器中可检测到20 copies/μL,分析原因可能在PCR启动过程中需要先预热到105 ℃的热盖温度,对PEDV LAMP反应体系中的反转录酶活性产生一定影响,而PCR反应管在水浴锅与金属浴中受热均匀,所以产生较好试验结果。通过对反应条件的试验摸索表明,建立的检测方法能在65 ℃ 45 min内特异性扩增PEDV,与TGEV、PoRV、CSFV、PRV、PRRSV R98株无交叉反应。灵敏度比目前市售的荧光定量PCR检测试剂盒高出一个梯度,RT-LAMP扩增时间为45 min,荧光定量RT-PCR扩增时间约为80 min,RT-LAMP反应时间比荧光定量RT-PCR快35 min,节省了反应时间。
本研究建立的PEDV RT-LAMP可视化快速检测方法,在65 ℃ 45 min内可以检出2 copies/uL浓度的PEDV,灵敏度高于市售PEDV荧光定量PCR检测试剂盒,与TGEV、PoRV、CSFV、PRV、PRRSV R98株均无交叉反应,临床样品比对试验符合率与荧光定量PCR方法一致,可在水浴锅、金属浴、PCR仪器进行操作,适用于临床PEDV的现场快速检测。
