超高效液相色谱-串联质谱法测定猪组织中泰拉霉素及其代谢物残留量
2020-07-16魏紫嫣王佳雅张晶晶黄川邻王利丹孙志文叶能胜
李 建,魏紫嫣,王佳雅,张晶晶,黄川邻,王利丹,孙志文*,叶能胜*
(1.国家粮食和物资储备局科学研究院,北京 100037;2.北京市兽药监察所,北京 102629;3.首都师范大学化学系,北京 100048;4.中国合格评定国家认可委员会,北京 100062)
泰拉霉素(tulathromycin)又名土拉霉素,是一种新近上市且为动物专用的大环内酯类半合成抗生素,主要用于治疗由胸膜肺炎放线杆菌、巴氏杆菌和支原体等引起的家畜呼吸系统疾病[1],我国农业部在2008年第957号公告中首次允许泰拉霉素在动物生产中使用,主要用于牛和猪呼吸系统疾病的防治[2]。目前,我国将泰拉霉素作为专用抗生素在牛、猪养殖过程中,用以防治由敏感菌引起的牛、猪呼吸系统感染性疾病以及由牛莫拉氏菌引起的牛传染性角膜结膜炎[3]。华南农业大学国家残留基准实验室进一步对泰拉霉素在猪体内的药物动力学及生物利用度等指标[4-5]进行了系统研究以指导养猪行业的合理用药,同时国外相关研究针对动物用药后药物在血浆中分布情况[6-9]及药代动力学[10]也进行了分析。研究表明,随着用药时间的延长以及用药量的不断增大,泰拉霉素在动物体性组织中会出现不同程度的药物残留[11-16],欧洲药品评价局(EMEA)相关资料(EMEA/MRL/894/04)表明:泰拉霉素在猪体内的残留量由皮肤+脂、肌肉、肾脏、注射部位到肾脏逐渐增高,并给出了猪组织中的最高残留限量(MRL):皮肤脂肪100 μg/kg,肝脏3000 μg/kg,肾脏3000 μg/kg。我国目前还并没有泰拉霉素残留检测相应的国家标准,基于高效液相色谱-串联质谱法检测泰拉霉素的研究主要集中在鸡肉[17]、猪肉[18]以及牛肉[19]等动物组织[20],对于猪组织中泰拉霉素的分析检测研究的报道很少[21]。另有针对动物组织中泰拉霉素及其代谢物的样品前处理技术的报道,主要有加压液相萃取[22]和分子印迹固相微萃取技术[23-24]等。本研究基于超高效液相色谱-串联质谱技术建立了猪组织中泰拉霉素及其代谢物的分析检测方法,采用基质外标法定量,分别对猪肉、肝脏、肾脏中的泰拉霉素及其代谢物进行了分析检测。
1 材料与方法
1.1 主要仪器与试剂
1.1.1 仪器 超高效液相色谱-串联质谱仪(美国Waters公司);匀浆仪(中国安信汇康);电子分析天平(北京赛多利斯有限公司);高速冷冻离心机(日本HITACHI 公司);氮吹仪(Organomation Associates公司);溶剂过滤器(美国PALL公司);旋涡混合仪(德国IKA公司)。
1.1.2 试剂 泰拉霉素及其代谢物标准品由艾美科健(中国)生物医药有限公司提供,含量分别为99.5%和98.5%;乙腈、甲醇、甲酸,购自美国Thermo Fisher Scientific公司,均为质谱纯;MCX固相萃取柱(60 mg/3 mL),购自美国Waters公司;正己烷、氨水,分析纯,购自北京化工试剂厂。其他试剂均为分析纯。
1.2 实验方法
1.2.1 样品前处理 称取试料2±0.02 g于50 mL离心管内,涡旋混合,加入提取液(乙腈+0.1%甲酸水,7+3)10 mL,震荡10 min,10000 r/min离心5 min,取上清于另一干净50 mL离心管中,剩余残渣重复提取,加入5 mL提取液,重复提取一次,合并上清液。在以上提取液中加入10 mL正己烷,振荡10 min,5000 r/min离心5 min,弃去正己烷层,下层溶液作为备用液。
MCX固相萃取柱依次用甲醇3 mL、2%甲酸水3 mL活化,取全部备用液过柱,依次用2%甲酸水3 mL、甲醇3 mL淋洗,然后用5%氨化甲醇2 mL洗脱,并收集洗脱液于10 mL离心管中,于40 ℃氮气吹干。加10%甲醇水溶液(含0.5%甲酸)1.0 mL复溶,充分漩涡混匀,14000 r/min离心20 min,上清液过0.22 μm滤膜后,供超高效液相色谱-串联质谱仪测定。高浓度样品稀释后上机检测。
1.2.2 液相色谱参考条件 液相色谱条件:BEH C18柱(50 mm × 2.1 mm,1.7 μm);流动相:A:乙腈;B:0.1%甲酸水;流速:0.3 mL/min;进样量:5 μL;柱温:30 ℃,梯度洗脱程序见表1。
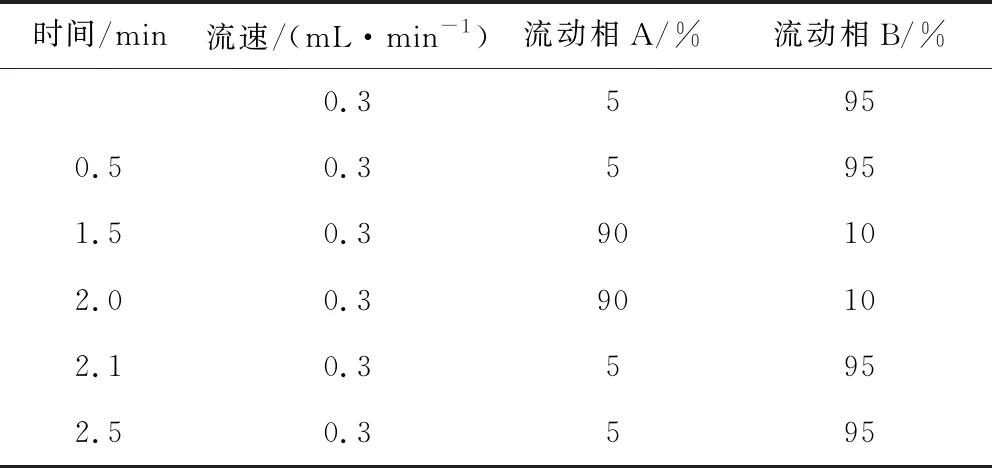
表1 液相色谱梯度洗脱条件Tab 1 Gradient elution conditions of liquidchromatography
1.2.3 质谱参考条件 离子源:电喷雾离子源(ESI);检测方式:多反应监测(MRM);扫描方式:正离子扫描;电离电压:3.0 kV;源温:150 ℃;雾化温度:450 ℃;锥孔气流速:150 L/h;雾化气流速:700 L/h。定性、定量离子对和锥孔电压及碰撞能量见表2。
1.2.4 标准曲线绘制 分别精密称取适量泰拉霉素、泰拉霉素代谢物标品,用乙腈溶解配制成质量浓度为1 mg/mL贮备液,再吸取不同体积贮备液配制6个不同浓度的基质标准工作液(5,10,50,100,200,500 μg/kg),以浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线。
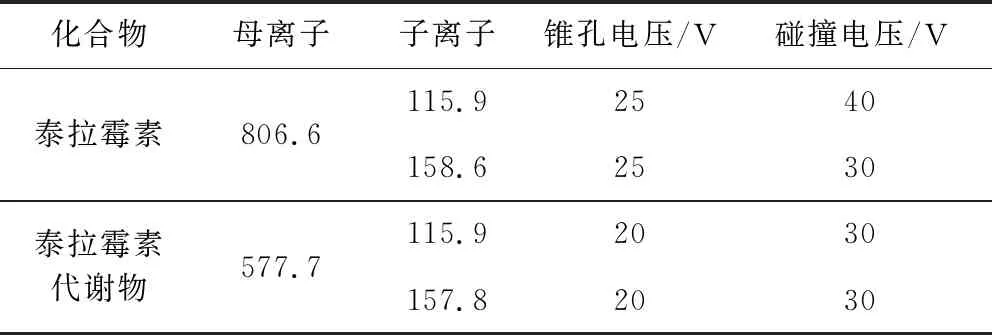
表2 泰拉霉素及其代谢物质谱参数Tab 2 Mass spectrometric determination paramete of tulathromycin and its metabolite
2 结果与分析
2.1 线性范围 采用6个不同浓度5,10,50,100,200,500 μg/kg基质标准工作液,以浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线。结果表明,在5~500 μg/kg的浓度范围内泰拉霉素及其代谢物色谱峰面积与浓度呈良好线性相关,相关系数均>0.99。泰拉霉素及其代谢物的标准曲线见表3。

表3 泰拉霉素及其代谢物猪组织基质匹配标准曲线Tab 3 The matrix standard curve of tulathromycin and its metabolite for pork, pig liver and kindey
2.2 检测方法灵敏度 方法检出限(LOD)和定量限(LOQ):按照药物选择离子响应色谱峰信噪比S/N>3(按PtP算)确定检出限;按照药物选择离子响应色谱峰的信噪比S/N>10(按PtP算)确定定量限。
添加适量标准溶液于2 g空白试样中,分别制备得到5 μg/kg和10 μg/kg的添加样品(猪肉:2 μg/kg),经前处理后检测,检出限(LOD)满足信噪比 S/N=3,定量限(LOQ)满足信噪比S/N =10,该方法检出限为5 μg/kg(猪肉:2 μg/kg),定量限为10 μg/kg。
2.3 实际样品检测应用 在上述优化最佳条件下,将本方法应用于猪肉、肝脏和肾脏中泰拉霉素及其代谢物的分析检测,并取得了较好的应用效果。泰拉霉素及其代谢物特征离子色谱图、猪肉、肝脏和肾脏空白色谱图以及猪肉、肝脏和肾脏添加特征色谱图见图1~图7。
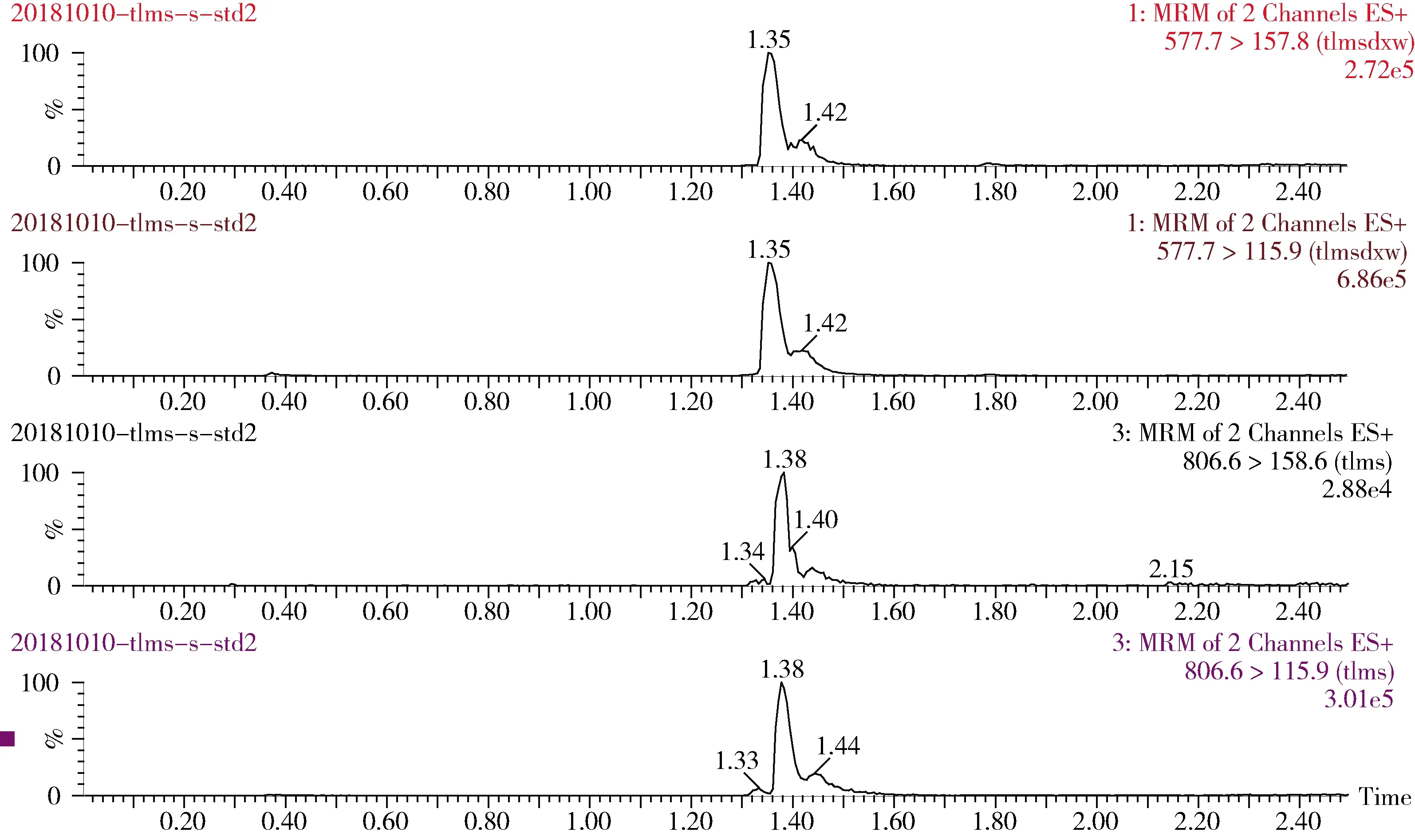
图1 10 ng/mL泰拉霉素及其代谢物标准溶液特征离子色谱图Fig 1 The chromatogram of tulathromycin and its metabolite for standard solution (10 ng/mL)
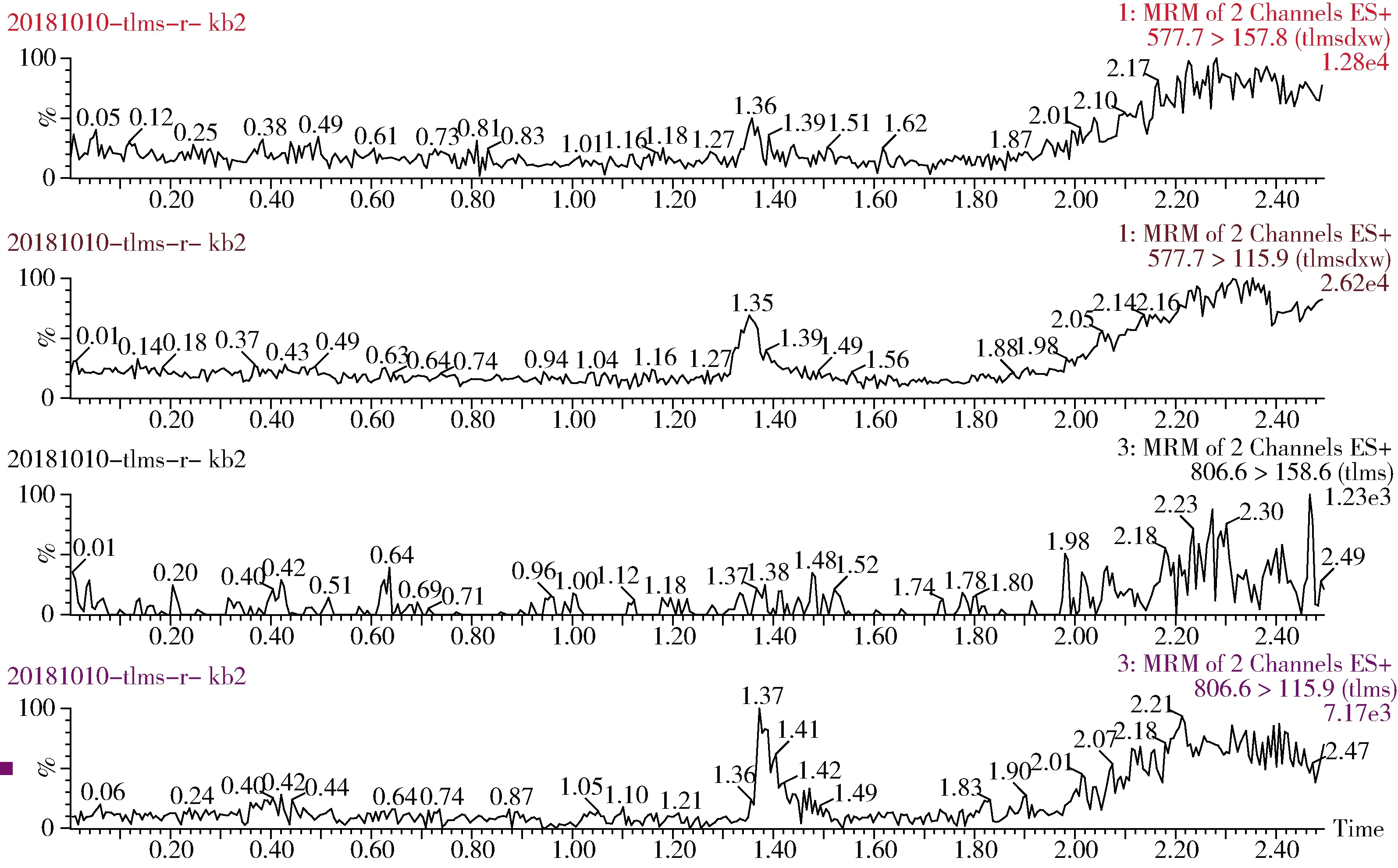
图2 泰拉霉素及其代谢物猪肉空白特征离子色谱图Fig 2 The blank chromatogram of tulathromycin and its metabolite for pork
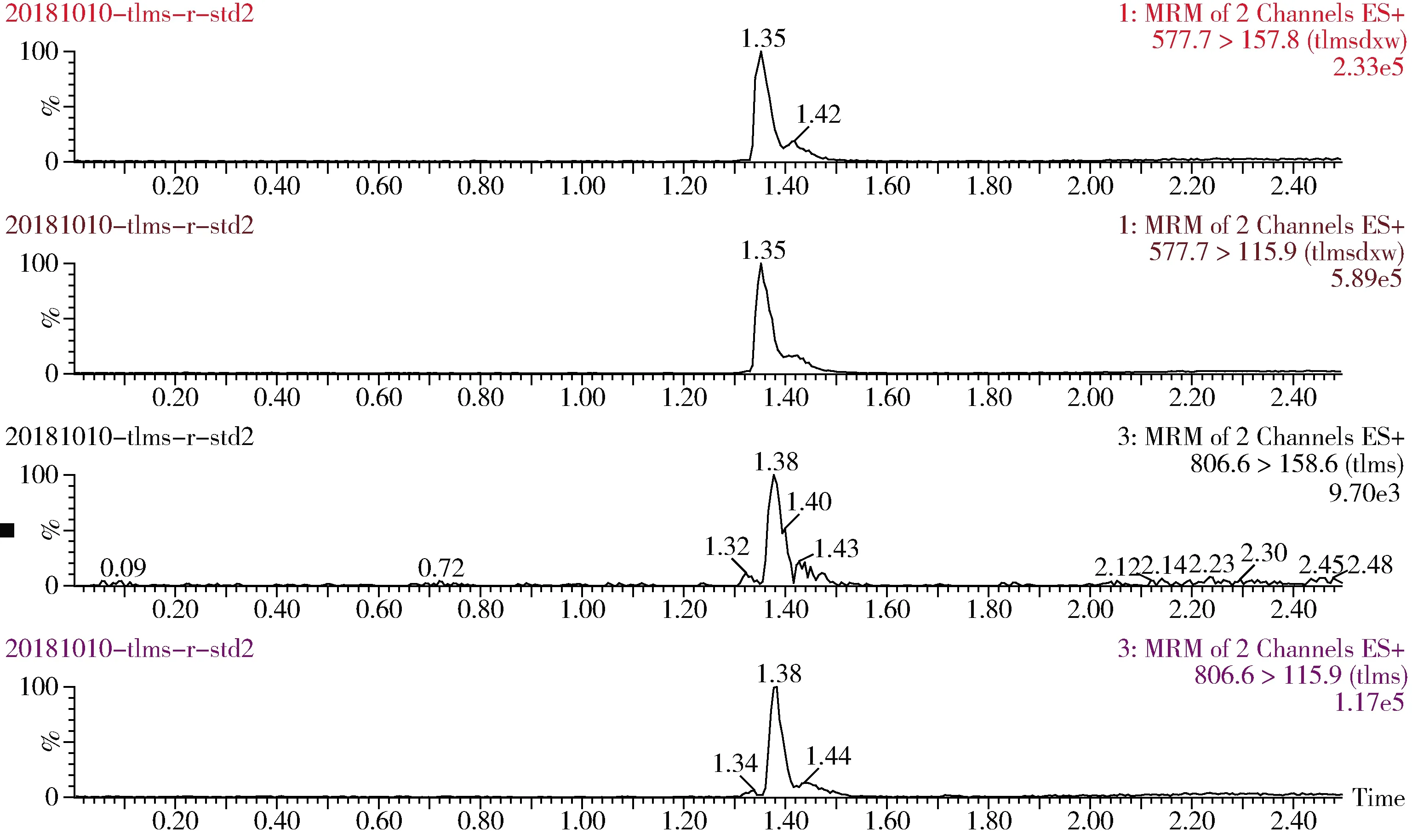
图3 猪肉添加10 μg/kg泰拉霉素及其代谢物特征离子色谱图Fig 3 The spiked chromatogram of tulathromycin and its metabolite for pork(10 μg/kg)
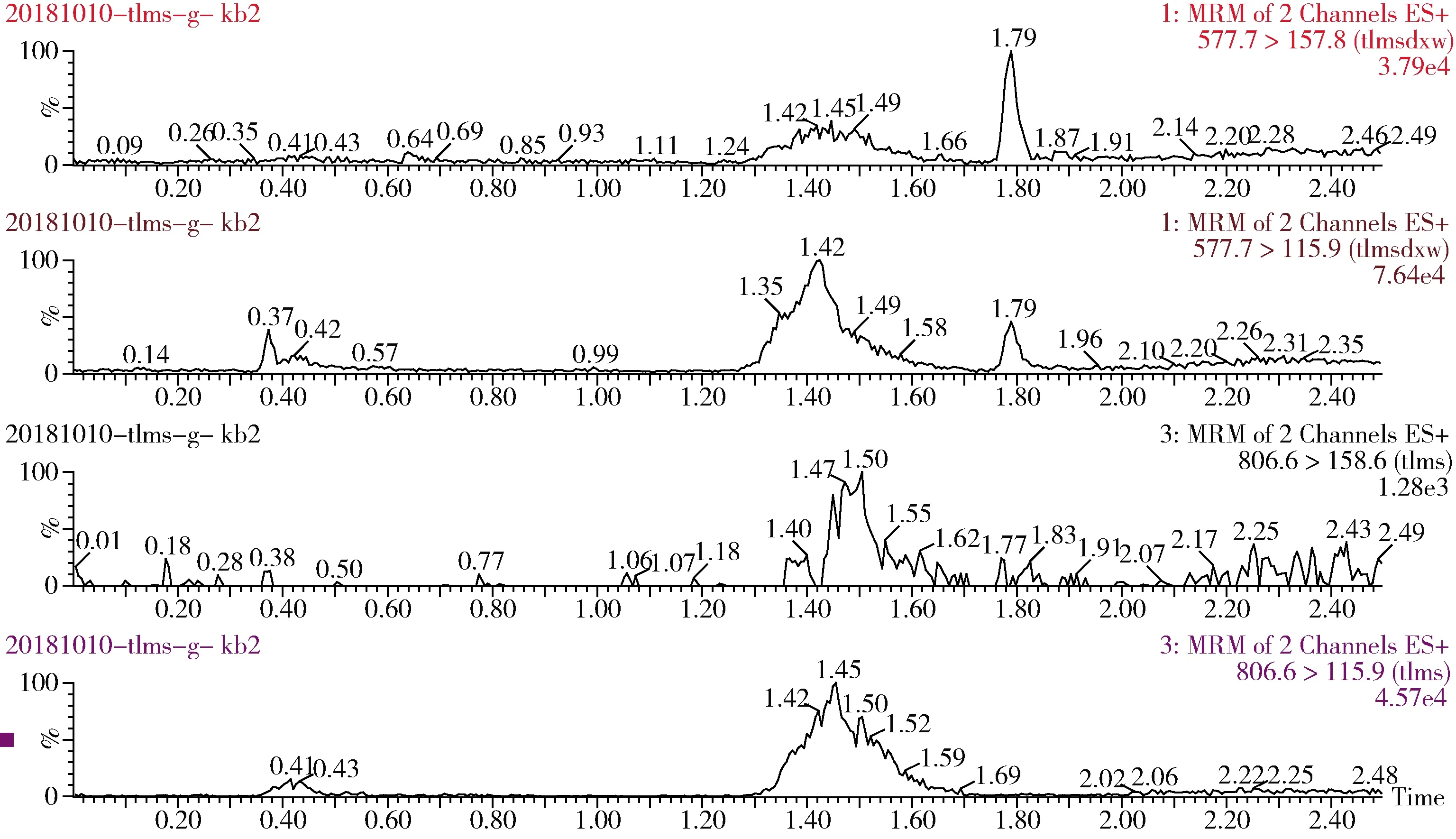
图4 泰拉霉素及其代谢物猪肝脏空白特征离子色谱图Fig 4 The blank chromatogram of tulathromycin and its metabolite for pig liver
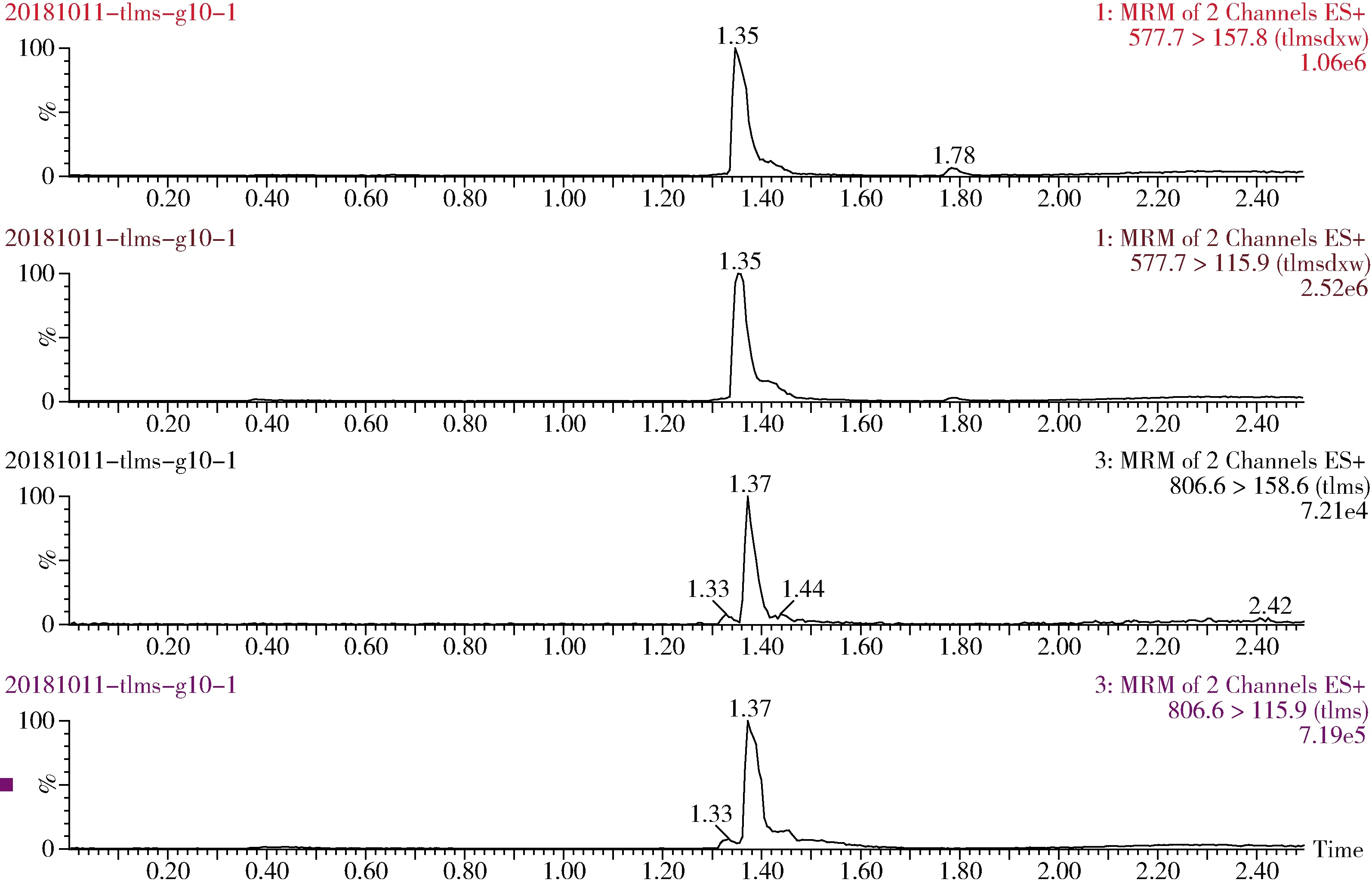
图5 猪肝脏添加10 μg/kg泰拉霉素及其代谢物特征离子色谱图Fig 5 The spiked chromatogram of tulathromycin and its metabolite for pig liver(10 μg/kg)
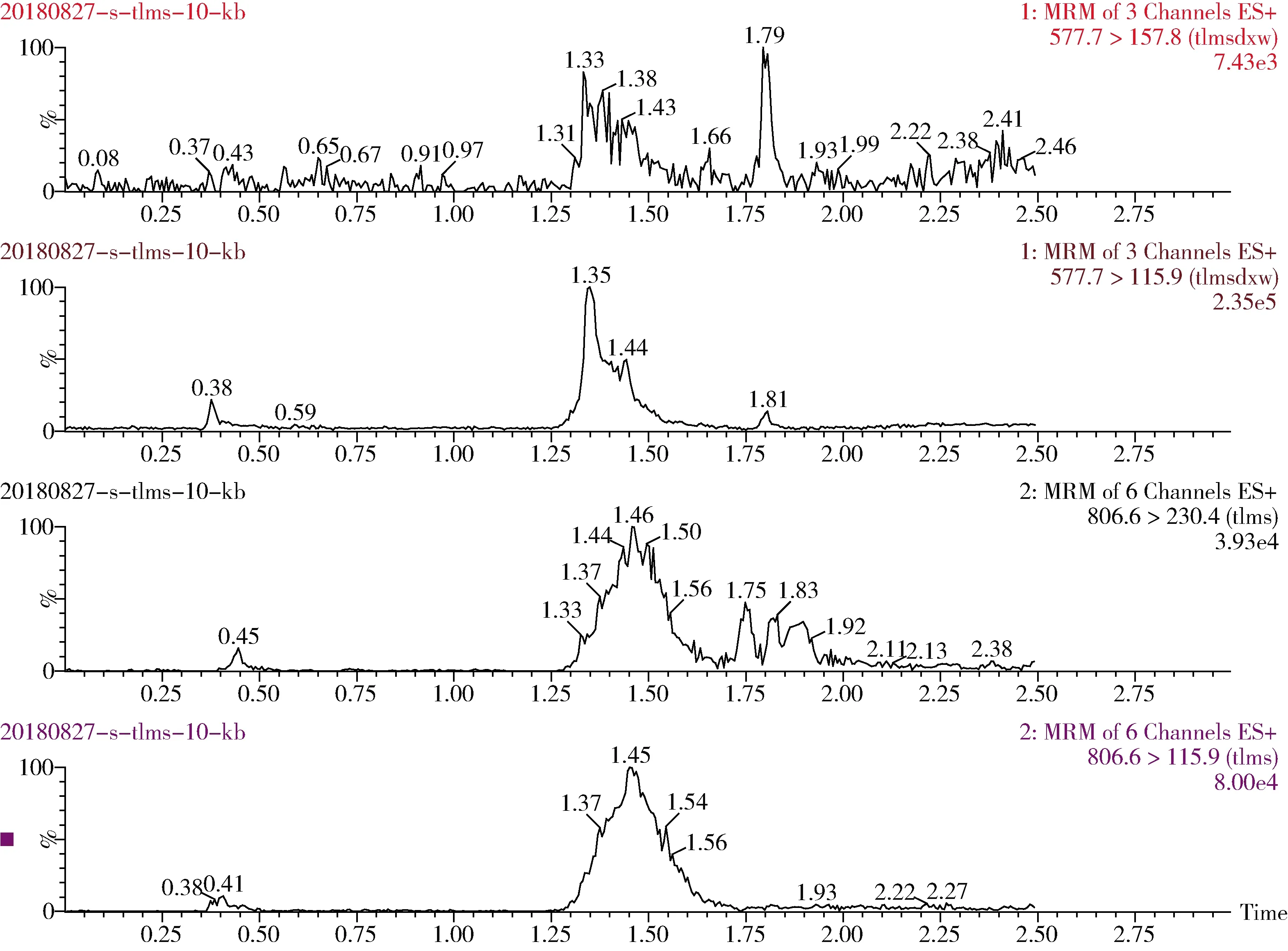
图6 泰拉霉素及其代谢物猪肾脏空白特征离子色谱图Fig 6 The blank chromatogram of tulathromycin and its metabolite for pig kidney
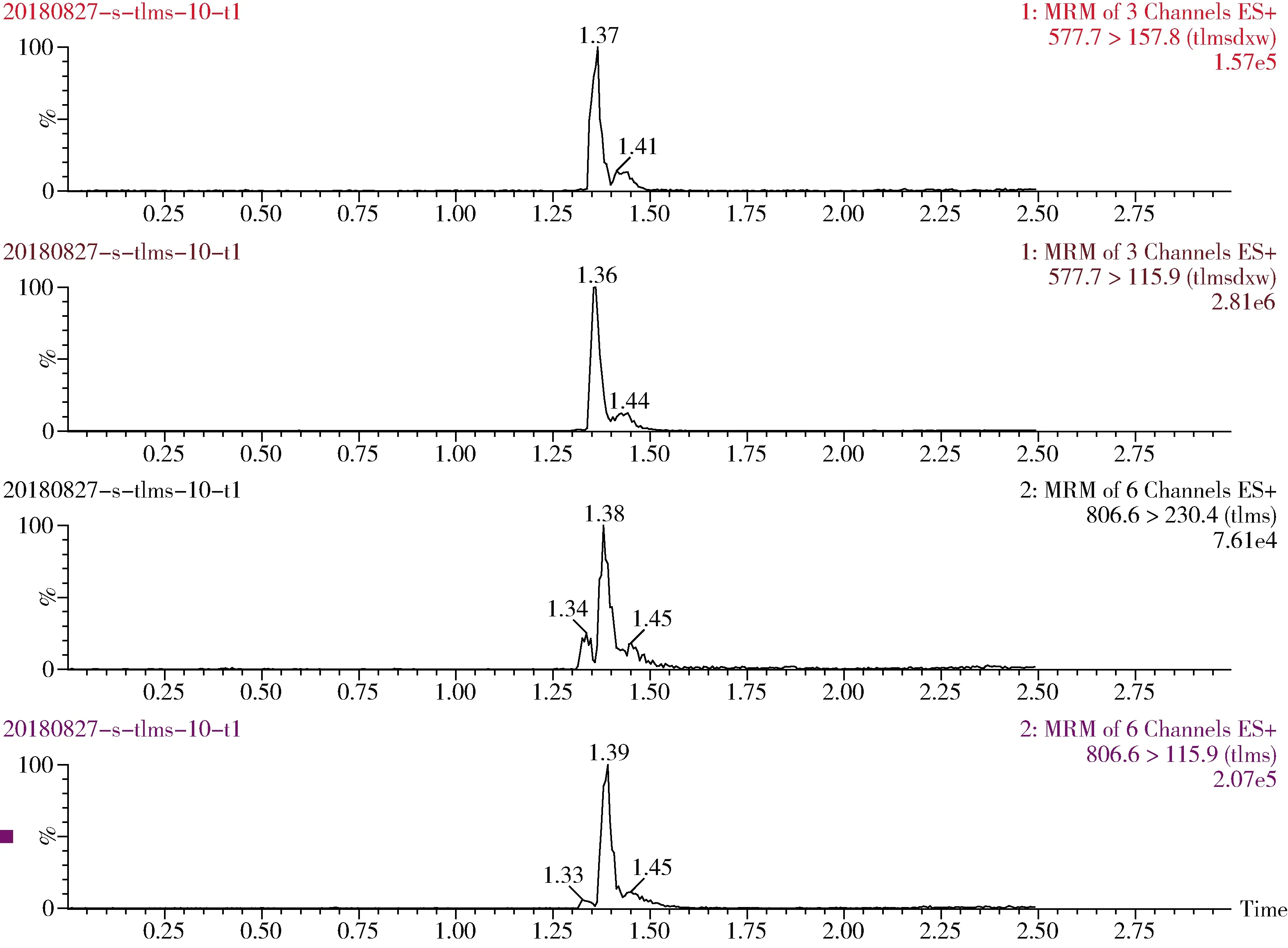
图7 猪肾脏添加10 μg/kg泰拉霉素及其代谢物特征离子色谱图Fig 7 The spiked chromatogram of tulathromycin and its metabolite for pig kidney(10 μg/kg)
2.4 检测方法准确度和精密度 分别准确称取空白样品2 g,添加一定体积的标准工作溶液,使组织中泰拉霉素及其代谢物浓度分别为10、3000、6000 μg/kg(猪肉、肝脏、肾脏),按上述样品前处理方法处理后进行测定,高浓度样品进行适当稀释后再测定。一日内每种药物的每个添加浓度取5个平行样品分别进行测定,计算回收率和日内相对标准偏差;每个添加浓度设5个平行,每天测定1批,重复测定3 d,计算回收率和日间相对标准偏差。猪组织样品中泰拉霉素及其代谢物在10~6000 μg/kg添加水平内的平均回收率在72.6%~105.8%之间,日内相对标准偏差在0.5%~12.1%之间,日间相对标准偏差在2.9%~8.1%之间。具体结果详见表4~表6。
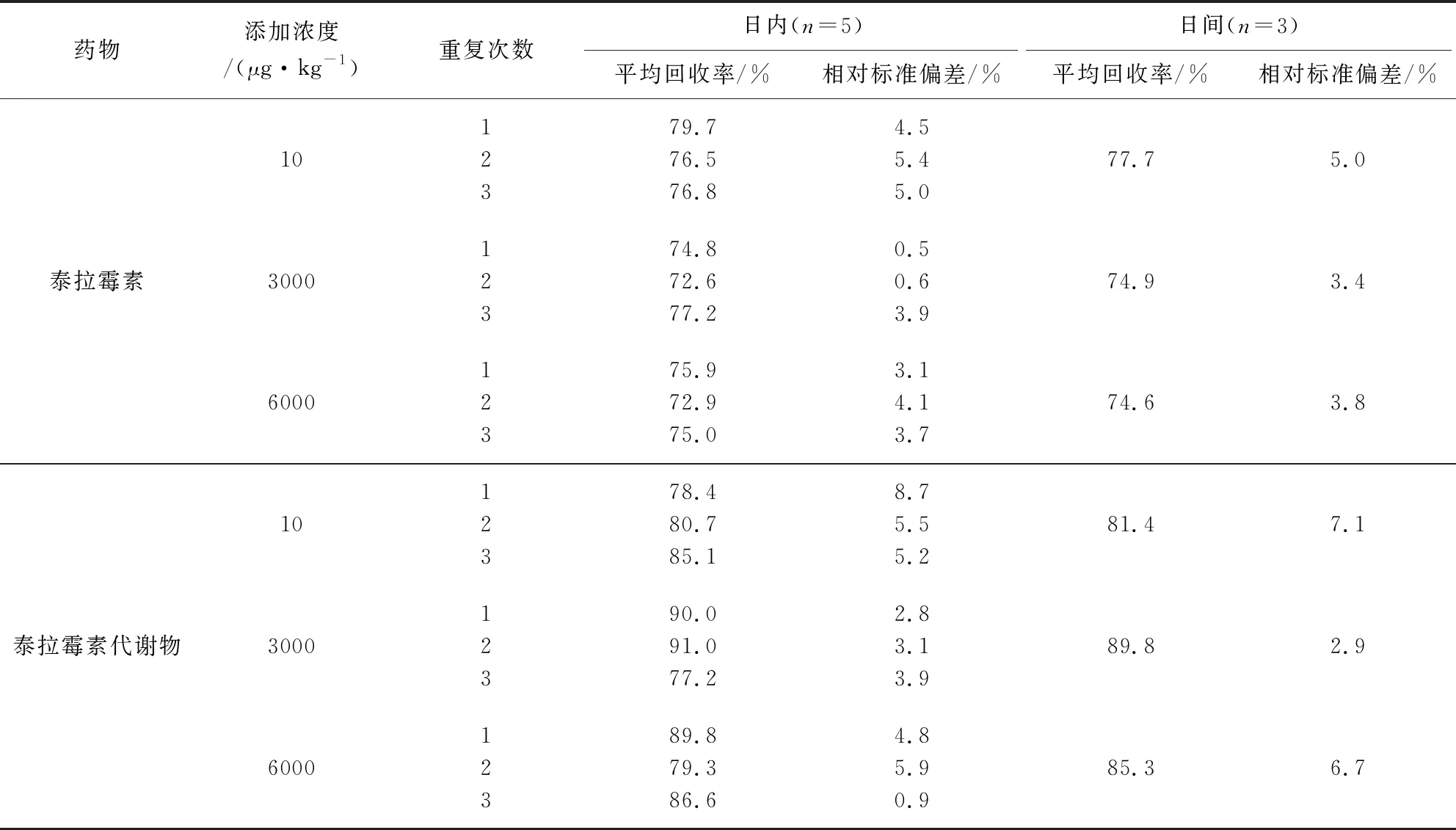
表4 猪肉中添加回收率和相对标准偏差Tab 4 The average recoveries and relative standard deviations (RSDs) of tulathromycin and its metabolite for pork
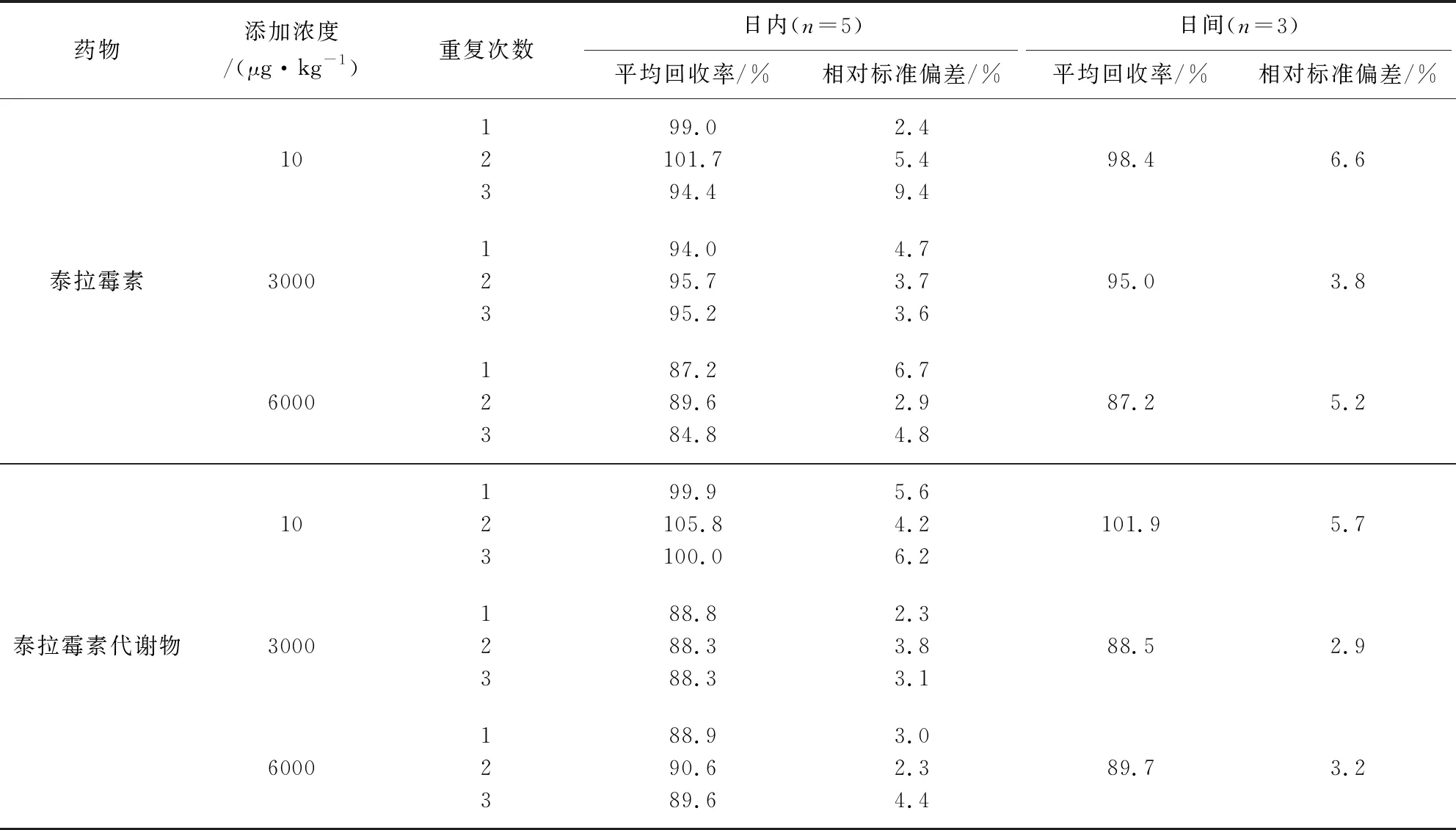
表5 猪肝脏中添加回收率和相对标准偏差Tab 5 The average recoveries and relative standard deviations (RSDs) of tulathromycin and its metabolite for pig liver
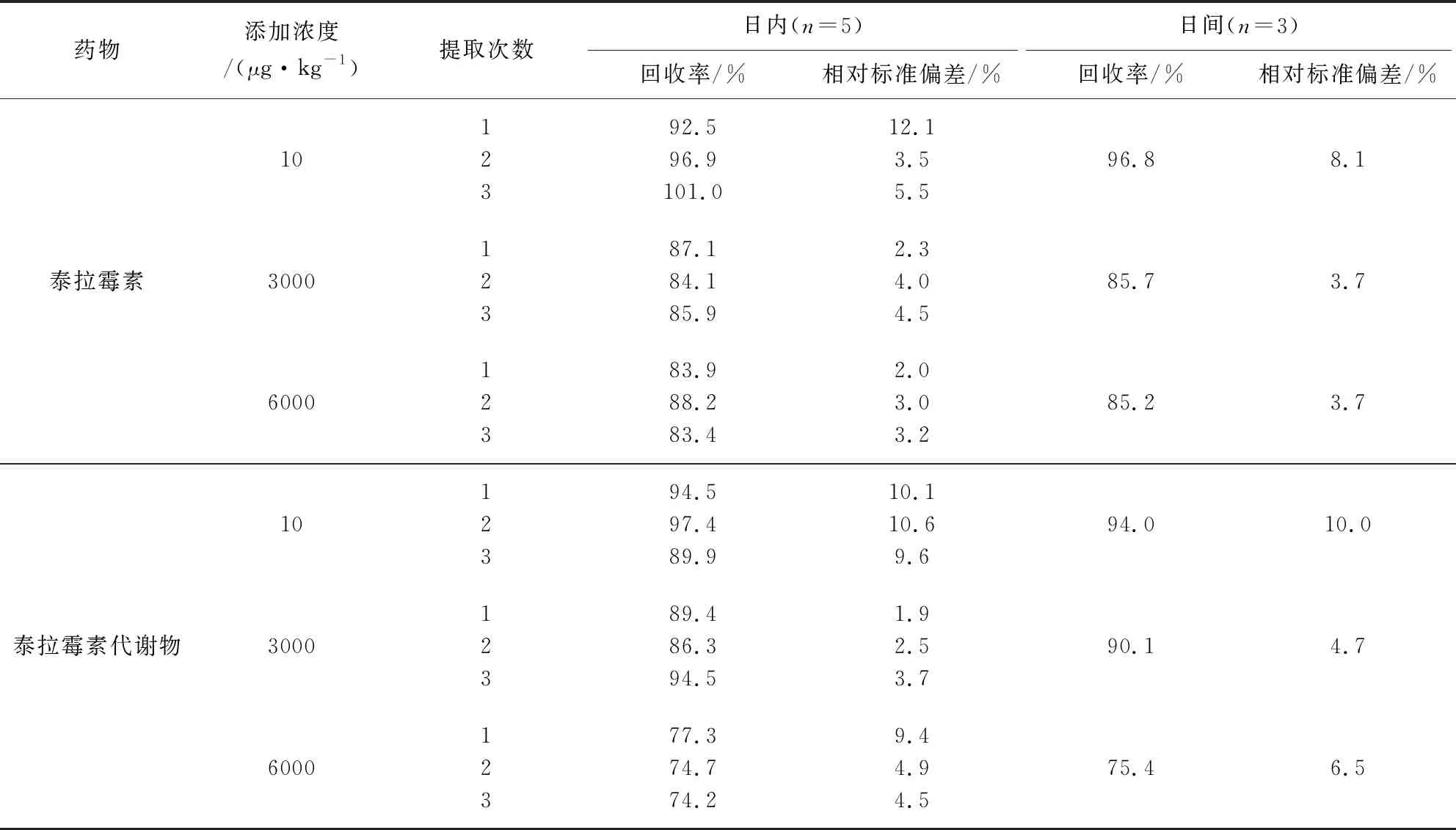
表6 猪肾脏中添加回收率和相对标准偏差Tab 6 The average recoveries and relative standard deviations (RSDs) of tulathromycin and its metabolite for pig kidney
3 讨论与结论
3.1 样品提取条件优化 泰拉霉素为弱碱性化合物,易溶于酸性溶液和极性溶液,因此,在样品前处理过程中分别考察了乙腈、0.1%甲酸乙腈、乙腈+0.1%甲酸水(7+3)和0.1%甲酸水四种样品提取溶液对猪组织中泰拉霉素的提取效率。实验中乙腈和0.1%甲酸乙腈加入猪组织中会立即产生蛋白质凝集沉淀,不宜于组织的涡旋分散,从而影响泰拉霉素的提取效率;0.1%甲酸水虽然能够使猪组织涡旋分散,但是无法使蛋白质变质沉淀,提取液浑浊不利于后续的净化操作;乙腈+0.1%甲酸水(7+3)不仅能够使猪组织涡旋分散,而且能够使蛋白质变质沉淀,提取上清液杂质较少,同时正己烷除脂能够使上清液更加干净,有利于后续提取液的净化过程。因此,本实验的样品提取液最终选择乙腈+0.1%甲酸水(7+3)。
3.2 样品净化条件优化 由于泰拉霉素含有3个氨基基团,具有一定的离子性,因此,本实验进一步采用阳离子固相萃取柱对提取液进行净化。实验中分别选取了弱阳离子交换柱(WCX)、混合型阳离子交换柱(MCX)和强阳离子交换柱(SCX)对泰拉霉素的提取效果进行了考察,结果表明:SCX柱和WCX柱对泰拉霉素的回收率均低于MCX柱(图8),这可能是因为SCX柱是强阳离子交换柱,对泰拉霉素的保留太强,导致泰拉霉素的回收率偏低;而WCX柱属于弱阳离子交换柱,对泰拉霉素的保留不强而导致回收率偏低。MCX柱属于混合阳离子交换柱,兼具离子交换和反相的特点,对碱性化合物具有较高的选择性和灵敏度,因此,本实验最终选择MCX固相萃取柱用于样品净化。
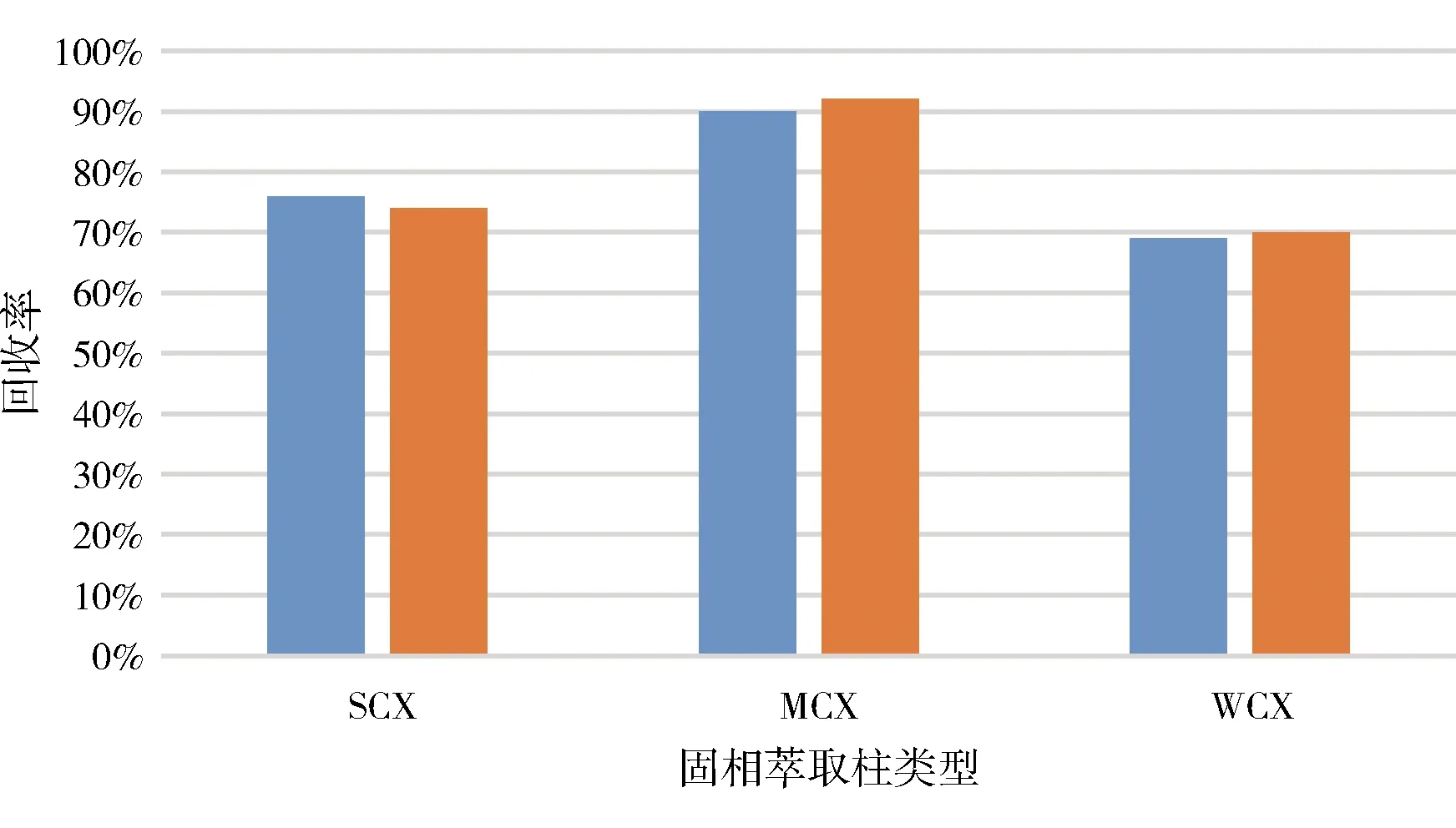
图8 三种不同阳离子交换柱对泰拉霉素及其代谢物的回收率(三种交换柱中第一个均为泰拉霉素,第二个均为泰拉霉素代谢物)Fig 8 The recoveries of tulathromycin and its metabolite for three different cation exchange columns
3.3 色谱条件优化 本实验采用BEH C18反相色谱柱(2.1 mm×50 mm,1.7 μm)进行了色谱条件优化,可使目标物在较短的时间内得到很好的色谱图。实验中以乙腈-0.1%甲酸水为流动相,对不同梯度条件下的色谱保留进行了考察,最终确定了泰拉霉素及其代谢物的色谱分离条件。
3.4 质谱条件优化 泰拉霉素为碱性化合物,容易获得一个氢离子而带正电,本实验采用电喷雾离子源进行正离子扫描,先通过一级全扫描质谱得到准分子离子峰([M+H]+),随后进行二级质谱扫描分析,通过优化毛细管电压、锥孔电压、碰撞电压等参数,最终确定了泰拉霉素及其代谢物的定性、定量离子对和锥孔电压及碰撞能量。
本研究建立了猪组织中泰拉霉素及其代谢物残留的分析检测方法,样品经提取、净化等处理,超高效液相色谱串联质谱分析检测。结果表明,该方法快速、简便,灵敏度高,重现性好,能够满足对猪肉、肝脏和肾脏中泰拉霉素及其代谢物的残留分析检测,同时也为相关检测单位提供了技术支持。
