hsa-miR-150-5p的生物信息学分析*
2020-07-15李九龙蔡雪梅何德超刘宇欣钟晓武
李九龙,刘 林,张 湘,蔡雪梅,何德超,刘宇欣,钟晓武,龙 璠
1.四川省南充市第五人民医院检验科,四川南充 637100;2.川北医学院附属医院检验科,四川南充 637000
微小RNA (miRNAs)是一类广泛存在于各种生物中、大小为20~25个核苷酸的内源性非编码小分子RNA[1-2]。成熟的miRNA与RNA诱导沉默复合物(RISC)结合,通过与mRNA 3′非编码区(3′UTR)上的靶位点进行互补识别,调控靶基因的表达与翻译[3-4]。miRNAs通过加强转录过程或减少异常转录,从而参与多种生物途径的调控,以及调节与个体生长、发育、疾病发生过程相关基因的表达,在细胞生长、凋亡、肿瘤发生发展等生物过程发挥着重要作用[5-6]。
近年来miRNAs与自身免疫与炎症性疾病关系的相关研究越来越多,有研究发现,miR-155能够激活T细胞依赖性组织炎症[7]。另外,miR-155缺失的纯合体小鼠对实验性自身免疫脑脊髓炎有着很高的抗性[8]。miR-146a过表达抑制了白细胞介素-1β(IL-1β)、肿瘤坏死因子α(TNFα)、单核细胞趋化蛋白1(MCP-1)和IL-8等炎性因子的表达,进而缓解炎性反应过程,说明miR-146a具有减轻炎性反应的作用[9]。Toll样受体4信号通路在调节促炎细胞因子和趋化因子的生成时受到miR-146b的抑制作用[10]。miR-150通过调控接头蛋白(GAB1)和叉头框蛋白P1(FOXP1)的表达,参与B细胞成熟过程[11]。miR-150还可以通过c-Myb转录因子负向调节CD8+T细胞和iNKT细胞,但正向调节NK细胞[12-13]。目前关于miR-150的具体作用机制尚不完全清楚,本研究利用miRNAs的进化保守性,探讨人类miR-150基因hsa-miR-150-5p在其基因家族的进化关系。本研究通过靶标预测、数据整理和信息分析,获得相关信息,同时分析了靶基因的生物学功能,为研究hsa-miR-150-5p靶基因的作用机制及功能奠定基础。
1 材料与方法
1.1材料 miRNA序列数据库miRBase[14](http://www.mirbase.org/cgi-bin/browse.pl),人类miRNA表达数据库(HMED)[15](http://bioinfo.life.hust.edu.cn/smallRNA/index.php),序列比对软件Clustalw2 (https://www.ebi.ac.uk/Tools/psa/wise2dba/)和进化分析软件MEGA5.0[16],miRNA靶基因预测在线软件TargetScan[17](http://www.targetscan.org/)、miRDB[18](http://mirdb.org/miRDB/)和PicTar[19](http://www.pictar.org/),基因本体(GO)[20](http://geneontology.org/)和代谢通路富集分析(KEGG)[21](http://www.kegg.jp/)。
1.2方法
1.2.1hsa-miR-150-5p表达谱分析 利用HMED在线工具检索获得hsa-miR-150-5p在不同组织和疾病中的每百万读段中来自某基因的读段数(RPM)数据,得到其在不同组织和疾病中特异性表达丰度信息,从而为hsa-miR-150-5p的组织和疾病定位及功能研究提供更多信息。
1.2.2序列分析 从miRNA序列数据库miRBase中获得所有物种hsa-miR-150-5p的碱基序列、染色体定位等信息;利用Clustalw2软件对所有物种hsa-miR-150-5p的碱基序列进行多序列比对,分析所有序列特征;再用MEGA5.0软件构建系统进化树,采用基于距离参数的邻接法(NJ),并自举检验1 000次。
1.2.3靶基因预测及功能注释 运用在线软件miRDB、PicTar和TargetScan预测hsa-miR-150-5p的靶基因,最后以3个数据库预测结果的交集作为hsa-miR-150-5p候选的靶基因。再利用GO和KEGG对靶基因的生物学功能注释分析,进一步认识hsa-miR-150-5p的生物学功能。
2 结 果
2.1hsa-miR-150-5p表达谱 在HMED数据库中,RPM<1代表miRNAs低表达或不表达, RPM≥100说明miRNAs呈高表达。本研究结果显示,hsa-miR-150-5p在较多组织和疾病标本中均呈高表达,比如在正常皮肤、银屑癣、扁桃体等组织,肺癌、淋巴瘤等疾病中高水平表达(RPM≥100),在急性淋巴细胞性白血病(ALL)、乳腺癌表达水平更高,其中,在乳腺癌表达水平最高,RPM达到2 183。
2.2miR-150基因家族成员的分布特征分析 通过同源性搜索在miRBase数据中获得 miRNA-150基因家族成员的序列36条,都具有典型的茎环状二级结构,分布于人类、猩猩、鼠等23个物种。绝大部分miRNA-150基因家族成员位于基因间隔区,少数成员位于外显子和内含子,还有基因位置未知的。如大猩猩ggo-miR-150和灰短尾负鼠mdo-miR-150分布位于ENSGGOT00000008813的第1个内含子和ENSMODT00000031346的第5个内含子。见表1。
2.3hsa-miR-150-5p序列同源性分析 人类成熟hsa-miR-150-5p序列号为MIMAT0000451,定位于人类基因组第19号染色体,其碱基数与绝大部分物种均为22个,除了牛bta-miR-150-5p、灰短尾负鼠mdo-miR-150-5p 和眼镜王蛇oha-miR-15-5p的碱基数23个,青鳉ola-miR-150-5p、三文鱼ssa-miR-150-5p和大棕蝠efu-miR-150-5p的碱基数为21个,以及最短的袋獾sha-miR-150-5p碱基数为19个。采用Clustalw2在线软件进行序列比对发现,miR-150基因家族成员序列碱基具有高度保守性,其中有16个碱基完全保守,6个碱基相对保守。但有一个碱基保守性较低,可能是由于miR-150基因家族进化过程中发生碱基的插入事件,引起了成熟序列长度发生变化。袋獾sha-miR-150-5p和大棕蝠efu-miR-150-5p成熟序列可能是在进化过程中发了缺失事件,所以序列长度变短。见图1。
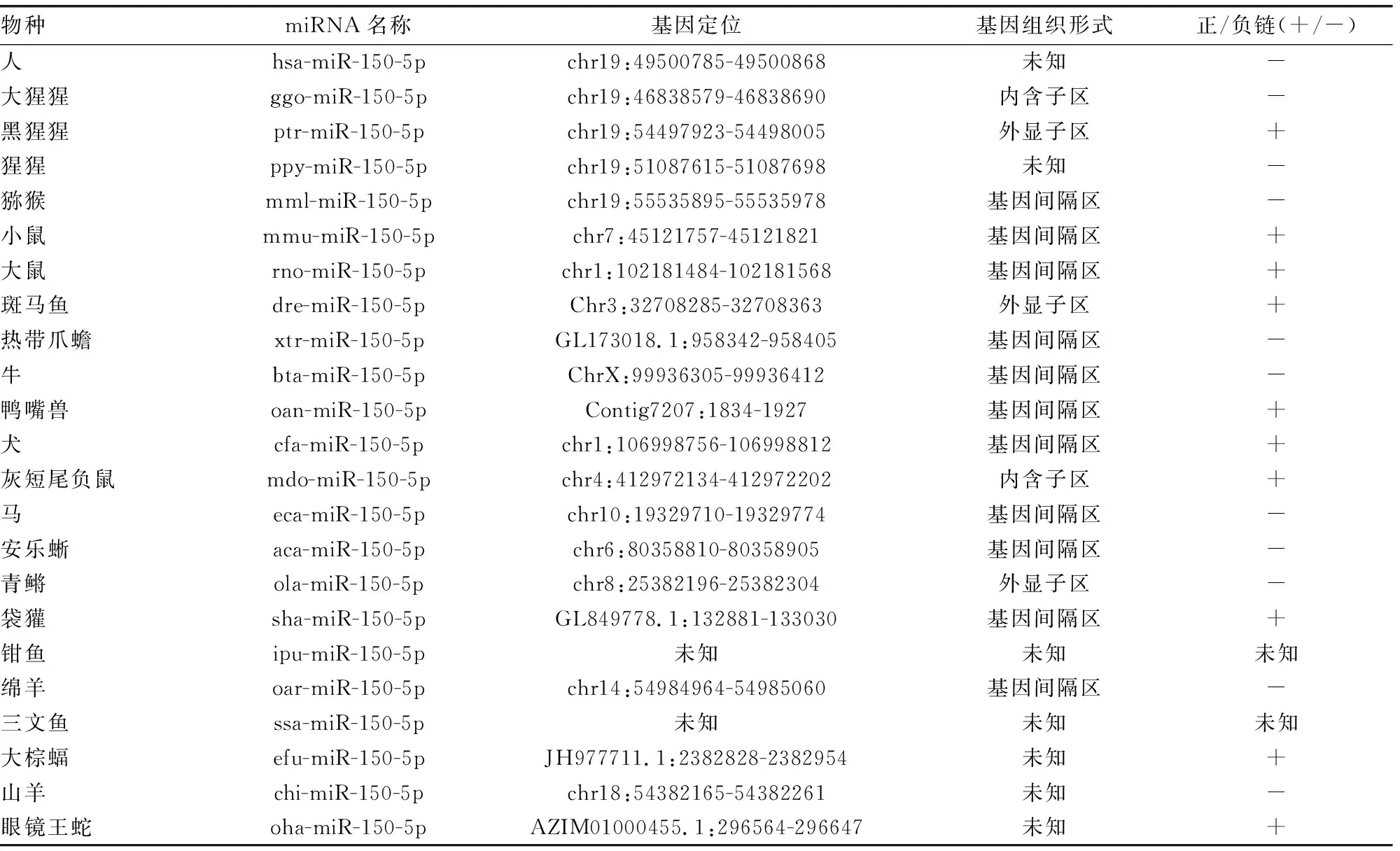
表1 不同物种miR-150基因家族成员在基因组的分布特征

图1 miR-150基因家族成员成熟序列多重比对
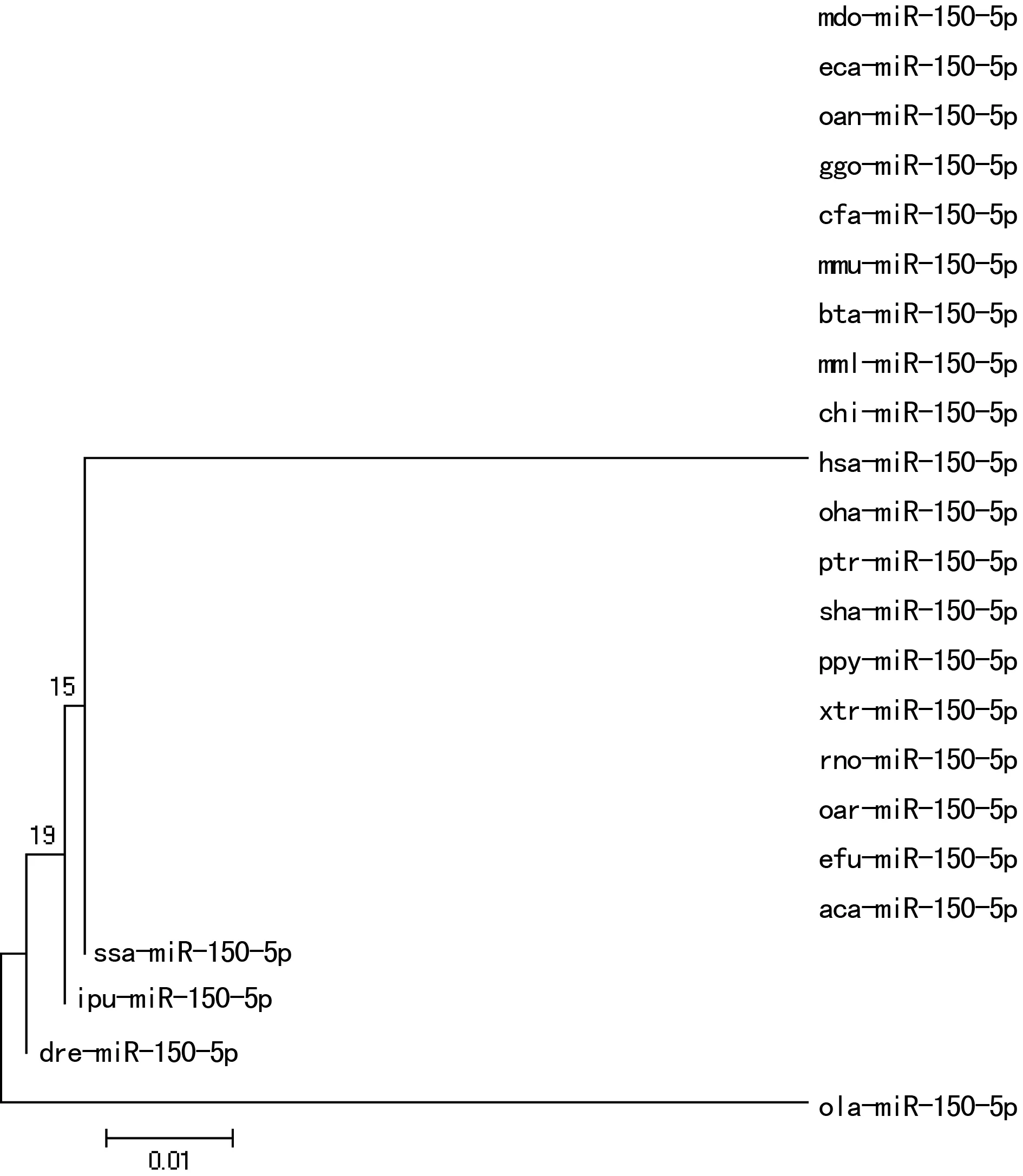
图2 miR-150基因家族成员的系统进化树
2.4miR-150基因家族成员系统进化分析 对23个物种的miR-150基因家族成员进行进化分析,发现系统进化树分为5支:青鳉、三文鱼、钳鱼、斑马鱼均单独聚为一支,人类等19个物种聚为一支,见图2。说明了人类的miR-150与青鳉、三文鱼、钳鱼、斑马鱼的分子系统进化关系较远,与其他18个物种的进化关系较近。
2.5miR-150靶基因预测及功能分析 为了提高预测的准确性,选用3种靶基因分析软件PicTar、TargetScan和miRDB预测人类hsa-miR-150-5p的靶基因,分别获得209、351和379个靶基因,最后取三者的交集作为候选靶基因(共25个)。hsa-miR-150-5p参与多个信号通路的调节,包括转录因子、锌指蛋白、Toll样受体信号通路的转导蛋白、ATP耦联的离子型通道受体和细胞因子信号传导抑制蛋白等,见表2。

表2 3种靶基因分析软件均能预测到的hsa-miR-150-5p靶基因
注:BP,生物过程;CC,细胞构成;MF,分子功能。
3 讨 论
miRNA具有高度的保守性,在许多生物学过程中发挥重要调控作用,从而能保证生物生命活动正常有效地进行[22]。miRNAs可通过促进抗炎因子的生成而抑制炎性信号通路,最终使致炎因子释放减少而抑制炎性反应[23]。有研究显示,miRNAs 能在获得性免疫和固有免疫中起着重要的调控作用,对机体自身的免疫系统具有精细的调节作用,能够防止机体出现过度的免疫激活[24]。研究发现,miR-150的表达异常能够引起免疫系统疾病的发生。ZHOU等[25]研究发现,miR-150在淋巴结和脾脏中的表达水平显著增加,并且可以调控靶基因的表达,进而调节机体免疫系统,调控 T/B细胞的分化。HONDA等[26]发现,在系统性硬化病患者中miR-150表达下降,其主要通过调控整合素β3,影响整合素的表达,然后参与系统性硬化病的发生、发展过程。在不同的疾病中,miR-150的作用靶点并不相同,部分靶点和作用机制也需要进一步探讨。因此,利用信息学方法深入分析靶基因信号通路和参与的生物学过程,对进一步研究 hsa-miR-150-5p在人类疾病中调控机制具有重要意义。
本研究发现,人类hsa-miR-150-5p具有25个候选靶基因,它们主要参与了转录因子、锌指蛋白、Toll样受体信号通路的转导蛋白、ATP耦联的离子型通道受体和细胞因子信号传导抑制蛋白等多种生物学过程。其中髓样分化因子(MyD88)是 Toll 样受体信号通路中的一个关键因子,在传达上游信息和疾病发生、发展中具有重要的作用。GHORPADE等[27]研究结果显示,在结核杆菌中 miR-150能直接靶向作用于Toll 样受体信号通路中的重要转导蛋白 MyD88从而调节Toll样受体的表达水平。然而,Toll样受体能够结合MSU刺激并进一步激活下游核转录因子-κB(NF-κB)信号通路从而导致IL-1β前体生成,生成的前体被NLRP3炎性体切割成熟后释放出细胞并能够与细胞表面 IL-1β受体结合,从而激活NF-κB,形成一个正反馈环。
嘌呤受体P2X配体门控离子通道7受体(P2X7R)是IL-1加工和释放中的一个关键因素。P2X7R主要来源于免疫细胞,能通过非选择性阳离子通道或非选择性的大孔隙发挥作用,这种孔隙能够渗透相对分子质量为900的分子。在免疫作用中,P2X7R参与加工和释放各种炎性因子,如IL-1β、IL-18和TNFα[28],因此,P2X7R被视为一种促炎症的受体。既往研究已经证实P2X7R 3′UTR存在miR-150的作用靶点[29],miR-150能够直接靶向作用于P2X7R,同时miR-150能够直接靶向作用于P2X7R促进乳腺癌细胞MCF-7或MDAMB-231和荷瘤小鼠肿瘤的增殖[30]。而 WENG 等[31]研究显示miR-150抑制Ⅰ型肺泡上皮细胞P2X7R水平从而降低Ⅱ型肺泡上皮细胞表面活性物质的分泌。
细胞因子信号传导抑制蛋白1(SOCS1)家族是一类由细胞因子诱导产生,主要参与转录途径负反馈调节的蛋白。WHYTE等[32]发现SOCS1能调节巨噬细胞极化分型,抑制IL-6对M1细胞的诱导分化而将其命名为SOCS1,SOCS1能够抑制巨噬细胞在脂蛋白/干扰素γ(LPS/IFN-γ)刺激下的M1表型,敲除小鼠SOCS1基因可明显上调M1表型的相关基因(如CD86、IL-6和IL-12)[33]并且能够增强NF-κB抑制蛋白(I-κB)和p38磷酸化[34]。同时研究显示SOCS1能够负性调控 M2表型及IL-4信号通路,敲除SCOS1小鼠的骨髓来源巨噬细胞在IL-4刺激后精氨酸酶Ⅰ表达明显增高[32]。另有学者发现,miR-150能够靶向下调SOCS1表达,增加近端肾小管上皮细胞和足细胞促纤维化蛋白表达,从而促进狼疮性肾炎患者肾纤维化[35]。
本研究筛选预测得到25个候选基因,为后续进一步探索hsa-miR-150-5p的调控机制提供了初步的研究方向。由于基因功能研究的限制,部分hsa-miR-150-5p的靶基因无法进行准确注释。但是对hsa-miR-150-5p进行生物学信息分析,不仅有利于hsa-miR-150-5p调控网络的揭示,也为阐明其功能研究提供新的理论基础。