三种方法检测口蹄疫146S抗原含量及抗原稳定性的比较研究
2020-07-15杨生海郭建荣王富强刘西兰董金杰翟国元
杨生海,柴 静,郭建荣,王富强,刘西兰,董金杰,张 军,翟国元,张 勇
(1.甘肃农业大学动物医学院,兰州 730070;2.中农威特生物科技股份有限公司,兰州 730046)
口蹄疫(Foot-and-Mouth Disease, FMD)是一种感染牛、羊和猪等偶蹄动物的、具有高度传染性的动物疫病[1]。口蹄疫病毒(Foot-and-Mouth Disease Virus, FMDV)培养物中可以分离出不同密度的粒子,主要有四种:完全病毒粒子(146S)、空衣壳(75S)、12S蛋白质亚单位(12S)、病毒感染相关成分(VIA抗原4.5S)[2]。
疫苗对动物的保护效果主要取决于两个方面,一是疫苗毒株与流行毒株的相似程度,二是疫苗中抗原的含量[3]。146S抗原含量是决定口蹄疫疫苗质量和免疫效力的关键因素。146S抗原含量检测方法主要有蔗糖密度梯度离心结合紫外分光光度计定量法、蔗糖密度梯度离心结合液相色谱仪定量法及高效液相体积排阻色谱法三种,目前国内各口蹄疫疫苗生产厂家主要采用蔗糖密度梯度离心法测定146S抗原含量并对生产环节进行控制[4-5]。1974年,荷兰口蹄疫学家Barteling采用蔗糖密度梯度离心的方法定量FMDV 146S抗原,能检测出病毒粒子的质量大小[6],基本原理是146S抗原在特定条件下分布在特定浓度的介质中,于259 nm处产生最大紫外吸收峰(用OD259nm表示),OD259nm与146S浓度成正比。蔗糖密度梯度离心法即将口蹄疫病毒样品置于蔗糖密度梯度中离心,在离心力的作用下,样品中的病毒粒子将沉降到相应的密度梯度层内,经紫外分光光度计259 nm检测时有最高吸收峰,而在其他级份层没有吸收峰。收集146S吸收峰级份,用紫外分光光度计进行检测,即可对146S含量进行定量[7]。蔗糖密度梯度离心结合液相色谱仪定量法是董金杰等在紫外分光光度计定量法的基础上演变而来,是将灭活的FMDV经超滤浓缩后分别加于15%~45%的蔗糖梯度顶部,35000 r/min超速离心3 h后,样品中病毒粒子沉降到相应的密度梯度层内,再用安捷伦1260液相色谱仪定量法检测各区带在259 nm处的吸光值,绘制吸收峰图谱,并计算峰的面积从而得到146S抗原含量[8]。高效液相体积排阻色谱法由Spitteler等2011年首次建立,中国科学院过程工程研究所率先在国内开发该方法并验证,目前与中国兽医药品监察所联合负责该方法的改进和应用[9]。该方法利用高效液相色谱技术的凝胶色谱柱分子筛机制,使样品进入色谱柱后,不同组分按其分子大小进入相应孔内,大分子因不能进入颗粒内部,在色谱柱中滞留时间短,先于小分子被流动相洗脱至柱外,通过这种分子筛效应,各组分从大到小依次被洗脱,并进入检测器,由数据处理系统处理色谱信号,即可计算出146S抗原的含量。高效体积排阻色谱技术常用于生物大分子的分离和纯化[10]。为筛选出一种最适合于临床需求的口蹄疫146S抗原含量检测方法,对这三种测量方法作一相关性试验,并对不同条件下口蹄疫抗原的稳定性特性及去除检测过程中的杂质干扰进行了研究。
1 材 料
1.1 仪器设备 冷冻高速离心机(Thermo公司)、超速冷冻离心机(Beckman公司)、超声破碎仪(Bandelin公司)、安捷伦1260高效液相色谱仪、安捷伦Cary100紫外分光光度计、全自动密度梯度制备仪(Biocomp公司)、TOSHO公司TSKgel G4000SWXL色谱柱(基质为亲水修饰的硅胶基质高效液相体积排阻色谱柱)、纯水机、色谱瓶等。
1.2 试剂与溶液 0.01 mmol/L PBS(pH7.6)、正戊醇(分析纯)、三氯乙烯(分析纯)、 聚乙二醇(PEG)6000(优级纯)、无RNA酶蔗糖、10% Nonidet P-40(V/V)、无水硫酸钠、十二水合磷酸氢二钠、二水合磷酸二氢钠、氯化钠(分析纯)、甲醇(色谱纯)、Benzonase核酸酶(上海源叶生物科技有限公司)。
1.3 口蹄疫抗原 口蹄疫抗原样品7份;口蹄疫抗原1号株、口蹄疫抗原2号株、口蹄疫抗原3号株。
2 方 法
2.1 蔗糖密度梯度离心结合安捷伦Cary100紫外分光光度计定量法 取6支12 mL离心管,每支离心管分别加入2 mL的15%蔗糖溶液、2.5 mL的25%蔗糖溶液、2.5 mL的35%蔗糖溶液、2.5 mL的45%蔗糖溶液,观察不同浓度之间界限清晰可见,然后置于4 ℃过夜(10~20 h)以形成连续梯度,或用梯度制备仪制备连续梯度,1支作为对照。取口蹄疫灭活抗原20 mL于50 mL离心管,加入5 mL三氯乙烯(抗原与三氯乙烯比例为4∶1),用力振摇5 min,置冷冻高速离心机,4 ℃ 3000 g离心15 min,离心后,准确取上清液10 mL,加入0.7 g PEG6000,4 ℃连续搅拌4 h,或40% PEG6000加入2.12 mL,混匀,再静置过夜。将前一天PEG沉淀抗原液,移入离心管4 ℃ 10000 g离心1 h以沉淀病毒抗原。弃上清液,于离心管内加入1 mL含1% NP40的PBS(pH7.6)浸润沉淀后超声,取1.0 mL样品加入装有蔗糖梯度的离心管,10 ℃ 35000 r/min离心2.5 h。将安捷伦Cary100紫外分光光度计检测波长调为259 nm,开始测定并记录数据,直至一管样品收集完毕。
样品管OD值减去空白对照管相对应每个点的OD值,再将每一个样品数据,采用EXCEL绘制点线图,对照管为相对比较平滑的直线;测定样品管的数据在35%~45%区域有一个明显的峰区;含量越高峰值越高,确定峰区的点后计算146S含量。
2.2 蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法 取6支12 mL离心管,每支离心管分别加入2 mL的15%蔗糖溶液、2.5 mL的25%蔗糖溶液、2.5 mL的35%蔗糖溶液、2.5 mL的45%蔗糖溶液,观察不同浓度之间界限清晰可见,然后置于4 ℃过夜(10~20 h)以形成连续梯度,或用梯度制备仪制备连续梯度,样品10000 r/min离心5 min,取1.5 mL样品加入装有蔗糖梯度的离心管,10 ℃ 35000 r/min离心3 h。
将安捷伦1260液相色谱仪流速调为1 mL/min,在259 nm波长下测定紫外吸光光度值,电脑自动记录检测曲线,根据检测曲线对146S抗原峰手动积分,结合1 μg口蹄疫146S抗原的峰面积计算所得每毫升抗原的146S含量。
2.3 高效液相体积排阻色谱法 配制50 mmol/L 磷酸缓冲液,含0.1 mol/L Na2SO4,测定pH值应在7.2~7.4,使用孔径0.2 μm滤膜,过滤脱气处理后使用。高效液相色谱仪检测波长调为259 nm,进样量100 μL,流速0.6 mL/min,采集时间30 min。先用纯水冲洗仪器管路,再更换流动相冲洗,待流动相充满仪器管路,接入色谱柱平衡,观察基线平稳后开始检测。用稀释液将146S标准品系列稀释,HPLC进样检测。采用系统自动积分146S在259 nm下的峰面积,以峰面积为横坐标,相应146S浓度为纵坐标,在EXCEL程序中绘制过原点的线性趋势线作为标准曲线。
检测样品色谱图中146S峰保留时间应与标准品色谱图中146S峰的保留时间一致,积分得检测样品146S峰面积,将峰面积代入标准曲线,即得146S抗原含量。
2.4 三种检测方法的重复性验证 采用蔗糖密度梯度离心结合安捷伦Cary100紫外分光光度计定量法重复检测口蹄疫抗原1号株样品20次,计算检验结果的相对偏差;采用蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法重复检测口蹄疫抗原2号株样品50次,计算检验结果的相对偏差;采用高效液相体积排阻色谱法重复检测口蹄疫抗原3号株样品20次,计算检验结果的相对偏差。
2.5 口蹄疫抗原稳定性实验 蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法重复性好,简便易行,所以将口蹄疫A型抗原和O型抗原各1株4 ℃放置12个月后,每个月采用蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法检测抗原含量的变化,将此2株抗原反复多次冷冻融化后检测抗原含量的变化。
2.6 利用全能核酸酶去除杂蛋白干扰的实验 取2支口蹄疫抗原,各吸取2 mL,加入全能核酸酶(Benzonase酶)5 μL,室温下200 r/min快速摇匀1 h后,3000 r/min 4 ℃离心6 min。按照2.2蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法检测2支口蹄疫抗原及Benzonase核酸酶处理过的抗原含量,根据色谱图分析全能核酸酶是否能有效去除杂蛋白干扰,提高色谱纯化效率。
3 结果与分析
3.1 紫外分光光度计定量法及液相色谱仪定量法检测结果 结果见表1。对表1中的两组数据作单因素方差分析,F值为1.659,Fcrit值为4.0069,P-value值为0.2028,F小于Fcrit,P-value高于0.05,表示两组数据无差异,证明安捷伦Cary100紫外分光光度计定量法和安捷伦1260液相色谱仪定量法两种方法检测结果相关性显著。
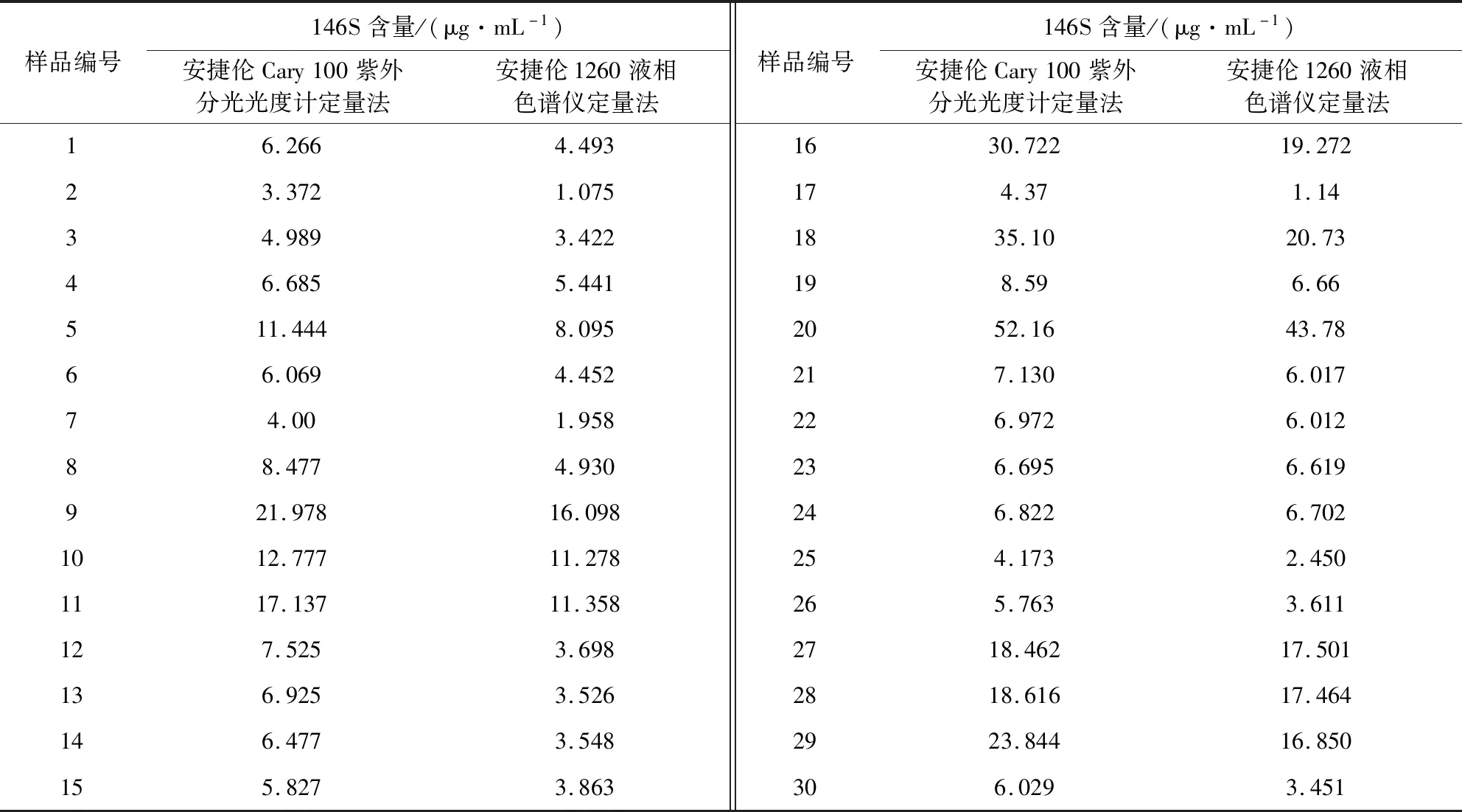
表1 安捷伦Cary100紫外分光光度计定量法和安捷伦1260液相色谱仪定量法的检测数值Tab 1 Detection values of Agilent Cary 100 UV spectrophotometer quantitative method and Agilent 1260 liquid chromatography quantitative method
3.2 紫外分光光度计定量法和液相色谱仪定量法相关性 图1结果显示,安捷伦Cary100紫外分光光度计定量法和安捷伦1260液相色谱仪定量法检测数值相关系数R2=0.9456,直线回归方程为:y=0.771x-0.546,两种方法的检测数值呈正线性相关,并且相关性极显著。
3.3 液相色谱仪定量法和高效液相体积排阻色谱法相关性 对表2中的两组数据作单因素方差分析,F值为0.0026,Fcrit值为4.1709,P-value值为0.9594,F小于Fcrit,P-value高于0.05,表示两组数据无差异,证明安捷伦1260液相色谱仪定量法和高效液相体积排阻色谱法两种方法检测结果相关性显著。
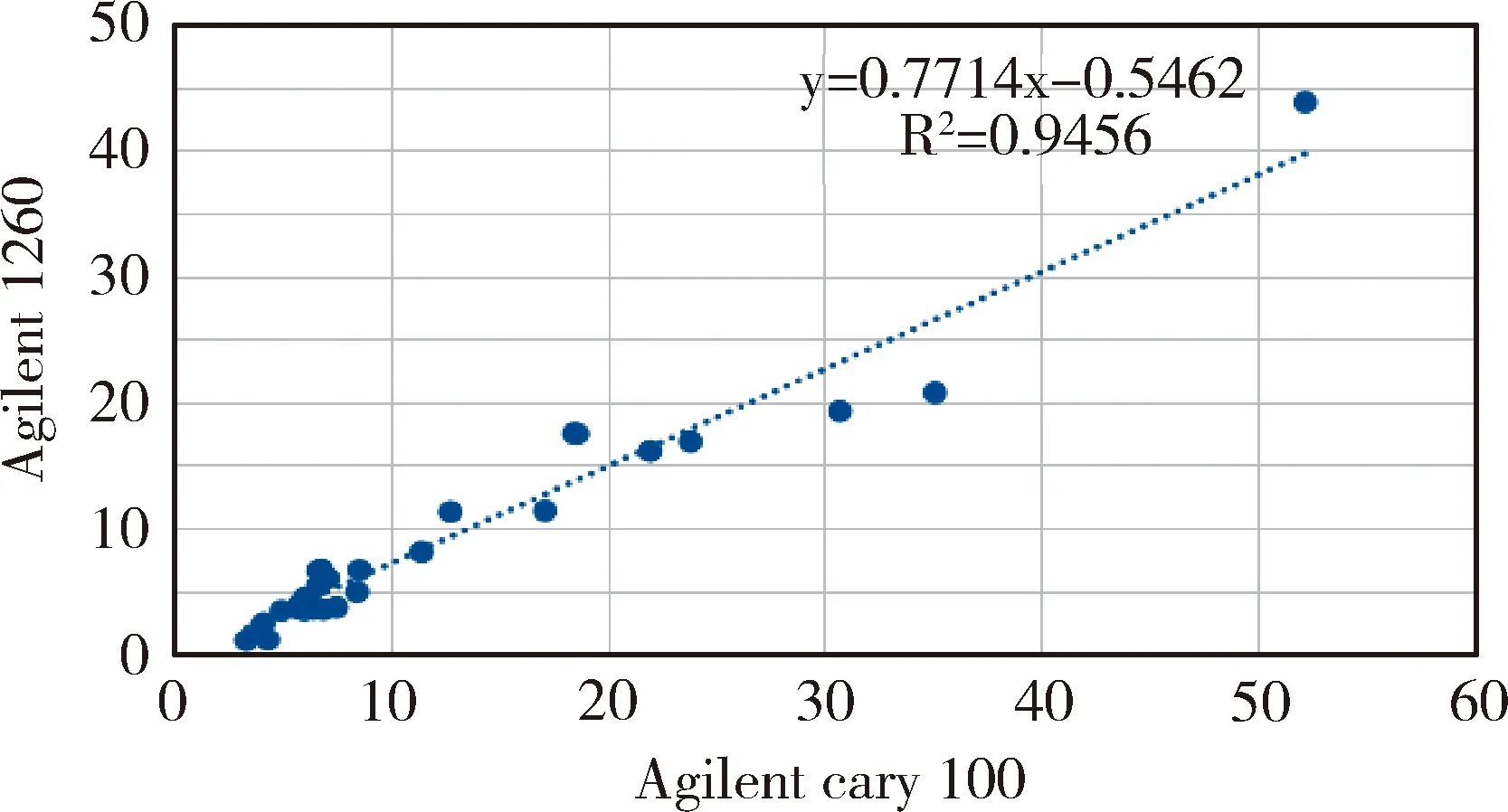
图1 安捷伦Cary 100紫外分光光度计定量法和安捷伦1260液相色谱仪定量法检测数值的相关性Fig 1 Correlation between quantitative method of Agilent Cary 100 UV spectrophotometer and quantitative method of Agilent 1260 liquid chromatography
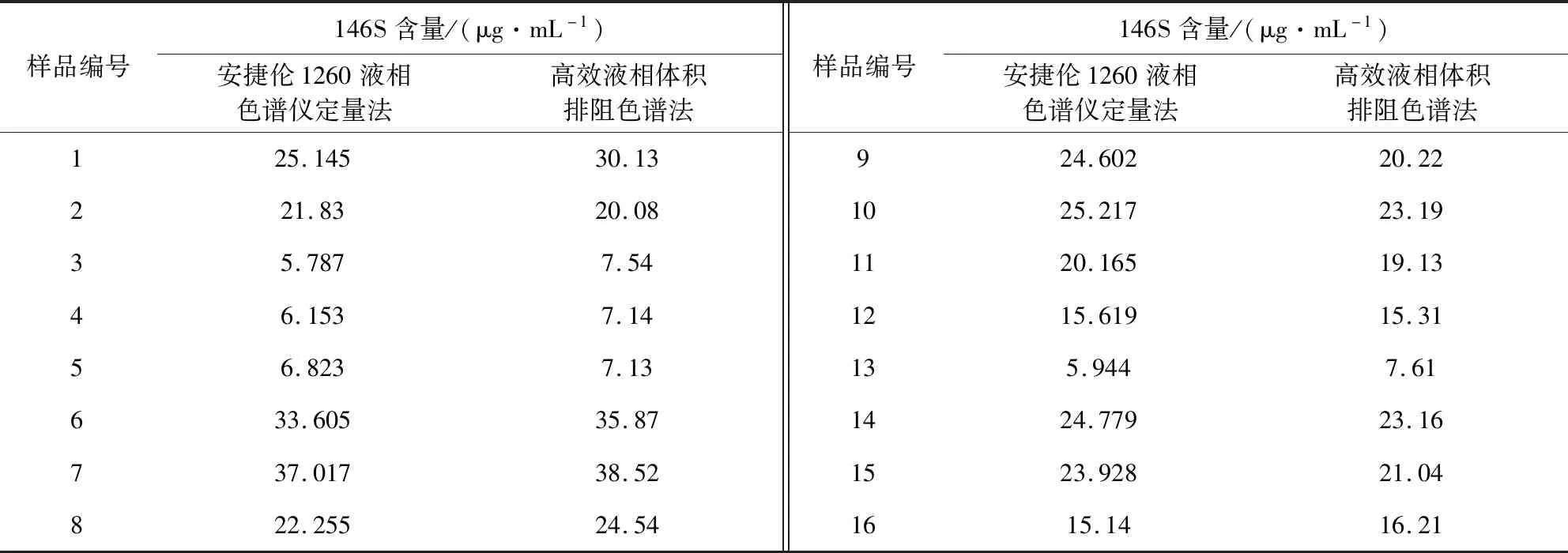
表2 安捷伦1260液相色谱仪定量法和高效液相体积排阻色谱法的检测数值Tab 2 Detection values of Agilent 1260 liquid chromatography quantitative method and high performance volume exclusion chromatography
图2结果显示,安捷伦1260液相色谱仪定量法和高效液相体积排阻色谱法检测数值相关系数R2=0.9416,直线回归方程为:y=0.9656x+0.5053,两种方法的检测数值呈正线性相关,并且相关性极显著。
3.4 紫外分光光度计定量法重复性试验结果 表3结果显示,口蹄疫抗原1号株样品检测20次,相对偏差大于10%的样品数为6个,相对偏差在5%~10%之间的样品数为8个,相对偏差在1%~5%之间的样品数为5个,相对偏差在1%以下的样品数为1个,用统计学方法计算此组检测数值的标准偏差σ值为2.1073,证明此检测方法重复性一般。
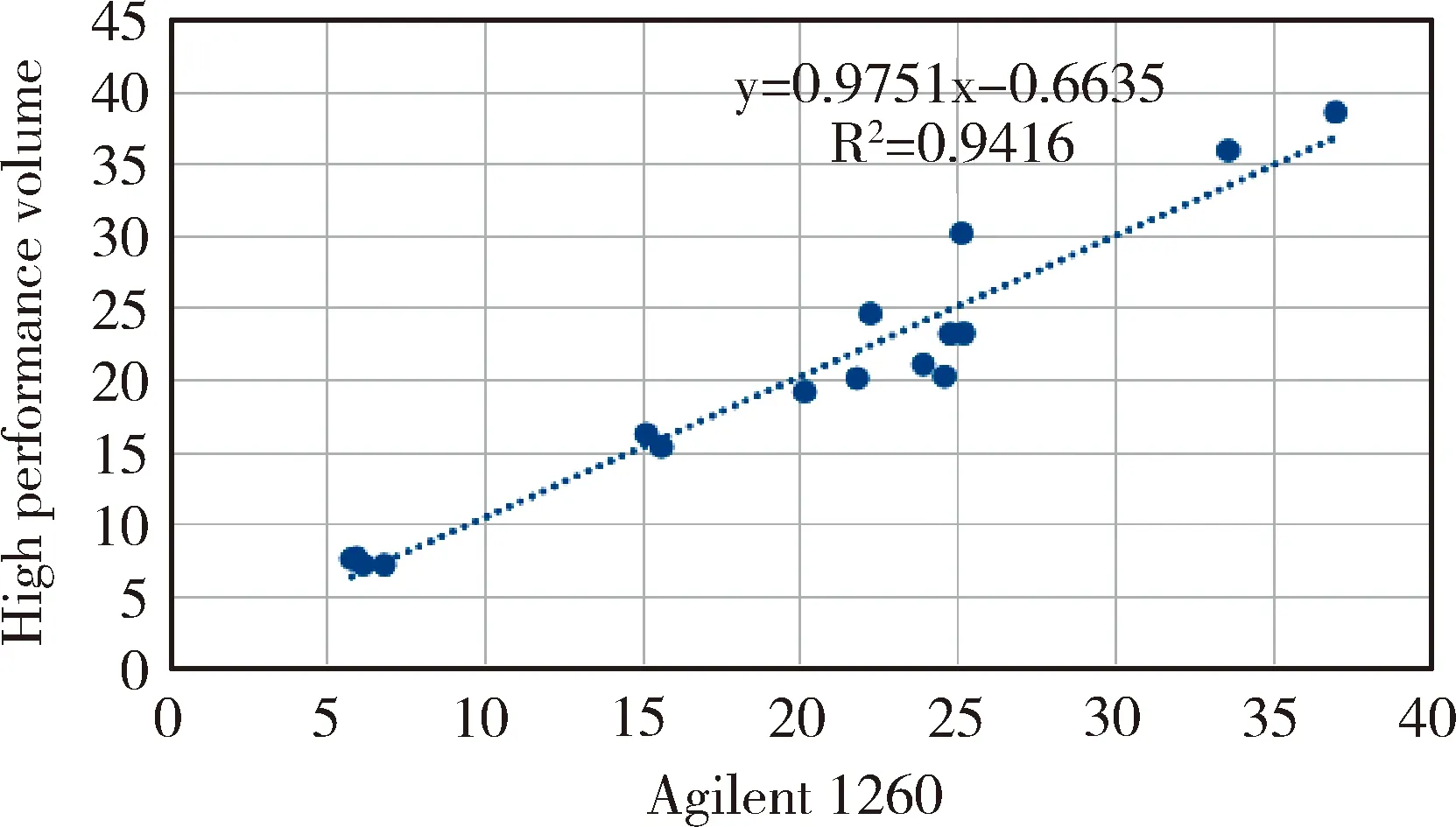
图2 安捷伦1260液相色谱仪定量法和高效液相体积排阻色谱法检测数值的相关性Fig 2 Correlation between quantitative method of Agilent 1260 liquid chromatograph and detection value of high performance volume exclusion chromatography
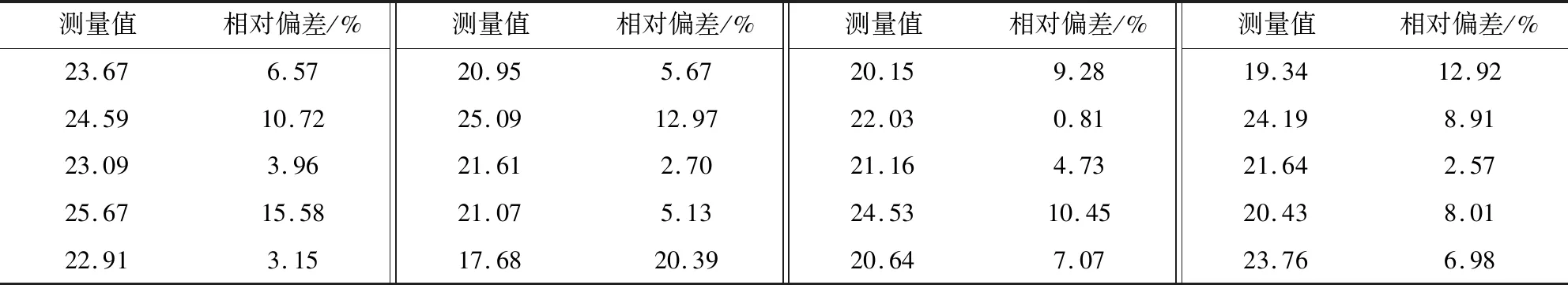
表3 紫外分光光度计定量法检测口蹄疫抗原1号株样品20次的146S含量及相对偏差Tab 3 146S content and relative deviation of FMD antigen strain 1 detected 20 times by quantitative method of ultraviolet spectrophotometer
3.5 液相色谱仪定量法重复性试验结果 表4结果显示,口蹄疫抗原2号株样品检测50次,相对偏差大于10%的样品数为3个,相对偏差在5%~10%之间的样品数为7个,相对偏差在1%~5%之间的样品数为26个,相对偏差在1%以下的样品数为14个,用统计学方法计算此组检测数值的标准偏差σ值为0.4759,证明此检测方法重复性很好。

表4 液相色谱仪定量法检测口蹄疫抗原2号株样品50次的146S含量及相对偏差Tab 4 146S content and relative deviation of FMD antigen strain 2 detected 50 times by quantitative method of liquid chromatograph
3.6 高效液相体积排阻色谱法标准曲线 结果见图3和图4。高效液相体积排阻色谱法所用标准品采用系统自动积分146S在259 nm下的峰面积,以峰面积为横坐标,相应146S浓度为纵坐标,在EXCEL程序中绘制过原点的线性趋势线作为标准曲线,线性回归方程的相关系数R2=0.9923,大于0.99,符合标准曲线的标准。
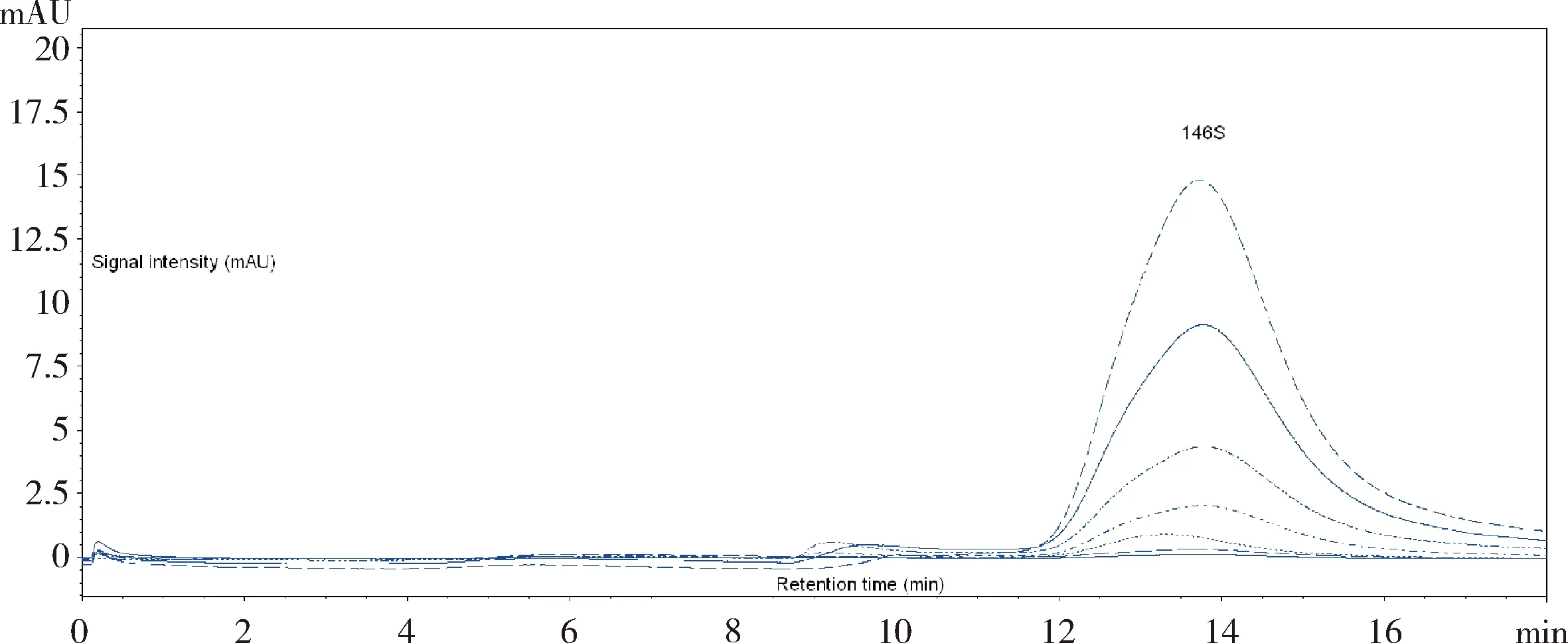
图3 口蹄疫146S 抗原标准品色谱图Fig 3 Standard chromatogram of 146S antigen of FMD
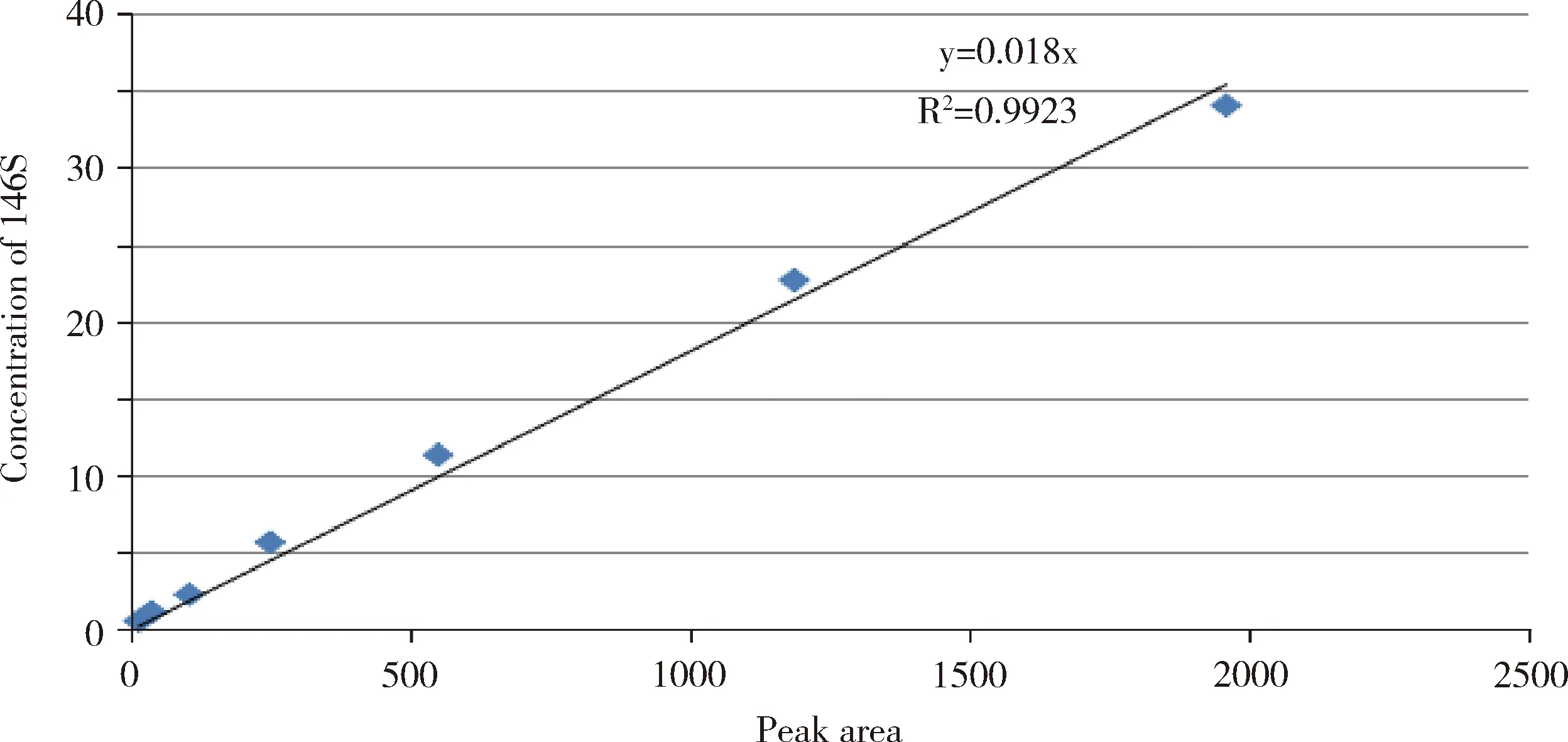
图4 口蹄疫146S 抗原标准品曲线Fig 4 146S antigen standard curve of FMD
3.7 高效液相体积排阻色谱法重复性实验结果 根据表5所示,口蹄疫抗原3号株样品检测20次,相对偏差都小于4%,用统计学方法计算此组检测数值的标准偏差σ值为0.2924,证明此检测方法重复性非常好。

表5 高效液相体积排阻色谱法检测口蹄疫抗原3号株样品20次的146S含量及相对偏差Tab 5 146S content and relative deviation of FMD antigen strain 3 detected 20 times by high performance size exclusion chromatography
3.8 口蹄疫抗原稳定性实验 表6、表7结果显示,将口蹄疫A型抗原和O型抗原各一株4 ℃放置12个月,每月采用蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法检测,结果抗原含量没有变化,将此2株抗原多次冷冻融化后检测,抗原含量的降解比较多, 所以口蹄疫抗原适合4 ℃保存。
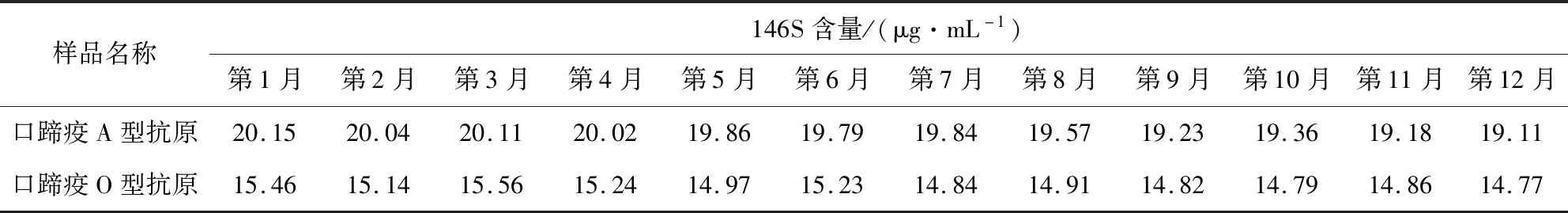
表6 液相色谱仪定量法检测两株抗原4℃放置12个月的含量变化Tab 6 Changes in the content of two antigens after 12 months at 4℃ by quantitative method of liquid chromatograph
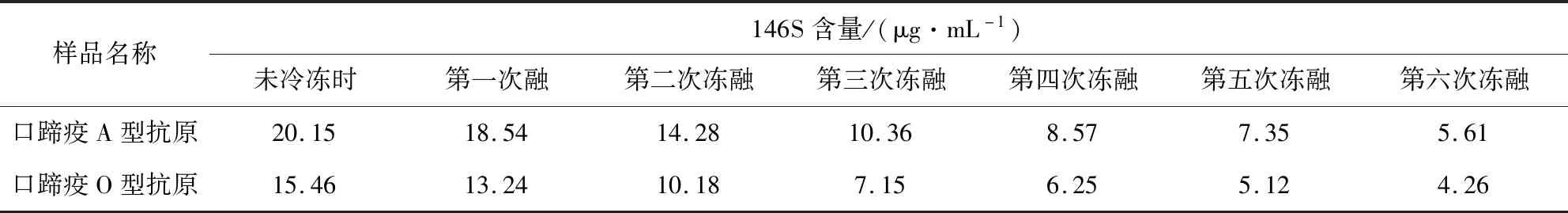
表7 液相色谱仪定量法检测两株抗原反复多次冻融后抗原含量的变化Tab 7 Changes of antigen content after repeated freeze-thaw of two antigens by quantitative method of liquid chromatograph
3.9 Benzonase核酸酶处理前后抗原检测图 图5结果显示,未加Benzonase核酸酶处理的抗原检测图(图5A)色谱峰出现之前,还出现了杂蛋白的紫外吸收峰,而加Benzonase核酸酶处理后的抗原检测图(图5B)除色谱峰之外,再没有出现杂蛋白的紫外吸收峰,所以Benzonase核酸酶能够有效去除杂蛋白干扰,增加蛋白产量,提高色谱纯化的效率。
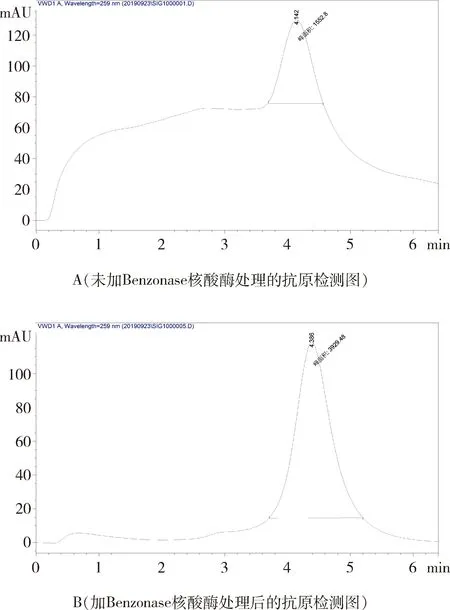
图5 液相色谱仪定量法检测1号抗原色谱图Fig 5 Quantitative detection of No.1 antigen by quantitative method of liquid chromatograph
4 讨论与结论
将口蹄疫A型抗原和O型抗原各一株4 ℃放置12个月,每月采用蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法检测,结果抗原含量没有变化,将此2株抗原多次冷冻融化后检测,发现抗原含量的降解比较多。因此口蹄疫抗原或疫苗适合4 ℃保存,不能冷冻,冷冻后抗原含量的降解比较多,会大大降低口蹄疫疫苗的免疫效力。Benzonase核酸酶,是一种核酸内切酶,可将核酸降解成为2~5个碱基的5’单磷酸核苷酸,能够有效降低蛋白样品的粘度,提高色谱纯化的效率,去除蛋白样品中核酸污染,并且没有蛋白酶活性残留,它能够完全去除检测过程中干扰物质对146S特征峰的影响,获得最佳的检测信号并实现146S抗原含量的准确测定。
使用蔗糖密度梯度离心法对口蹄疫146S抗原含量进行定量是一种标准方法,该方法操作较复杂,对仪器设备要求较高[11]。分别用蔗糖密度梯度离心结合安捷伦Cary100紫外分光光度计定量法、蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法及高效液相体积排阻色谱法三种检测方法,对口蹄疫灭活抗原中的146S含量进行检测,对三种检测方法的数据作单因素方差分析,结果F小于Fcrit,P-value高于0.05,表明三种检测方法的数据无差异,安捷伦Cary100紫外分光光度计定量法和安捷伦1260液相色谱仪定量法检测数值相关系数R2=0.9456,安捷伦1260液相色谱仪定量法和高效液相体积排阻色谱法检测数值相关系数R2=0.9416,因此三种检测方法的检测数值相关性极显著,呈正相关性,蔗糖密度梯度离心结合安捷伦Cary100紫外分光光度计定量法重复性检测数值的标准偏差σ值为2.1073,此检测方法重复性一般,操作步骤繁琐。高效液相体积排阻色谱法重复性检测数值的标准偏差σ值为0.2924,重复性非常好,自动化程度高,但是操作不够简易,尤其要制作标准曲线,如果每次、每批检测有一种试剂等因素有变动,都需要制作标准曲线,影响检测结果。蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法重复性检测数值的标准偏差σ值为0.4759,此检测方法重复性很好,并且简便易行,所以基于临床需求,蔗糖密度梯度离心结合安捷伦1260液相色谱仪定量法更适合口蹄疫抗原检测,通过优化筛选,期望能为口蹄疫疫苗中146S抗原含量的检测方法进一步标准化奠定基础,在疫苗质量控制中,可以在生产阶段用抗原含量测定的方法保证疫苗中有效抗原的含量,而在成品疫苗的效力检验时尝试将抗原含量检测方法与替代试验动物检测方法相结合进行综合评价,大批量的终产品检验可以通过抗原含量测定方法试验数据来进行检验,从而减少试验的数量,在终产品的组分发生改变时或者疫苗中添加免疫增强剂等情况时用动物进行效力检验,同时检测疫苗组分改变或添加免疫增强剂后所需要的有效抗原含量新标准,以探索一种有较好重复性、可靠性和易于标准化的替代方法。
