水貂犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)临床安全性和免疫效力评价
2020-07-15冯二凯易立陈立志张淼罗国良郭利王振军程世鹏任飞程悦宁
冯二凯,易立,陈立志,,张淼,罗国良,郭利, 王振军,程世鹏,任飞,程悦宁*
(1.中国农业科学院特产研究所,长春 130112;2. 吉林特研生物技术有限责任公司, 长春 130122)
水貂犬瘟热是由副黏病毒科、麻疹病毒属的犬瘟热病毒(Canine distemper virus, CDV)感染水貂引起的一种急性、高度接触性、高死亡率的传染病[1-2],Rudolf在1928年首次报道了该病,我国首例水貂犬瘟热发生于1968年[3],以后逐渐蔓延至全国,给我国乃至全世界的水貂养殖者或农场主造成了严重经济损失。
水貂犬瘟热没有有效治疗药物,疫苗免疫是预防和控制该病的最有效手段。中国农业科学院特产研究所先后研制了水貂犬瘟热鸡胚成纤维细胞活疫苗和水貂犬瘟热Vero细胞活疫苗,为预防和控制我国毛皮动物犬瘟热的爆发和流行,减少广大毛皮动物养殖户经济损失等方面奠定了坚实基础[4-5]。
然而,目前常见的水貂犬瘟热疫苗都是基于传统转瓶工艺生产,需要添加高浓度血清,具有生产成本高、产量有限、生产周期长等缺点,无法满足不断扩大的毛皮动物病毒类疫苗的市场需求;其次,在病毒类疫苗市场竞争越来越激烈的背景下,越来越多的企业开始注重自身疫苗悬浮培养平台的建立,提升疫苗质量、降低疫苗生产成本,提升本企业疫苗的市场竞争力[6-8]。此外,根据《新兽药研制管理办法》2005版中关于新兽药研制的要求,疫苗需要开展临床研究,以验证疫苗在临床应用中的安全性和有效性。
因此,本研究在前期水貂犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)冻干制剂的安全检验、性状检验、无菌检验、效力检验等均合格的基础上[9-10],分别在吉林、辽宁两省进行了犬瘟热Vero活疫苗(CDV3-CL株,悬浮培养)冻干制剂的临床安全性和免疫效力评价。
1 材料与方法
1.1 试用疫苗 3批犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)冻干制剂,批号:201701、201702、201703,由吉林特研生物技术有限责任公司试制。
1.2 试验试剂 Vero细胞(CCL-81),购自美国国家菌种保藏中心(American Type Culture Collection,ATCC);新生牛血清(批号:20160405),由内蒙古金源康生物提供;DMEM(批号:1693945), 由美国Gibco公司提供;CDV强毒株(LNM株),由中国农业科学院特产研究所分离鉴定、保存;犬瘟热病毒阳性血清,血清中和抗体(Serum neutralizing antibody,SN)≥1∶256,中国农业科学院特产研究所制备和保存。
1.3 实验场所及动物 选择饲养规模相近的3个毛皮兽养殖场(吉林省2个,辽宁省1个)作为疫苗试用场所:选择美国短毛黑水貂,2~4月龄,未接种任何疫苗,经犬瘟热病毒抗体检测,其血清中和抗体SN≤1∶4,作为疫苗接种对象;接种方式为后肢内侧肌肉注射;各试验场使用实验动物数量、性别统计结果见表1。

表1 疫苗临床试用毛皮兽场及实验动物情况一览表Tab 1 The list of fur farms and animals that used to evaluate the vaccine
1.4 疫苗安全性试验 将3批疫苗分别接种2~4月龄育成水貂,10头份/只,分4点注射;每个试验点100只水貂,接种后每天观察水貂的精神、食欲、粪便的变化,连续观察14 d,记录结果。
1.5 疫苗效力试验 将3批疫苗分别接种2~4月龄育成水貂,1 头份/只;免疫21 d后每组随机选择水貂20只,采血、分离血清、测定抗体,记录结果;免疫180 d后,从每个实验组随机选水貂20只,采血分离血清测定血清抗体;用100个ID50的CDV强毒(CDV-LNM株)对3批疫苗免疫组(5只/批)和对照组水貂(3只)进行攻毒,观察动物是否出现典型犬瘟热临床症状,统计动物死亡和存活数,持续15 d,记录结果。
1.6 疫苗抗体监测 3批疫苗分别接种2~4月龄育成水貂,1 mL/只;分别在接种7 d、14 d、21 d、60 d、120 d、180 d分别随机选水貂各10只进行采血,分离血清,测定血清中和抗体,记录结果。
2 结果与分析
2.1 犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)试制和性状检验结果 基于前期建立的犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)制备工艺,试制3批疫苗,疫苗试制数量、疫苗性状检测结果见表2。

表2 犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)中间试制及检验结果Tab 2 Pilot scale production and inspection of the mink canine distemper attenuated live Vaccine
2.2 疫苗安全性试验结果 3批疫苗在3个毛皮兽场分别超剂量皮下接种(后肢内侧肌肉)2~4月龄育成水貂,观察14 d,接种水貂食欲、精神状态正常,接种局部无肿胀和炎症,未出现局部和全身反应,说明疫苗对水貂具有较好的安全性。结果见表3。
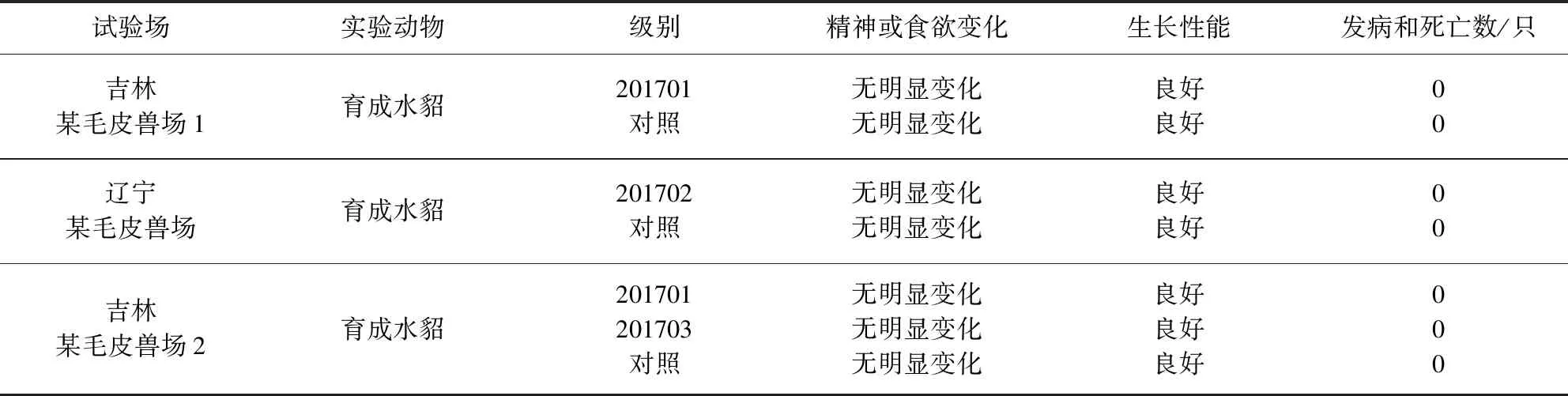
表3 犬瘟热活疫苗(CDV3-CL株,悬浮培养)安全性试验结果Tab 3 The security test recor of the mink canine distemper modified live vaccine (CDV3-CL strain, Suspension)
2.3 犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)效力试验结果 由表4及表5可知,犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)接种水貂21 d后,血清中SN抗体效价均在1∶64以上,对照组SN抗体在1∶4以下;疫苗接种水貂180 d,免疫水貂血清SN抗体均在1∶81以上;用100个ID50的CDV强毒(CDV-LNM株)攻击,免疫组水貂获得100%保护,对照组均发病。
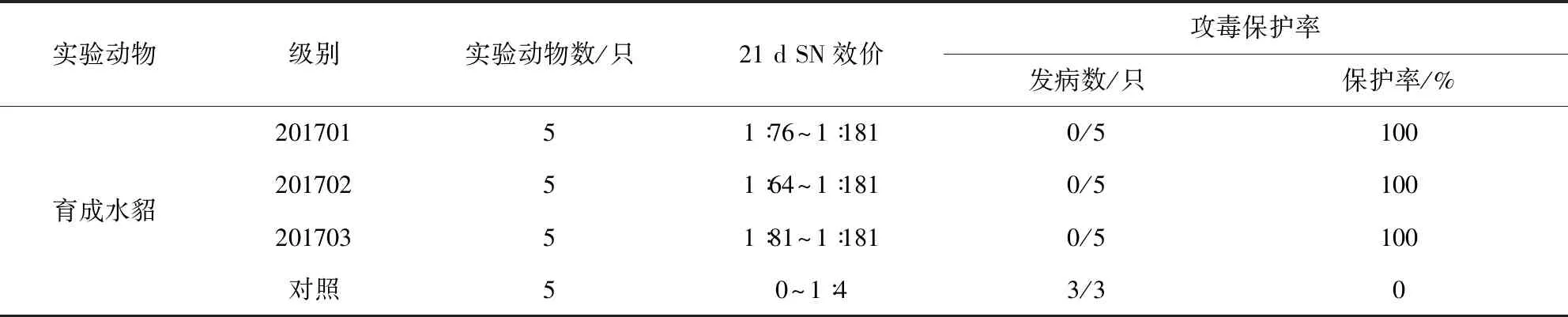
表4 犬瘟热活疫苗(CDV3-CL株,悬浮培养)免疫水貂21d效力试验结果Tab 4 The 21-d immune efficacy result of mink canine distemper modified live vaccine CDV3-CL strain, Suspension)

表5 犬瘟热活疫苗(CDV3-CL株,悬浮培养)免疫水貂180 d效力试验结果Tab 5 The 180-d immune efficacy result of mink canine distemper modified live vaccine (CDV3-CL strain, Suspension)
2.4 不同批次疫苗免疫水貂抗体监测结果 由表6可知,犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮)接种水貂,7 d抗体开始产生,部分水貂14 d即可达到免疫保护水平;21d 水貂的中和抗体均在免疫保护水平之上;疫苗免疫180 d,仍保持较高的抗体滴度。

表6 犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)免疫水貂SN抗体持续时间测定结果Tab 6 The duration period of serum neutralizing antibody of different batch of mink canine distemper acttenuated lived vaccine(CDV3-CL strain, Suspension)
3 讨论与结论
根据《新兽药研制管理办法》2005版中关于新兽药研制的要求,本研究按照水貂犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)制造与检验试行规程(草案)中试生产了3批疫苗,并选择吉林省、辽宁省3个饲养规模相近的毛皮兽场开展疫苗临床试用,评价疫苗的临床试用效果。
生物制品的安全性是养殖业健康发展的前提条件。本研究通过后肢内侧肌肉注射途径,将超剂量疫苗接种试验场水貂,接种后水貂在观察期(14 d)内无全身和局部异常反应,且无死亡和发病病例出现,说明疫苗具有较好的安全性;此外,接种水貂的食欲和精神均正常,且对动物的生产性能无影响,进一步说明疫苗的安全性,可以用于临床疾病防治。
疫苗的效力,尤其是疫苗的临床效力,是养殖业健康发展的关键。本研究通过将试制的3批水貂犬瘟热Vero细胞活疫苗接种生产中的水貂,考察疫苗的临床免疫效果。疫苗免疫后7 d即可检测抗体;14 d时,部分动物的抗体水平即可达到免疫保护水平;21 d即可获得坚强的免疫力,且犬瘟热病毒中和抗体水平均在临界保护值1∶64以上;免疫180 d血清中的犬瘟热病毒中和抗体仍然在临界值之上。动物攻毒实验也证实,免疫水貂能够抵抗100 ID50CDV强毒的攻击,获得100%保护。
本研究制备的犬瘟热Vero细胞活疫苗(CDV3-CL株,悬浮培养)在免疫接种水貂21d后,可以产生具有免疫保护水平的抗体,且可持续180 d以上,可用于水貂犬瘟热的临床预防使用。
