猪伪狂犬病病毒JSSQ2013株的分离鉴定及重要功能基因序列分析
2020-07-15孙雅鑫韩剑锋荣先锋
孙雅鑫,韩剑锋,荣先锋
(北京维牧康动保生物科技有限公司,北京101207)
伪狂犬病(Pseudorabies,PR) 是由伪狂犬病病毒(Pseudorabies virus,PRV)感染引起的多种家畜和野生动物以发热、奇痒、脑脊髓炎为主要特征的一种急性传染病。PRV属于疱疹病毒科(Herpesviridae)、α-疱疹病毒亚科、猪疱疹病毒属,病毒粒子呈圆形或椭圆形,直径在110~180 nm之间,呈二十面体对称。猪是PRV的唯一自然宿主,各种年龄猪均可感染,主要危害怀孕母猪和哺乳仔猪,主要临床特征是怀孕母猪繁殖障碍,哺乳仔猪出现神经症状及腹泻。该病在世界范围内对养猪业危害极大,被世界动物卫生组织(OIE)列为法定报告的动物疫病,我国将其列为二类动物疫病。在欧美国家,通过使用标记疫苗和相应的鉴别诊断方法很好地控制或根除了该病,我国从匈牙利引进了Bartha-K61 gE基因缺失弱毒活疫苗并在猪场中广泛应用,使PR疫情得到较好的控制,在2010年我国许多猪场已达到了净化的状态[1]。自2011年以来,我国多个地区(包括河南、河北、山东、山西等在内)已免疫PRV基因缺失疫苗的猪场呈现伪狂犬病暴发式流行,母猪产弱仔、死胎或木乃伊胎,仔猪出现神经症状、死亡,死亡率达10%~50%,给我国养猪业再次造成了巨大损失。诸多研究学者认为此次暴发可能是因为PRV某些氨基酸位点发生突变,致使变异株毒力增强,现有Bartha-K61疫苗也不能提供足够的免疫保护力[2],因此,迫切需要对变异流行毒株的毒力及分子特征进行研究,以针对性地制定有效的防控措施。
本研究通过对采自江苏省宿迁市的疑似病死猪病料进行PCR检测和病毒分离鉴定,对分离株的gB、gC、gD和gE等重要功能基因进行了序列比对与分子遗传进化分析,确定基因型,并进一步通过动物试验测定其致病性,为了解江苏PRV分子流行特征、丰富我国PRV分子流行病学资料及新型疫苗的研制奠定基础。
1 材料与方法
1.1 病料 2013年5月,江苏省宿迁市某规模化猪场疑似暴发猪伪狂犬病,剖检发病死亡猪,采集肉眼病变明显的脑、肺和淋巴结等组织样品,低温运送至实验室,-80 ℃保存。
1.2 细胞系与毒株 Vero细胞系由ATCC引进(CCL-81),本实验室保存。PRV闽A株,由中国兽医药品监察所惠赠,本实验室保存。
1.3 试验动物 新西兰白兔10只,1.0~1.4 kg,购自上海甲干生物科技有限公司。
1.4 主要试剂与仪器 病毒基因组DNA 提取试剂盒购自天根生化科技有限公司,LA Taq酶(含GC buffer)、DNA marker购自Takara公司,DMEM高糖培养基和胰酶均购自HyClone公司,胎牛血清购自GIBCO公司,PRV gp50单克隆抗体购自美国VMRD公司,FITC标记羊抗鼠IgG H&L二抗购自Abcam公司。超净台、生物安全柜和细胞培养箱是哈东联公司产品。PCR扩增仪为北京东胜创新生物科技有限公司生产。凝胶成像系统为Alpha公司生产。离心机为Eppendorf公司产品,电泳仪是北京六一仪器公司产品。
1.5 引物 引物的选择与设计见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 本研究所用引物Tab 1 Primers used in this study
*参考PRV TJ株全基因组(Genbank: KJ789182.1)
1.6 病料的处理 用无菌镊子和剪刀切取约1 g组织,加入适量DMEM进行匀浆处理,冻融3次,8000 g离心2 min,取上清液于-80 ℃保存。
1.7 病毒DNA提取及PCR扩增 病料检测及病毒鉴定:取病料组织经匀浆及离心处理后的上清液或纯化的病毒,按照病毒基因组DNA提取试剂盒说明书操作方法提取病毒DNA。采用表1中的引物PRV-gG-1/PRV-gG-2与PRV-gE-nF/PRV-gE-n分别扩增PRV gG和gE基因。PCR反应体系:LA Taq (5 U/μL) 0.25 μL,2×GC Buffer II 12.5 μL,dNTP Mixture (2.5 mM/L each) 4.0 μL,DNA 模板2 μL,上、下游引物(10 μmol/L)各0.5 μL,灭菌超纯水5.0 μL。反应条件:94 ℃预变性5 min;94 ℃变性1 min,60 ℃退火30 sec,72 ℃延伸2 min,35个循环;72 ℃延伸10 min,最后12 ℃保存。PCR结束后,取3 μL以上PCR产物进行1.5%琼脂糖凝胶电泳,观察目的片段的扩增结果,基因理论大小gG基因约为277 bp,gE基因约为474 bp。
gB、gC、gD及gE全基因扩增:按照病毒基因组DNA提取试剂盒说明书操作方法提取纯化病毒上清液的病毒DNA。使用的引物见表1,反应体系及条件同上。PCR结束后,取3 μL以上PCR产物进行1.0%琼脂糖凝胶电泳,观察目的片段的扩增结果,各基因理论大小分别约为gB基因2869 bp、gC基因1607 bp、gD基因1470 bp、gE基因1942 bp。
1.8 测序与序列分析 琼脂糖凝胶电泳后切取目的片段,使用琼脂糖凝胶回收试剂盒纯化回收DNA,送至生工生物工程(上海)股份有限公司测序,测序引物为表1中相应的引物。获得的序列首先在NCBI(https:∥www.ncbi.nlm.nih.gov/)的Blast工具进行比对,然后应用DNASTAR中的MegAlign软件将序列与Genbank中已公布的PRV参考株序列(表2)进行多序列同源性对比分析。应用MEGA 7.0软件对gB、gC、gD和gE基因序列构建进化树,方法为Neighbor-Joining法(Bootstrap值为1000)。
表2 PRV毒株参考序列
Tab 2 PRV Reference sequences from GenBank
毒株Genbank登录号分离地分离年份基因型/亚型EaKU315430中国1990经典株FaKM189913中国2012经典株SCKT809429中国1986经典株HNXKM189912中国2012变异株HNBKM189914中国2012变异株HN1201KP722022中国2012变异株HeN1KP098534中国2012变异株JS-2012KP257591中国2012变异株ZJ01KM061380中国2012变异株TJKJ789182中国2012变异株HLJ8KT824771中国2012变异株DL14/08KU360259中国2014变异株BJ/YTKC981239中国2012变异株BeckerJF797219美国NA欧美株KaplanJF797218匈牙利NA欧美株BarthaJF797217匈牙利NA欧美株KolchisKT983811希腊2010欧美株NIA3KU900059英国2016欧美株
1.9 病毒分离与纯化 将PCR检测为阳性的病料组织上清液用0.22 μm微孔滤器过滤除菌后用DMEM作10倍稀释,接种于长满Vero细胞单层的6孔板,每孔接种200 μL,共接种3孔,设正常细胞对照。在37 ℃、5% CO2培养箱中感作1 h后用PBS洗2次,加入含2%胎牛血清的DMEM细胞维持液,同等条件下继续培养,并每天观察细胞病变情况。若接毒的细胞4 d后仍未出现病变,则收毒后再盲传2代,仍未出现病变即视为阴性。若出现细胞病变则病变达80%以上后收毒,将细胞培养物于-80 ℃反复冻融2次后4000 g离心5 min,上清分装至离心管中放入-80 ℃保存备用。
1.10 病毒空斑纯化 将盲传收获的病毒进行空斑纯化,纯化方法为:将上述盲传有CPE的病毒液作10倍系列稀释至10-7,每个稀释度取400 μL接种6孔板中的单层致密Vero细胞,1 h后弃上清,用1∶1的2×DMEM 培养基与融化的2%低熔点琼脂糖混合培养液铺到6孔板中,室温凝固后置于37 ℃、5% CO2培养箱。观察CPE,当空斑长至合适大小后在显微镜下用枪头挑取空斑溶于500 μL无血清的DMEM中,冻融后用相同的方法作下一轮空斑纯化。经3轮纯化后的病毒接种于Vero细胞进行扩大培养,收取病毒液于-80 ℃保存。
1.11 病毒鉴定
1.11.1 PCR鉴定 采用2.2项的方法对纯化PRV病毒进行PCR鉴定,并将扩增产物送至生工生物工程(上海)股份有限公司进行测序。
1.11.2 IFA鉴定 取纯化PRV病毒作10倍系列稀释后接种于长满Vero单层细胞的24孔板,每个稀释度接种3个孔,每孔200 μL,同时设立PRV闽A株阳性对照和Vero阴性空白对照。在37 ℃ 5% CO2培养箱培养2 d,弃去培养液,PBS洗涤1次,每孔加入200 μL 4%甲醛固定液室温固定30 min;PBS洗涤2次,每孔加入200 μL 0.1%Triton x-100穿透15 min;PBS洗涤2次,每孔加入200 μL PRV gp50单克隆抗体(用1%BSA作1∶1000稀释),37 ℃孵育1 h;PBS洗涤3次,每孔加入200 μL的羊抗小鼠IgG H&L (FITC)标记二抗,37 ℃孵育1 h;PBS洗涤3次,置荧光显微镜下观察荧光。
1.12 TCID50测定 将纯化PRV用DMEM做10倍系列稀释,从10-1稀释到10-9,取10-2~10-9稀释度样品分别接种长满Vero细胞单层的96孔细胞培养板,每稀释度接种6孔,每孔100 μL。每个样品做3次重复。37 ℃、5% CO2培养箱培养,4 d后记录CPE情况。根据Reed-Muench法计算TCID50病毒含量。
1.13 一步生长曲线绘制 在24孔板中接种Vero细胞培养至单层致密细胞,以1.0 MOI的PRV接种Vero细胞,在不同时间点取上清液,每个时间点作3个重复,上清冻融后4000 g离心5 min,测定病毒TCID50,绘制纯化病毒的一步生长曲线。
1.14 动物毒力试验
1.14.1 对新西兰白兔的毒力试验 将10只新西兰白兔随机分为2组(攻毒组和对照组),每组5只,攻毒组每只接种103TCID50的纯化PRV,对照组接种DMEM,接种方式均为皮下注射,接种剂量均为1 mL/只,隔离饲养,观察发病情况。
1.14.2 对仔猪的毒力试验 将10头15日龄健康仔猪(PRV抗原、抗体阴性)随机分成2组(攻毒组和对照组),每组5头,攻毒组通过滴鼻途径攻毒106.0TCID50/mL的PRV JSSQ2013 2 mL,对照组滴鼻2 mL DMEM。同等饲养条件下隔离饲养,每天定时测量仔猪体温、观察临床表现和死亡情况。
2 结果与分析
2.1 病料PCR检测 采集疑似PRV感染发病死亡猪的脑、肺、淋巴结组织样品,无菌处理样品,提取病毒DNA,用PRV-gG-1/PRV-gG-2和PRV-gE-nF/PRV-gE-nR分别针对gG和gE基因进行PCR扩增。结果显示,所有样品能扩增到单一、明亮的条带,扩增产物与预期大小均相符,分别为277 bp和474 bp(图1)。回收目的条带进行测序,序列blast比对分析证实所有扩增序列均为PRV序列。

M:DL2000 marker;1,6:脑;2,7:肺; 3,8:淋巴结; 4,9:阳性对照;5,10:阴性对照。图1 病料PCR检测结果Fig.1
2.2 病毒分离与纯化 将经过除菌处理的脑组织悬液样品,10倍稀释后接种Vero细胞,接种24 h后,可观察到细胞呈现圆缩并发亮、聚集、拉网等典型的细胞病变而对照组细胞没有病变(图2)。接种48 h后收毒,4000 g离心5 min,取上清作10倍系列稀释进行空斑纯化,经3轮空斑纯化后获得纯化的病毒株。

A:接种脑组织悬液的细胞;B:正常细胞对照图2 病毒分离细胞病变观察Fig.2
2.3 PRV分离株鉴定
2.3.1 PCR鉴定 使用病毒DNA提取试剂盒提取上述纯化的分离株的病毒DNA,同样使用PRV-gG-1/PRV-gG-2和PRV-gE-nF/PRV-gE-nR引物分别针对gG和gE基因进行PCR 扩增。结果显示,分离株能扩增到单一、明亮的条带,扩增产物与预期大小均相符(图3)。PCR产物测序的序列blast比对分析结果也显示为PRV序列。
2.3.2 IFA鉴定结果 为了进一步鉴定PRV分离株,采用PRV gp50单克隆抗体进行IFA鉴定,结果显示该分离株和阳性对照均可观察到明显的特异的绿色荧光,而阴性对照无荧光(图4),进一步证明该分离株为PRV。如上所述,经PCR和IFA鉴定证实,分离到一株PRV,命名为PRV JSSQ2013株。
M: DL2000 marker;1,4:PRV分离株; 2,5:阳性对照;5,10: 阴性对照。图3 PRV分离株PCR鉴定结果Fig.3

A:分离株;B:阳性对照;C: 阴性对照。图4 PRV分离株IFA鉴定结果Fig.4
2.4 TCID50测定及生长曲线 对纯化的PRV JSSQ2013株收获的培养上清进行滴度测定,结果显示病毒滴度平均为107.8TCID50/mL。以1.0 MOI的病毒接种24孔板培养的Vero细胞,在不同时间点取上清液测定TCID50,绘制病毒一步生长曲线,结果见图5,在感染20 h后病毒滴度即达到最高,为108.6TCID50/mL,表明PRV JSSQ2013株在Vero细胞上的复制能力非常强。
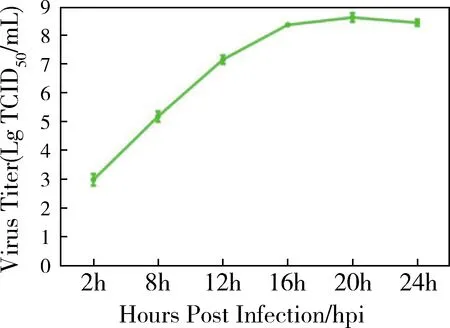
A:分离株;B:阳性对照;C: 阴性对照。图5 PRV JSSQ2013分离株一步生长曲线测定Fig.5
2.5 gB、gC、gD和gE基因序列比对及遗传进化分析 将PRV JSSQ2013株的重要功能基因gB、gC、gD和gE基因序列与18株国内外参考毒株进行序列同源性分析。结果显示(表3),PRV JSSQ2013株的gB、gC、gD和gE基因与所有参考株的核苷酸序列同源性分别为97.5%~99.6%、94.1%~99.6%、97.9%~99.6%和97.2%~99.7%,氨基酸序列同源性分别为95.5%~99.0%、91.5%~99.7%、96.2%~99.2%和95.1%~99.3%;与我国近几年分离的PRV变异株序列相比核苷酸序列同源性分别为99.5%~99.6%、99.5%~99.6%、99.5%~99.6%和98.7%~99.7%,氨基酸序列同源性分别为98.9%~99.0%、99.5%~99.7%、99.0%~99.2%和98.1%~99.3%,均高于其与经典毒株(Ea、Fa和SC株)和欧美毒株(Becker、Kaplan、Bartha、Kolchis和NIA3)的同源性。

表3 PRV JSSQ2013株与参考毒株gB、gC、gD和gE全基因核苷酸及推导氨基酸序列同源性比对Tab 3 Homology comparison of nucleotide and deduced amino acid sequences of gB, gC, gD and gE genes between PRV JSSQ2013 and reference strains
将PRV JSSQ2013株gB、gC、gD和gE 全基因序列与18株PRV参考毒株进行遗传进化树分析(图6)。结果均显示,18株PRV均可依据gB、gC、gD和gE基因序列划分为中国型(Genotype II)和欧美型 (Genotype I),中国型进一步可划分为变异株亚型 (Variant subtype) 和经典株亚型 (Classical subtype)。本次分离得到的PRV JSSQ2013株与我国近几年新分离的PRV变异毒株遗传进化距离最近,属同一分支,因此该分离株属于PRV变异株。
2.6 动物试验结果
2.6.1 新西兰白兔致病性试验 为了初步评价PRV JSSQ2013株的致病性,选择易感动物新西兰白兔进行试验。攻毒组的5只兔子在接种病毒24 h后开始出现厌食、兴奋、啃咬或用爪挠接种部位等典型症状,进而表现为呼吸急促、四肢麻痹、尖叫、鼻腔出血,最后抽搐而死,呈现“角弓反张”姿势,至48 h 5只兔子全部死亡。对照组5只兔子精神状态与食欲均正常,无异常表现。结果表明,PRV JSSQ2013株在新西兰白兔上毒力很强。
2.6.2 仔猪攻毒试验 为了进一步评价PRV JSSQ2013株的毒力,选择本体动物15日龄仔猪进行攻毒。攻毒组的5头仔猪攻毒后第1天,体温出现明显升高,第三天达到最高(图7);第1天开始出现典型的PR症状,包括精神沉郁、厌食、咳嗽、腹泻。第3天出现呼吸困难、呈犬坐姿势,随后表现狂躁、不断做划水动作,频繁用头顶撞柱栏现象,后期全身颤抖及倒地出现划水运动。第5天全部死亡(病死率100%)。空白对照组体温、临床症状无任何异常。结果表明,PRV JSSQ2013株在本体动物15日龄仔猪上毒力也很强,因此,该分离株为强毒株。

A:gB基因;B:gC基因;C:gD基因;D:gE基因图6 PRV gB、gC、gD及gE基因核苷酸序列遗传进化树构建Fig.6

图7 PRV JSSQ2013接种仔猪后体温变化情况Fig.7
3 讨论与结论
猪伪狂犬病在世界范围内广泛分布和流行,给世界养猪业造成了重大的经济损失。自2011年以来,我国多个地区包括江苏、浙江、吉林、黑龙江、福建等省份在已免疫PRV基因缺失疫苗的猪场暴发了PR病例,研究者分离到了PRV 强毒株并进行了基因变异分析,证实大多数毒株在重要功能基因存在变异突变[4-7]。研究者对变异PRV毒株进行了猪体免疫保护攻毒试验,结果发现常规疫苗免疫不能对变异PRV强毒株提供完全保护,推测可能由于变异PRV毒株的突变导致了病毒抗原发生变异或/和对宿主的致病力增强[8-9]。
由于新流行的PRV变异毒株毒力增强,且常规疫苗不能提供完全保护,导致PRV感染情况变得严峻。林文耀等在2018年对我国24个省市358个规模化猪场不同猪群的血清流行病学进行了全面调查与系统分析,结果显示PRV野毒抗体阳性猪场比例为72.63%,总血清样品平均阳性率为30.85%;其中江苏省野毒抗体阳性猪场比例为83.33%,总血清样品平均阳性率为18.60%[10]。佘志成等于2017年5月至2019年1月对江苏地区59个规模场的流行病学调查结果显示,gE抗体阳性率为36%[11];袁朗等于2016年对江苏省部分猪场进行PRV病原学监测与变异性分析,结果显示11株分离株中10株为变异毒株[12]。因此得知,相比全国平均水平,江苏地区猪伪狂犬病感染压力较大,因此,本研究可进一步了解江苏PRV分子流行特征、丰富我国PRV分子流行病学资料。
PRV gB、gC与gD 基因编码的糖蛋白是PRV最主要的保护性抗原,能刺激动物产生中和抗体和病毒特异性的细胞免疫应答反应,gE 基因是PRV的主要毒力基因。对PRV 流行毒株gB、gC、gD及gE 基因进行序列分析及遗传进化分析能在一定程度上反映病毒变异情况。通过gB、gC、gD及gE基因的遗传进化树分析显示,分离株PRV JSSQ2013与2011年以前的经典株关系较远,不在同一分支上,而与几年在猪群中广泛流行的PRV 变异株亲缘关系较近,在同一分支上,且与PRV 变异株的分子变异特征一致,即gC 基因在第63~69位存在1 个AAASTPA连续7个氨基酸插入,在gE基因氨基酸序列第48和496位附近各有一个天冬氨酸的插入,在部分氨基酸位点出现突变[5,13]。以上结果表明分离株PRV JSSQ2013具有典型的PRV变异毒株特点。
猪是PRV的唯一自然宿主,家兔是其易感动物,常用于评价PRV的致病性和毒力。李彩虹等对四川南充变异分离株BZ 株进行了家兔致病性试验,结果表明24 h后开始出现症状,72 h后家兔全部死亡[14]。马晶晶等对河北变异分离株HB-11株研究表明,接种家兔36 h后开始出现典型PR症状,48 h后家兔四肢出现麻痹而死亡;以106TCID50/mL的剂量接种仔猪后在第9、11天分别死亡一头猪[13]。李振伟等对河南变异分离株HN2012研究表明,接种家兔48 h后产生PR症状,随后死亡,60 h内全部死亡[15]。曾显成等对福建变异分离株MQ18研究表明,接种家兔后48 h开始发病,约60 h全部死亡[16]。王凤求等对广东变异分离株GD-1406在15日龄仔猪上的毒力进行了研究,结果显示攻毒106TCID50/mL的仔猪在第五天全部死亡[17]。本研究结果显示,PRV JSSQ2013接种兔子24 h后出现PR症状,48 h内全部死亡,接种仔猪第五天后全部死亡,与前期报道一致,证实PRV JSSQ2013株致病力强,为变异强毒株,可为研发PRV变异毒株有效的疫苗提供材料。
本研究成功分离到1株PRV变异株JSSQ2013,该毒株具有较强的细胞感染能力,可在Vero细胞上有效增殖,且在新西兰兔和仔猪上可引起典型的PRV感染症状且死亡,为PRV变异强毒株。本研究为PRV的分子流行特征及新型疫苗开发奠定了基础。
