地稔多糖微波提取与回流提取工艺比较
2020-07-15曾荣香蓝义琨雷凯君
曾荣香,陈 丽,蓝义琨,雷凯君
(广东省佛山市中医院药剂科,广东 佛山 528000)
地稔Melastoma dodecandrum Lour. 为野牡丹科植物地稔的全草[1],喜酸性土壤,广泛分布于江浙、两广、福建、贵州、湖南等地区,其味甘、微涩,性凉,具有清热解毒消肿、活血祛瘀止血的功效,常用于治疗高热、疗疮痈肿、咽喉肿痛、痔疮、毒蛇咬伤等症[2]。地稔的多糖类成分药理作用广泛,如抗氧化、清除自由基、抗溃疡、抗炎症、抗肿瘤、抗衰老、降糖调脂等[3-4]。目前,对地稔活性成分的研究多集中于没食子酸[5-6],但对地稔多糖的研究报道不多。多糖的提取一般采用回流提取法,目前也有关于微波提取多糖的报道[7-9]。本研究中采用单因素考察比较微波提取和回流提取的多糖提取率,通过正交试验优选地稔多糖的最佳提取工艺。现报道如下。
1 仪器与试药
仪器:UV2550 型紫外可见分光光度计(日本岛津公司);BT25S 型电子天平(北京赛多利斯仪器系统有限公司,精度为十万分之一);HWC-3LA 型微波提取设备(广州兴兴微波能设备有限公司);KDM 型控温电热套(山东华鲁电热仪器有限公司);R-200 型旋转蒸发仪(厦门精艺兴业科技有限公司);Sorvall Legend X1 型高速大容量离心机(德国Thermo 公司);SZ -93 型自动双重纯水蒸馏器(上海亚荣生化仪器厂)。
试药:地稔饮片(广州致信中药饮片有限公司,批号为130801);D-无水葡萄糖(中国药品生物制品检定所,批号为110833 -201204);苯酚、浓硫酸、95%乙醇均为分析纯。
2 方法与结果
2.1 多糖含量测定
2.1.1 溶液制备
无水葡萄糖105 ℃干燥至恒重,取60.00 mg,精密称定,置100 mL 容量瓶,加蒸馏水溶解并稀释至刻度,摇匀,备用,即得对照品溶液。取样品20 g,浸泡30 min,微波或回流提取,过滤,浓缩至20 mL,加4 倍量的95%乙醇,放置冰箱中醇沉过夜,离心,取沉淀稀释至1 000 mL,再取10 mL 稀释至100 mL,即得供试品溶液。
2.1.2 标准曲线绘制
分别精密量取葡萄糖对照品溶液1,2,3,4,5 mL,置50 mL 容量瓶中,加蒸馏水稀释至刻度,摇匀,再分别精密量取2 mL 置25 mL 具塞试管中,加5%苯酚溶液1 mL,摇匀,迅速加浓硫酸7.5 mL,摇匀,室温放置15 min,置冷水中冷却30 min 取出,以相应试剂为空白,按分光光度法于490 nm 波长处测定吸光度[10]。以葡萄糖质量浓度(C)为横坐标、吸光度(A)为纵坐标绘制标准曲线,得回归方程A =0.047 3 C +0.057 4, R2=0.998 2(n =5)。结果表明,葡萄糖溶液质量浓度在12 ~60 μg/mL 范围内与吸光度线性关系良好。
2.1.3 样品含量测定
精密吸取供试品溶液2 mL,置25 mL 具塞试管中,按标准曲线项下操作,代入回归方程,计算含量。
2.2 单因素考察
2.2.1 微波提取
提取时间:取样品20 g,按料液比1 ∶30 加水600 mL,每个条件取3 个平行,置微波提取设备中,在700 W 功率 下 分 别 提 取5,10,15,20,25 min, RSD 分 别 为1.46%,1.14%,0.67%,0.99%,2.52%(n =3)。由图1可见,5 ~20 min 多糖提取率处于平稳状态,20 min 后呈下降趋势,可能是较长时间的微波辐射使多糖的稳定性下降,从而影响其含量,故微波提取时间不宜过长。
料液比:取样品20 g,置微波提取设备中,在700 W功率下提取15 min,每个条件取3 个平行,分别按1 ∶10,1 ∶20,1 ∶30,1 ∶40 的比例加水提取,结果的RSD 分别为1.03% ,0.69% ,0.88% ,1.21% (n =3)。由图2 可见,料液比对地稔多糖提取率的影响并不大。由于地稔饮片吸水性较强,为使药材完全浸泡,故料液比1 ∶20相对较佳。
微波功率:取样品20 g,按料液比1 ∶20 加水400 mL,每个条件取3 个平行,置微波提取设备中提取15 min,分别于400,500,600,700,800 W 提取功率下提取,结果的 RSD 分 别 为1.80% ,1.20% ,0.81% ,1.20% ,0.92% ( n =3)。由图3 可见,多糖的提取率随着微波功率的增大而升高,但700 W 后无显著变化。
提取次数:取样品20 g,按料液比1 ∶20 加水400 mL,每个条件取3 个平行,置微波提取设备中,在700 W 功率下提取15 min,分别提取1,2,3 次,结果的RSD 分别为0.91%,0.52%,0.42% ( n =3)。由图4 可见,地稔多糖提取率随提取次数的增多而升高。
2.2.2 回流提取
提取时间:取样品20 g,按料液比1 ∶20 加水400 mL,每个条件取3 个平行,分别提取1,2,3,4,5 h ,结果的RSD 分别为0.86% ,1.88% ,1.60% ,2.87% ,1.12%( n =3)。由图5 可见,1 ~2 h 多糖提取率显著增加,而2 h后随着时间的延长并无显著变化,故提取2 h 最佳。
料液比:取样品20 g,提取1 h,每个条件取3 个平行,分别按1 ∶10,1 ∶20,1 ∶30,1 ∶40 的比例加水提取,结果的 RSD 分别为0.93% ,0.59% ,0.64% ,0.37%( n =3)。由图2 可见,料液比对地稔多糖提取率的影响不大,故1 ∶20 相对较佳。
提取次数:取样品20 g,按料液比1 ∶20 加水400 mL,提取2 h,每个条件取3 个平行,分别提取1,2,3 次(结果的RSD 分别为0.30%,2.99%,2.26% ( n =3)。由图4 可见,地稔多糖提取率随提取次数的增多而升高。
2.2.3 微波辅助回流提取
取样品20 g,按料液比1 ∶20 加水400 mL,先在700 W 功率下微波提取10 min,再回流提取2 h,平行3 次,结果的RSD 为1.03%( n =3)。
2.2.4 多糖提取率比较
由图1 至图5 可见,回流提取的多糖提取率增长趋势比微波提取更显著。由图6 可见,微波辅助回流提取的多糖提取率并未高于回流提取。
2.3 正交试验设计

图1 微波提取时间对地稔多糖提取率的影响

图2 料液比对地稔多糖提取率的影响
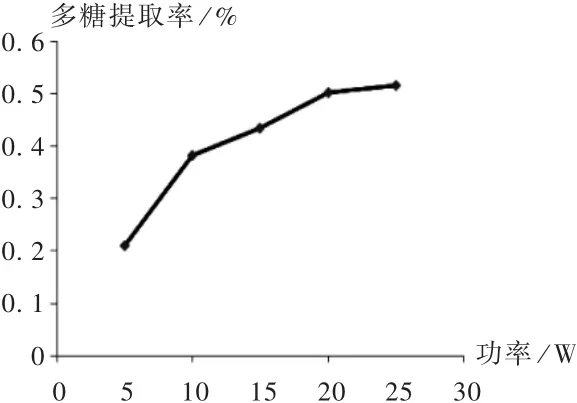
图3 微波功率对地稔多糖提取率的影响
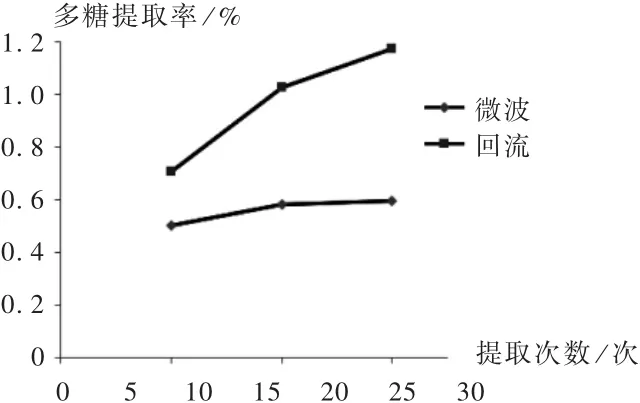
图4 提取次数对地稔多糖提取的影响

图6 微波辅助回流提取与回流提取的比较

图5 回流提取时间对地稔多糖提取率的影响
由单因素考察试验结果可见,回流提取比微波提取更适合地稔多糖的提取,故对回流提取进行正交设计优化。选择提取时间(因素A)、料液比(因素B)、提取次数(因素C)3 个因素为考察对象,每个因素拟3 个水平,选用L9(34)正交设计优化回流提取工艺。因素水平见表1。正交试验结果见表2,方差分析结果见表3。可见,A 列K 值A3>A2>A1,B1、B2、B3相差不大,说明因素B 的三水平差不多;C 列K 值C3>C2>C1,说明C3比C1和C2好。由直观分析表明,因素C 的极值R 最大,为主要影响因素,其次为因素A,最后是因素B。故各因素对提取效果的影响程度依次为C >A >B。由方差分析结果可见,因素A、因素C 是极显著因素。综合考虑,优选出的最佳提取工艺为A2B1C3,即20 倍水量,提取3 次,每次2 h。
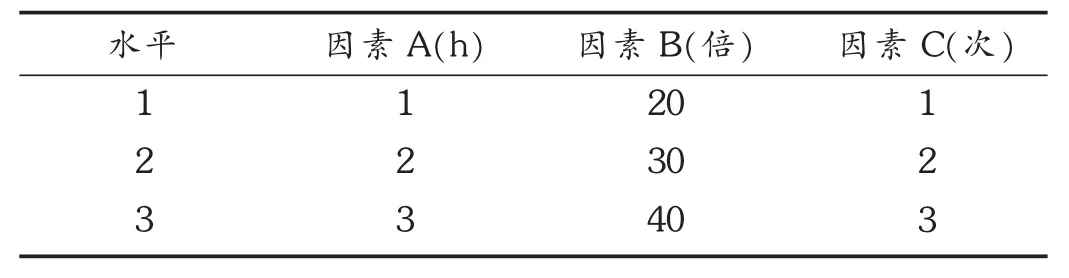
表1 L9(34)因素水平
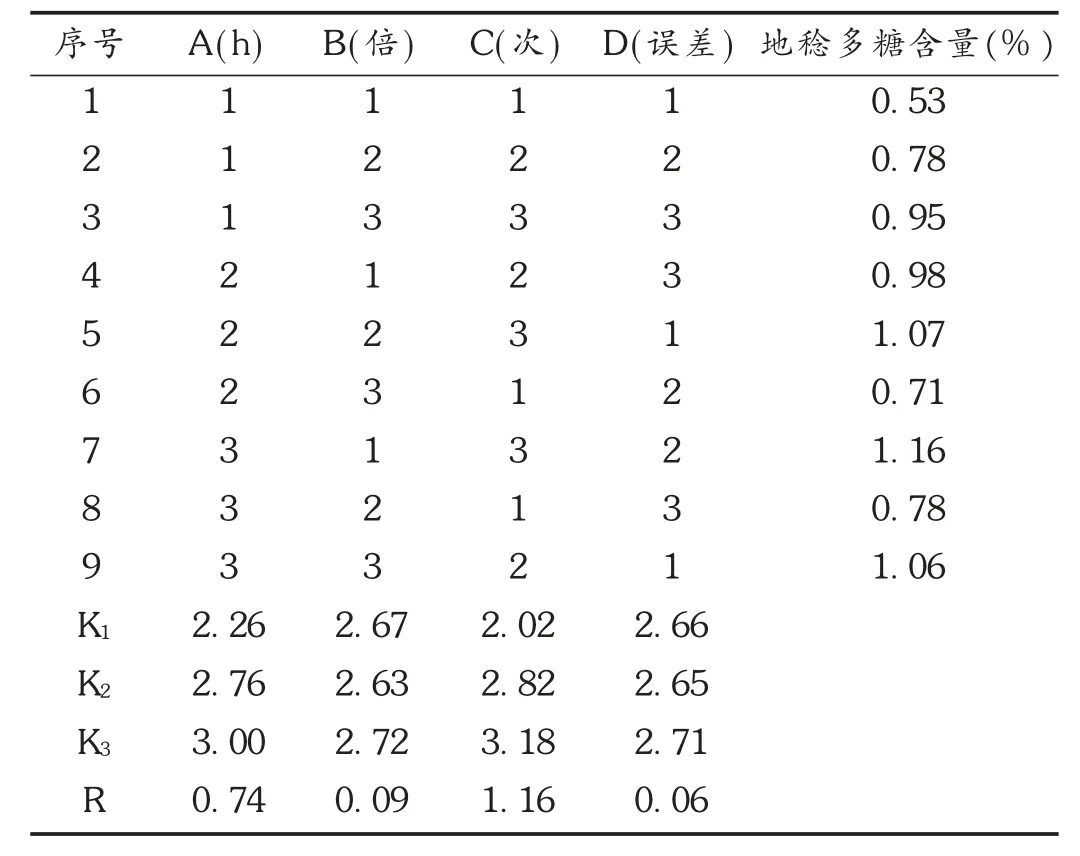
表2 正交试验方案与结果

表3 方差分析结果
2.4 验证试验
分别称取同一批样品20 g,平行3 份,用20 倍量水浸泡30 min,提取3 次,每次2 h。在此工艺下,地稔多糖的提取率为1.12%。
3 讨论
目前,多糖提取方法有超声提取法、回流提取法、微波提取法、酶提取法等,其中超声提取技术可通过超声波的空化作用及其次级效应,如机械振动、扩散、乳化、击碎、化学效应等,促进植物有效成分溶出、扩散、释放并与溶剂充分混合[11]。预试验结果显示,超声提取地稔多糖效率很低,不利于提高药材的使用率。微波提取是将微波射线辐射于溶剂,微波射线透过细胞壁到达细胞内部,极性溶剂及细胞液可吸收微波能,导致细胞内部及附近的温度升高,细胞内气化压力增大至超过细胞壁承受能力时,细胞壁破裂,细胞内成分释放转移到溶剂中[12]。回流提取法是常规提取方法,操作简单,成本较低。酶提取法提取条件温和,提取率高,但工艺条件要求及成本也较高[13],不利于大规模工业化生产。
本试验结果显示,微波提取达到平衡态的时间虽比回流提取时间短,但提取率明显低于回流提取,表明微波提取不适合地稔多糖。超声提取法和微波提取法操作简单,提取率高,但提取较剧烈,易造成多糖降解[14-15]。综合回流提取的单因素试验、正交试验和实际应用考虑,地稔多糖更适合的提取工艺为回流提取,最佳提取条件为料液比1 ∶20,提取3 次,每次提取2 h,此条件下的地稔多糖提取率约为1.1%。
