血清胆红素水平与2型糖尿病视网膜病变的相关性
2020-07-14佟晶晶施克新李凤萍
佟晶晶,施克新,冷 飞,李凤萍
(1.锦州医科大学葫芦岛市中心医院 研究生培养基地,辽宁 葫芦岛 125000;2.葫芦岛市中心医院 内分泌科,辽宁 葫芦岛 125000)
糖尿病(DM)是一种以血浆葡萄糖升高为特征的复杂慢性代谢性疾病。中国DM患病率从1980年的0.67%上升至2013年的10.4%,居世界首位[1]。本病与多种并发症的发生有关,其多重并发症给患者带来了巨大负担。糖尿病视网膜病变(diabetic retinopathy, DR)是DM最具破坏性的微血管并发症之一,在全球35个研究中心进行的基于流行病学的荟萃分析显示,DR在DM总人口中的患病率为35.4%[2],它主要影响工作年龄的成年人,是该年龄段失明的主要原因。
DR是DM终末器官损害的眼部表现,其发病机制比较复杂,主要是由于在遗传基础上,长期高血糖导致视网膜多元醇通路活性增加、蛋白激酶C途径及己糖胺途径的激活、晚期糖基化终产物(AGEs)的产生以及聚(ADP)-核糖聚合酶上调等,进而导致局部血管的氧化应激(oxidative stress, OS)。OS在DR的发病机理中起着至关重要的作用。OS可引起内皮功能障碍,这是DM微血管并发症发生和发展最重要的机制。由于部分DR临床表现不明显,容易被忽视。因此,早期检测、早期诊断和早期治疗至关重要,以便及时采取干预措施。在临床上如果能找到简单有效的风险评估指标,在有高危风险的患者中进行上述眼底筛查,对早期检测DR将有一定的帮助,并且可以有效减轻患者的痛苦和心理负担。
胆红素是血红素分解代谢的主要产物,是人体内较强的天然抗氧化剂,对微血管具有抗氧化和抗炎作用。胆红素能够清除氧自由基、抑制低密度脂蛋白及脂质的过氧化。Jayanthi等[3]发现总胆红素(TBIL)可作为预测2型糖尿病(type 2 diabetes, T2DM)合并有亚临床甲状腺疾病患者胰岛素抵抗进展的早期生化指标和临床指标,主要是由于胆红素的抗氧化特性。此外,胆红素的测定与其他标记物相比无疑是廉价的,而且是常规检查项目,临床医生很容易获得。本研究旨在探讨血清胆红素水平对DR的影响,为DR的防治及延缓其进展提供参考及新的理论依据。
1 资料与方法
1.1病例选择 2018年10月至2019年12月在葫芦岛市中心医院内分泌科住院的2型糖尿病(T2DM)患者293例(均符合1999年世界卫生组织(WHO)制定的诊断标准),男143例,女150例。平均年龄(59.62±10.98)岁,平均病程(13.37±5.02)年。为保障患者的知情同意权,此项研究数据的采用均经过患者本人及家属同意,所有数据匿名分析,并取得了医院伦理委员会审核同意。病例排除情况:特殊类型DM患者、1型糖尿病以及合并DM急性并发症患者;血清胆红素异常、肝功能异常[ALT和(或)AST>40 U/L]或存在肝胆疾病者及肾功能异常者(肌酐>97 μmol/L);明显缺氧、心肺功能不全,处于应激状态的患者(严重创伤、手术、心血管事件等);急慢性感染者;肿瘤性疾病、营养不良、贫血者;合并自身免疫性疾病及其它系统性、活动性疾病、代谢性疾病患者以及患甲亢、垂体瘤等疾病的患者;近3个月曾服用激素、免疫抑制剂者;口服除降糖以外影响血糖的药物者;合并有其他眼底病变,或因屈光间质混浊无法看清眼底者;曾行视网膜手术和激光治疗者。
1.2研究分组 参照1984年全国眼科学术会议通过的DR的分期标准[4],Ⅰ期:微血管瘤,小出血点;Ⅱ期:出现硬性渗出;Ⅲ期:出现棉絮状软性渗出;Ⅳ期:新生血管形成,玻璃体积血;Ⅴ期:纤维血管增殖、玻璃体机化;Ⅵ期:牵拉性性视网膜脱离、失明。Ⅰ~Ⅲ期为非增生型DR(NPDR),Ⅳ~Ⅵ期为增生型DR(PDR)。将所有受试对象依据眼科检查结果分为NDR、NPDR及PDR3组。依据TBIL水平四分位数分组,依据Q1、Q2、Q3和Q4分成4组。
1.3资料收集 符合入选标准的T2DM 患者293例,病案室借阅病例档案。收集患者资料,包括年龄、性别、吸烟史、饮酒史、收缩压(SBP)、舒张压(DBP)、病程,体重指数(BMI)(BMI=体重(kg)/身高(cm)2)。
1.4实验室指标检测 应用罗氏全自动生化分析仪测定FPG、2 hPG、TBIL、直接胆红素(DBIL)、间接胆红素( IBIL)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(γ-GGT)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇( LDL-C)及肌酐;应用罗氏全自动免疫分析仪测定空腹C-肽(fasting C-peptide, FCP)、餐后2小时C-肽(C-peptide 2 hours meal, 2 h-CP);应用爱科来全自动糖化血红蛋白分析仪测定糖化血红蛋白(HbA1c)。采用葡萄糖氧化酶法检测血糖;采用重氮法检测TBIL、DBIL和IBIL;采用酶法检测ALT、AST、TC、TG、HDL、LDL、γ-GGT及肌酐;采用高效液相色谱层析法检测HbA1c;采用电化学发光法检测C肽。
1.5眼底检查 所有患者入院后第2天进行系统的眼科检查,暗室内应用日本KOWA免散瞳眼底照相机进行拍摄55°以黄斑为中心的视网膜彩色图像,每只眼睛拍摄1张照片,摄片后将彩色图像传输到计算机并打印,眼底摄片不清或肉眼观病变超过Ⅲ期的患者,由眼科医师散瞳检查或行眼底血管荧光造影检查,之后由有经验的眼科医师进行DR筛查和分期。
1.6统计学方法 采用IBM SPSS 24.0进行统计分析。分类变量和连续性变量分别采用频数/百分比和均数±标准差进行统计描述,分类变量组间比较采用卡方检验,满足正态分布和方差齐性的连续性变量组间比较采用方差分析,偏态分布和方差不齐的连续性资料组间比较采用Kruskal-Wallis检验,组间比较分析采用SNK法。采用多元有序Logistic回归分析DR的危险因素。血清TBIL水平分为四分位数组间比较采用卡方检验。TBIL与其他指标的相关性采用Spearman相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1一般临床资料比较 与NDR组比较,NPDR组和PDR组中的病程、收缩压均升高(P<0.05),且PDR组中的病程、收缩压高于NPDR组(P<0.05)。3组患者的年龄、性别、吸烟史、饮酒史及BMI差异无统计学意义(P>0.05)。见表1。
2.2实验室指标比较 与NDR组比较,NPDR组和PDR组中TBIL、DBIL、2 h-CP均减低,且PDR组中TBIL、DBIL、IBIL、2 h-CP低于NPDR组(P<0.05)。与NDR组比较,PDR组中IBIL低于NDR组(P<0.05)。与NDR组比较,NPDR组和PDR组中FPG、2 hPG、HbA1c、TC均升高(P<0.05),且PDR组中FPG、2 hPG、HbA1c、γ-GGT高于NPDR组(P<0.05)。与NDR组比较,PDR组中γ-GGT高于NDR组(P<0.05)。FCP、ALT、AST、HDL、LDL、TG及肌酐3组比较差异无统计学意义(P>0.05)。见表2。
2.3DR多元有序Logistic回归分析 根据单因素分析结果将P<0.05的变量纳入有序Logistic回归模型,结果显示:TBIL和2 h-CP是DR的保护性因素;病程、SBP、FPG、2 hPG、HbA1c、γ-GGT是DR的危险因素。见表3。
2.4不同总胆红素水平DR的患病率 依据TBIL水平将所有患者分为4组:Q1组(<7.8 μmol/L)、Q2组(7.8~10.1 μmol/L)、Q3组(10.1~12.65 μmol/L)和Q4组(>12.65 μmol/L),各组DR患病率分别为68.1%、63.3%、43.1%和26.0%;4组患病率差异有统计学意义(P<0.01)。各组间进行比较,与Q1组相比,Q3组DR的患病率显著降低(P=0.003),Q4组患病率亦显著降低(P<0.01);与Q2组相比,Q4组的患病率显著降低(P<0.01);其余差异无统计学意义。4组DR患病率存在差异,DR的患病率随着TBIL水平的升高而降低。见表4,图1。
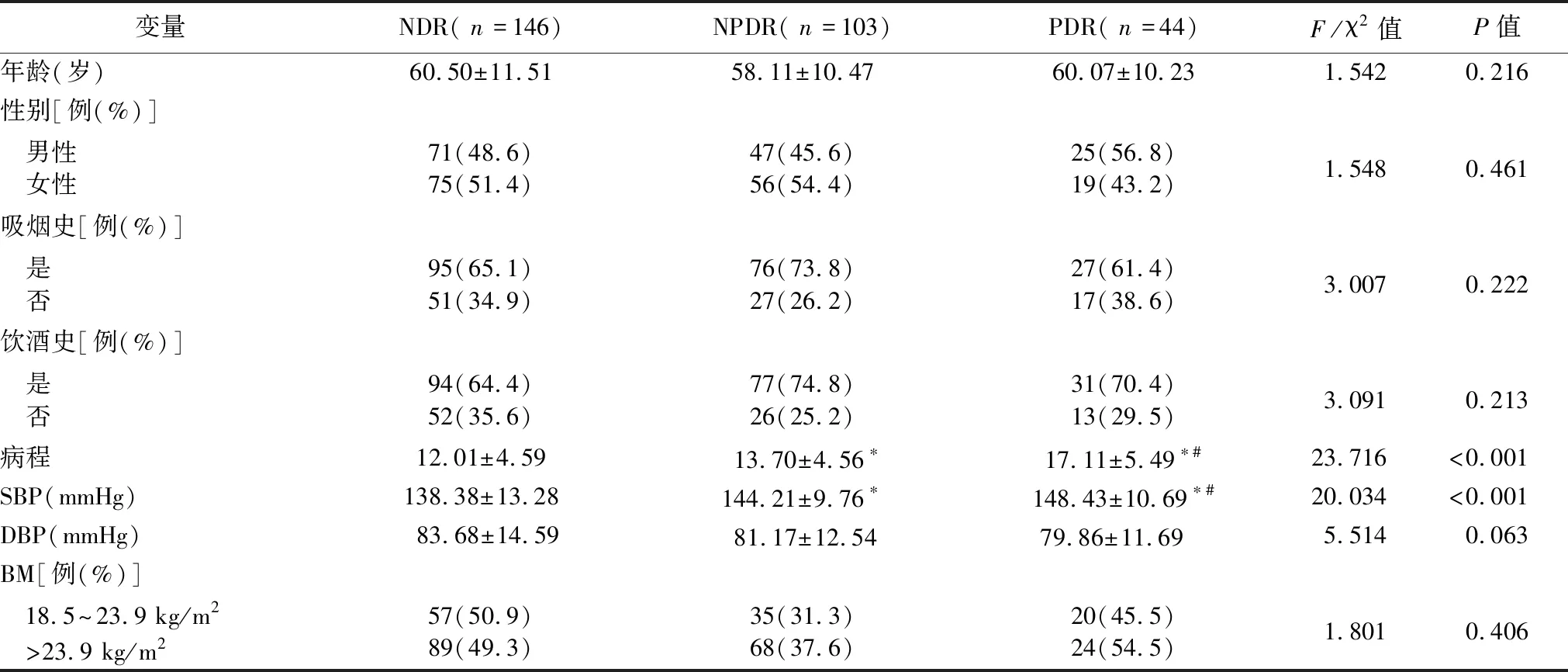
表1 3组一般临床资料比较
注:与NDR组比较,*P<0.05,与NPDR 组比较,#P<0.05

表2 3组实验室指标比较
注:与NDR组比较,*P<0.05,与NPDR比较,#P<0.05
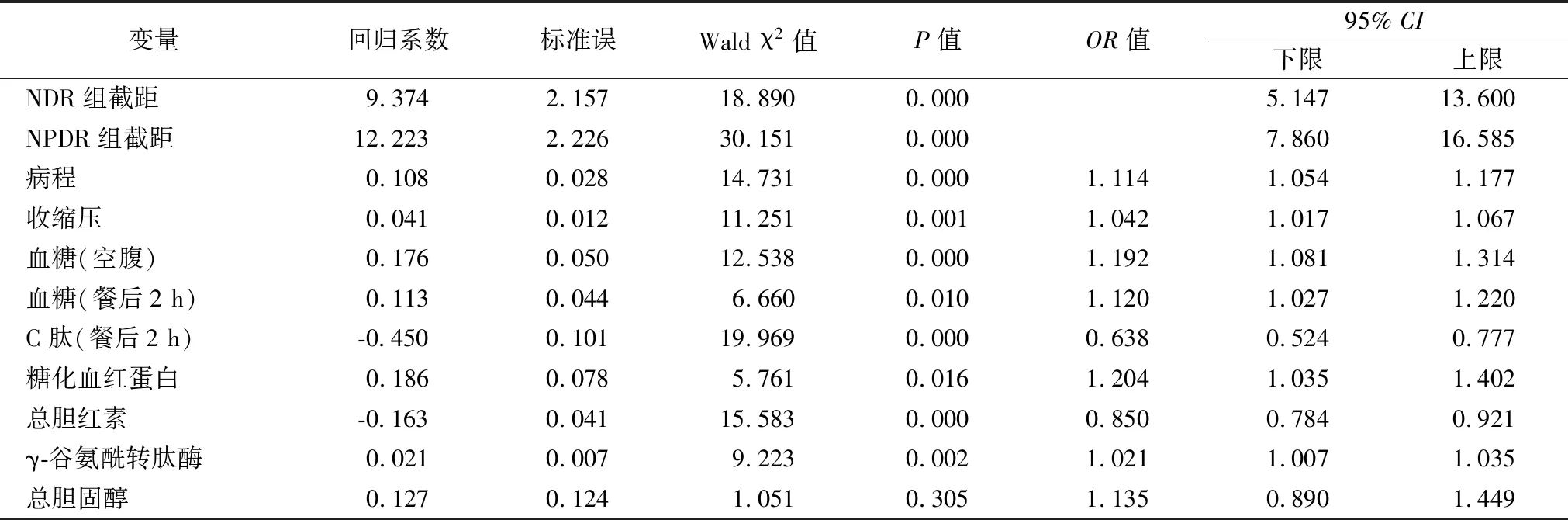
表3 DR多元有序Logistic回归分析
注:平行性检验P=0.07,满足多元有序logistic回归假设
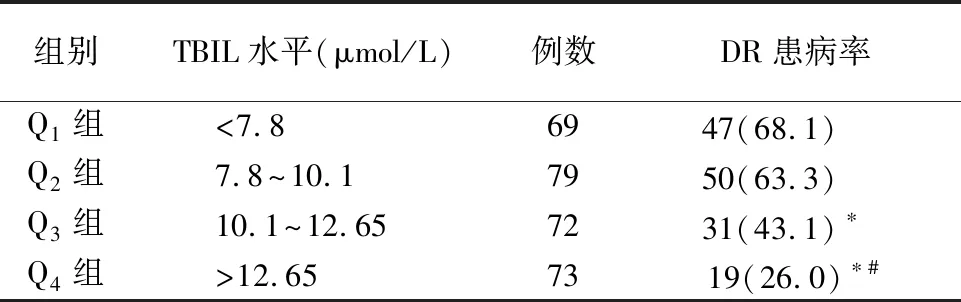
表4 不同TBIL四分位数分组DR的患病人数及患病率[例(%)]
注:χ2=32.807,P<0.01。与<7.8比较,*P<0.05;与7.8~10.1比较,#P<0.05
2.5TBIL与各项指标的相关性分析 Spearman相关性分析结果表明:TBIL分别与SBP、FPG、2 hPG、HbA1c呈负相关(P<0.05),与2 h-CP呈正相关(P<0.05)。见表5。
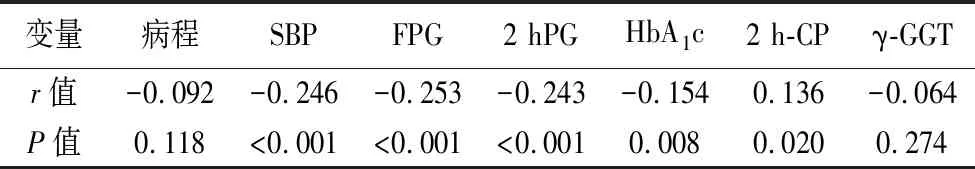
表5 TBIL与各项指标的相关性分析
图1 TBIL四分位数分组DR患病率
注:*表示两组间比较差异有统计学意义
3 讨 论
DM是一种影响血糖水平稳态的慢性代谢性疾病,在发展中国家和发达国家都是一个日益严重的健康问题[5-6]。DR是DM最常见且严重的慢性微血管并发症之一。世界卫生组织(WHO)宣布DR是第五大失明原因,也是可预防性失明的重要原因之一[7]。在适当管理下,90%以上由DR引起的视力丧失是可以避免的。因此,在临床实践中,寻找一种简便易行的指标来预测DR的发生与发展具有重要的临床价值。本实验中的胆红素指标作为OS的生理性调节因子,近年来,在DM患者中引起广泛关注。
DR的发生是许多因素共同作用的结果,如上述提到其潜在机制是长期暴露于高血糖和血糖控制不良的状态下,激活了5个关键的生化途径,导致局部血管的OS并产生活性氧。视网膜微脉管系统受到OS的影响,其附近细胞的选择性减少而产生微动脉瘤,并且由于内皮素-1合成减少,引起血管眼底膜增厚、微血管内皮细胞血管通透性增加和血管闭塞,导致NPDR的形成;随着病程进一步加重,诱导内皮细胞和周细胞凋亡以及血管内皮生长因子(VEGF)的产生,VEGF在促进血管生成和血管通透性方面起着关键作用,还可介导对血管的有害影响[8]。同时有研究显示炎症及血管纤维化也是DR发生发展的关键机制[9],因此VEGF的及其他炎症和血管纤维化等相关趋化因子过度表达促进了视网膜新生血管形成和血-视网膜屏障完整性的丧失,最终导致PDR,在严重情况下会诱发黄斑水肿,甚至失明。
胆红素是由血红素加氧酶和胆绿素还原酶对血红素的顺序催化降解而产生的[10]。近年来研究表明,生理水平范围内的胆红素水平与DM大血管和微血管并发症的发生密切相关[11-14]。主要由于生理浓度下高水平的胆红素具有潜在的抗氧化活性,特别是在疏水性细胞膜中,胆红素比谷胱甘肽更能保持细胞膜中蛋白质的稳定性[15-16]。研究显示,在瘦素受体缺乏、饮食诱导的肥胖小鼠中,胆红素可提高胰岛素的敏感性,改善肥胖症,并可抑制慢性炎症和内质网应激[17]。胆红素还通过降低瘦素、血糖和胆固醇浓度,对饮食诱发的肥胖小鼠产生有益作用。从而发挥对DM和代谢综合征的保护作用[18-19]。此外,血清胆红素水平与葡萄糖代谢状态有关,在空腹血糖受损和新发的T2DM患者中,血清胆红素的水平较高,但随着DM时间的延长而降低。先前的观察性研究表明,胆红素的升高使人类患DM的风险降低26%~31%[20-21],Abbasi等[22]对3 381例前瞻性队列参与者进行孟德尔随机研究,使用位于UDP-葡萄糖醛酸转移酶(UGT1A1)的rs6742078,发现TBIL升高与DM患病风险存在因果关系,并证明其具有保护性作用。
本研究发现,T2DM患有视网膜病变患者的TBIL、DBIL和IBIL水平显著低于无视网膜病变的患者,同时PDR患者的TBIL、DBIL和IBIL水平低于NPDR患者的血清胆红素水平,根据上述所述考虑其原因可能为DM患者长期处于高糖状态下,氧化应激反应增强,而胆红素作为抗氧化剂,不断被消耗,使人体内胆红素逐渐降低,进而导致DR的发病,以及促进DR的进一步发展。我们进一步行多元有序Logistic回归分析发现TBIL水平的升高是DR的保护性因素,TBIL每减少1 μmol/L,DR严重程度的增加是原来的0.85倍(95%CI0.784-0.921)。这与Karuppannasamy和Ghaffar等[23-24]研究结果相似。本研究又进一步以血清TBIL四分位数进行分组,4组间DR患病率差异有统计学意义,且组间比较提示随着TBIL浓度的降低,DR的患病率逐渐升高。由此推断TBIL水平的降低促进了DR的进一步发展,在低血清胆红素水平的T2DM患者中,应更加关注DR发生的风险。
关于胆红素对DR的保护机制,可能包括以下几个方面:①抗氧化:胆红素比维生素E类似物和谷胱甘肽更能防止低密度脂蛋白及脂质过氧化,与氧化应激标志物呈负相关,与超氧化物歧化酶和过氧化氢酶等抗氧化酶活性呈正相关[25]。因此,较低的血清胆红素浓度会增加OS,促进DR的发展。②抗炎作用:胆红素可通过抑制肿瘤坏死因子介导的黏附分子的上调,具有抗炎作用,且胆红素与C-反应蛋白呈负相关[24]。因此,可以推测血清TBIL水平越高,其抗炎能力越强,越能降低DR发生的风险,延缓其进展。③改善视网膜内皮功能:一项动物研究表明:通过内源性合成或外源性给药增加血清胆红素水平,可通过激活蛋白激酶B来改善DM患者视网膜的内皮功能障碍[26]。
此外本研究发现,从T2DM进展到NPDR甚至发展为PDR,2 h-CP的水平逐渐降低,进一步行Logistic回归分析提示2 h-CP水平的降低是DR的危险因素。表明C肽对T2DM患者视网膜病变的有益影响。Lim等[27]研究表明,C肽通过抑制活性氧的产生、应力纤维的形成、VE-钙黏蛋白的破坏以及血管通透性的增加,证明了其对VEGF诱导的糖尿病小鼠视网膜微血管渗漏潜在的保护性作用。在相关分析中,我们发现TBIL与2 h-CP存在着正相关的关系。考虑原因为胆红素通过其抗氧化作用在β细胞损伤中起到保护作用[28]。
本研究还发现,病程、血糖、HbA1c在NDR、NPDR及PDR 3组之间存在显著差异,Logistic回归分析提示病程、血糖、HbA1c是DR的危险因素。同时在相关性分析中,我们发现TBIL与血糖、HbA1c呈负相关。随着DM病程延长,患者往往伴随多种并发症的发生,T2DM并发的慢性眼病在早期DM患者中更为常见,早发作T2DM患者的DR患病率高于晚发者[29]。近年来,高血糖“代谢记忆”成为DM研究领域的热点问题,患者高血糖时间越长,越容易患微血管疾病,高血糖对微血管的损伤可在降低血糖后持续较长时间[30]。众所周知,HbA1c是一种可靠的慢性高血糖的标志物,有效的血糖控制与降低HbA1c的水平有关。研究报道HbA1c水平超过7%,反映了长期血糖控制不良,对视网膜微血管的损伤有重要影响[29-31]。HbA1c的形成与OS的增加显著相关,血清TBIL的升高可通过降低OS而抑制血红蛋白的糖基化,降低DR发生的风险[23]。
此外,在Logistic回归分析中我们发现SBP也是DR的危险因素,提示SBP的升高可增加DR的患病风险,有横断面研究显示,由于血压异常可增加血流剪切应力,破坏DM患者视网膜毛细血管内皮细胞,因此在DM和高血压患者中,更严格的控制血压可能有助于预防DR的发生[32]。Spearman研究结果显示TBIL与SBP存在负相关的关系,表明SBP越高,可进一步加重TBIL的缺乏状态,从而进一步增加DM患者患视网膜病变的风险。在Logistic回归分析中我们还发现γ-GGT也是DR的危险因素,最近国内外研究报道,γ-GGT直接参与活性氧的形成,被认为是OS的独立指标,γ-GGT水平的升高增加了糖尿病周围神经病变和代谢综合征的发病风险[33-34]。结合本研究结果可推断,γ-GGT通过参与氧化应激过程促进DR的发生发展。
综上所述,生理水平范围内的血清TBIL水平的升高可以有效地延缓或阻断DR的发生及NPDR进展到PDR的过程,可作为评估DR风险的潜在性生物标志物。2 h-CP水平的降低可能协同参与了DR的发生发展;临床上当DM患者出现病程、血糖、HbA1c、SBP、γ-GGT的升高,我们应该警惕DR的发生,特别要警惕PDR的发病,提高糖尿病患者生存质量,降低DM患者致残、致死率。
