纤维负载炭黑金属酞菁轴向配合物仿酶高效催化降解水体中有机污染物
2020-07-13吕汪洋陈文兴
夏 云, 吕汪洋, 陈文兴, 李 楠
(浙江理工大学纺织纤维材料与加工技术国家地方联合工程实验室, 杭州 310018)
激素类微污染物在水体中的含量很少, 但对生物体及人类的生长、发育会产生了严重的伤害[1~3]. 传统方法(如吸附法)只是将水体中微污染物从液相转移到固相, 无法从根本上去除微污染物. 高级氧化法是近几年研究和使用最多的方法, 向反应体系中加入少量氧化剂[H2O2, 过硫酸氢钾(PMS)等]产生的羟基自由基等活性物种会将微污染物彻底分解, 或将其转化为可生物降解的化合物[4]. 但该方法存在活性物种对底物选择氧化性差从而导致使用受限的问题.

本文采用稳定性较好的十六氯铁酞菁(FePcCl16)作为仿酶催化剂的活性中心, 通过重氮盐改性成本低廉且比表面积较大的炭黑, 生成吡啶环修饰的炭黑(Py-CB), 并与FePcCl16轴向配位后生成FePcCl16-Py-CB. 将FePcCl16-Py-CB热黏合到LMPET上, 形成纤维负载型仿酶催化剂FePcCl16-Py-CB@LMPET; 分析了该仿酶催化剂的结构与形貌, 并考察了其催化性能和循环使用性能.
1 实验部分
1.1 试剂与仪器
FePcCl16(自制); 炭黑(CB, 粒径 30 nm)购自美国卡博特公司; 低熔点皮芯聚酯纤维(DMPET, 细度为2D, 皮层和芯层聚酯纤维的质量百分比均为50%)购自Huvis 公司; 四氨基吡啶(4-AP, 分析纯)、亚硝酸钠(NaNO2, 分析纯)、浓盐酸(HCl, 质量分数 37%)、氢氧化钠(NaOH, 分析纯)、丙酮(分析纯)、四氢呋喃(THF, 分析纯)、N,N-二甲基甲酰胺(DMF, 分析纯)、乙醇(Ethanol, 分析纯)、异丙醇(IPA, 分析纯)、对苯醌(p-BQ, 分析纯)、二甲基亚砜(DMSO, 分析纯)和双氧水(H2O2, 质量分数30%)均购自阿拉丁试剂有限公司; 5,5-二甲基-1-吡咯啉-氮-氧化物(DMPO, 分析纯)购自东京化成工业株式会社; 去离子水为自制.
k-Alpha型X射线光电子能谱(XPS, 美国赛默飞公司); ULTRA-55型扫描电子显微镜(SEM, 德国蔡司公司); A300型电子顺磁共振波谱仪(EPR, 德国Bruker公司); RV10型真空旋转蒸发仪(德国IKA公司); Agilent 6890N型气相色谱-质谱联用仪(GC-MS, 美国安捷伦公司); UPLC/SynaptG2-S型超高效液相色谱-高分辨质谱联用仪(HDMS)和UPLC型高效液相色谱仪(HPLC)(美国Waters公司).
1.2 实验过程
1.2.1 FePcCl16-Py-CB的制备 将0.2 mol 4-AP加入到60 mL去离子水与60 mL浓硫酸混合液中, 将0.2 mol NaNO2溶于10 mL冰水后, 逐滴加入上述混合物, 并在冰浴中搅拌1 h, 即为重氮盐溶液. 将1 g CB分散于100 mL DMF中, 并置于冰浴中, 向其逐滴加入重氮盐溶液, 重氮盐溶液完全加入后搅拌3 h, 然后置于室温下搅拌15 h后过滤. 分别采用DMF、2 mol/L HCl、2 mol/L NaOH、丙酮和去离子水洗涤滤渣数次后, 冷冻干燥即得Py-CB. 将质量比为1∶1的Py-CB和FePcCl16加入到100 mL THF中, 在85 ℃下冷凝并搅拌24 h后过滤, 分别采用THF溶液和去离子水洗涤数次, 冷冻干燥后即得FePcCl16-Py-CB.
1.2.2 FePcCl16@CB的制备 将质量比1∶1的CB和FePcCl16加入到100 mL THF中, 在85 ℃下冷凝并搅拌24 h后过滤, 分别采用THF溶液和去离子水洗涤数次, 冷冻干燥后即得FePcCl16@CB.
1.2.3 FePcCl16-Py-CB@LMPET的制备 参照文献[13]方法, 将FePcCl16-Py-CB超声分散于去离子水中形成浓度为5 g/L的分散液, 以浴比1∶30将LMPET浸渍于分散液中, 待LMPET完全浸透后, 在浸压装置上二浸二压, 用去离子水洗净吸附于LMPET表面的FePcCl16-Py-CB, 放入80 ℃烘箱中预烘30 min, 然后在135 ℃烘箱中干燥30 min, 取出后即得FePcCl16-Py-CB@LMPET. 浸压装置中的浸没辊与压浆辊之间的压力为0.2 MPa, 辊的转速为20 r/min.
1.2.4 催化性能测试 在室温(25 ℃)下进行催化降解实验. FePcCl16-Py-CB/H2O2体系中FePcCl16-Py-CB的浓度为0.025 g/L, H2O2的浓度为5 mmol/L, 底物DXMS的浓度为2.5×10-5mol/L. FePcCl16-Py-CB@LMPET/H2O2体系中FePcCl16-Py-CB@LMPET的浓度为5 g/L, H2O2的浓度为20 mmol/L, 底物DXMS的浓度为2.5×10-5mol/L. 采用高效液相色谱评价催化降解DXMS的效率, 色谱柱为BEH-C18(1.7 μm, 2.1 mm×50 mm), 流动相为40%(体积分数)乙腈与60%(体积分数)水的混合溶液, 流速为0.2 mL/min.
1.2.5 催化机理测试 以IPA为羟基自由基捕获剂, p-BQ为超氧自由基捕获剂, 在室温(25 ℃)下, 分别向体系中加入IPA和p-BQ, 考察它们对体系的影响, 以此判断体系中起作用的活性物种. FePcCl16-Py-CB@LMPET的浓度为5 g/L, H2O2的浓度为20 mmol/L, 底物DXMS的浓度为2.5×10-5mol/L, IPA的浓度为500 mmol/L, p-BQ的浓度为5 mmol/L.
采用EPR分别检测水溶液中DMPO捕获羟基自由基的自旋信号和甲醇溶液中DMPO捕获超氧自由基的自旋信号. 水溶液和甲醇溶液中FePcCl16-Py-CB@LMPET的浓度为5 g/L, H2O2的浓度为20 mmol/L, DMPO的浓度为10 mmol/L. EPR的测试参数为: 中心场0.3507 T, 扫描宽度8×10-3T, 静态场0.34675 T, 微波频率9.85 GHz, 调制频率100 kHz[14].
采用GC-MS检测FePcCl16-Py-CB@LMPET在室温下活化H2O2催化氧化DMSO的产物. FePcCl16-Py-CB@LMPET的浓度为5 g/L, H2O2的浓度为20 mmol/L, DMSO的浓度为10 mmol/L. 反应120 min后, 采用旋转蒸发仪将溶液蒸干, 加入少量的无水甲醇溶解残余物, 再进行GC-MS检测. 测试条件: OV1701型毛细管柱(30 m×0.25 mm×0.25 μm), 检测器温度为250 ℃, 进样初始温度为280 ℃.
1.2.6 降解中间产物和最终产物测试 在UPLC/SynaptG2-S HDMS上通过正离子模式测试DXMS的中间产物, 采用负离子模式测试降解最终产物[14,15].
2 结果与讨论
2.1 XPS分析
采用XPS分析了FePcCl16, FePcCl16-Py-CB和FePcCl16-Py-CB@LMPET表面Fe的结合能, 并采用XPSPEAK分峰软件拟合分析了Fe2p3/2和Fe2p1/2的化学键合态, 同时测试了材料表面的元素组成, 结果如图1所示. 从图1(D)可见, FePcCl16-Py-CB@LMPET表面出现了N1s, Cl2s和Cl2p特征峰, 说明FePcCl16-Py-CB通过热黏合法已成功负载于LMPET的表面. 采用等离子体发射光谱(ICP)测试Fe的含量仅为0.14%(质量分数), 因此, 图1(D)几乎看不出FePcCl16-Py-CB@LMPET表面Fe元素的存在. 图1(A), (B)和(C)分别为FePcCl16, FePcCl16-Py-CB和FePcCl16-Py-CB@LMPET中Fe2p的XPS谱图, 图1(A)中Fe2p3/2和 Fe2p1/2的结合能分别位于711.32和726.01 eV处, 而在图 1(B)中Fe2p3/2和Fe2p1/2的结合能分别位于710.80和725.60 eV处, 分别下降了0.52和0.41 eV, 这主要是吡啶中的氮原子与FePcCl16中的Fe离子发生轴向配位, 氮原子上的孤对电子向铁离子转移, 使得铁离子的电子云密度增加, 因而结合能减小, 由此也证明了FePcCl16与Py-CB轴向配位生成了FePcCl16-Py-CB[16~20]. 图1(B)和(C)中Fe2p3/2和Fe2p1/2的结合能相同, 说明通过热黏合法将FePcCl16-Py-CB负载于LMPET上并未改变Fe的化学键态.
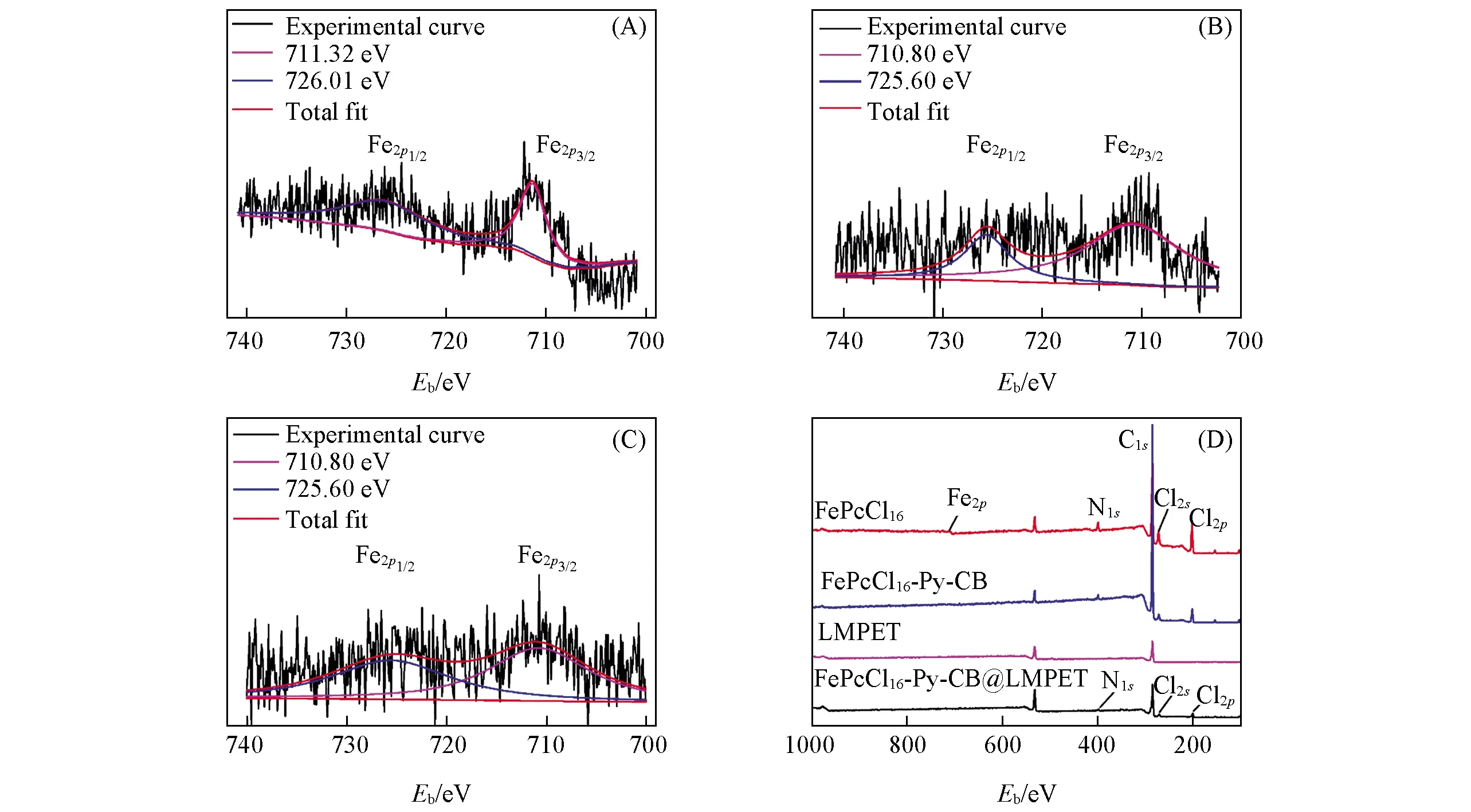
Fig.1 XPS spectra of Fe2p of FePcCl16(A), FePcCl16-Py-CB(B), FePcCl16-Py-CB@LMPET(C) and XPS survey spectra for FePcCl16, FePcCl16-Py-CB, LMPET and FePcCl16-Py-CB@LMPET(D)
2.2 SEM表征
图2为未经处理的LMPET和FePcCl16-Py-CB@LMPET的SEM照片. 从图2(A)和(C)可见, LMPET的纵向表面光滑, 只有零星的杂质附在纤维表面. 由图2(B)可见, LMPET的横截面有明显的皮芯结构, 因此LMPET是由皮层和芯层组成. 而由图2(D)和(E)可见, FePcCl16-Py-CB@LMPET表面粗糙不平, 聚酯纤维表面有大量颗粒状物质存在, 这是FePcCl16-Py-CB负载于纤维表面所呈现出来的形态.

Fig.2 SEM images of origin LMPET(A—C) and FePcCl16-Py-CB@LMPET(D, E)
2.3 催化性能
不同反应体系中DXMS的催化降解效率不同, 其结果如图3所示. 图3(A)给出了不加H2O2时FePcCl16-Py-CB对底物DXMS的吸附作用, FePcCl16-Py-CB对DXMS的吸附在0 min时基本达到平衡. 在含有H2O2的催化体系中, 0 min前为吸附实验, 之后开始加入H2O2. 从图3(A)可见, H2O2及FePcCl16/H2O2体系对DXMS的去除能力几乎无差异, 这是由于FePcCl16在水体中易团聚, 分散性差, 未能活化H2O2所致. 而FePcCl16@CB/H2O2及FePcCl16-Py-CB/H2O2体系均表现出优异的催化性能, 这是由于将FePcCl16负载于CB上, 增加了FePcCl16的分散性, 有助于裂解H2O2而产生活性物种[21,22]. 而FePcCl16-Py-CB/H2O2体系的催化性能优于FePcCl16@CB/H2O2体系, 说明轴向配位合成的催化剂性能优于回流法, 这归因于不同的催化机理[23,24]. 由图3(B)可见, FePcCl16-Py-CB@LMPET体系中, DXMS吸附率仅为4%, 这主要是因为LMPET为疏水性纤维[25], 阻碍了FePcCl16-Py-CB对底物DXMS的吸附. 在H2O2体系中, DXMS的降解率为11%, 而在FePcCl16-Py-CB@LMPET/H2O2体系中, FePcCl16-Py-CB@LMPET对DXMS的催化降解率为96%, 说明FePcCl16-Py-CB@LMPET活化了H2O2从而大幅度提高了体系中 DXMS的降解率. 因此, FePcCl16-Py-CB@LMPET在温和条件下具有优异的催化性能. LMPET作为一种商用低熔点皮芯聚酯纤维, 芯层能提供较高的强度, 表层具有较好的黏接性能, 可有效提高催化剂与纤维的结合能力, 而且采用热黏合法负载催化剂的方法简便易行, 因此, LMPET作为固着粉末状催化剂的载体具有重要的应用潜力.
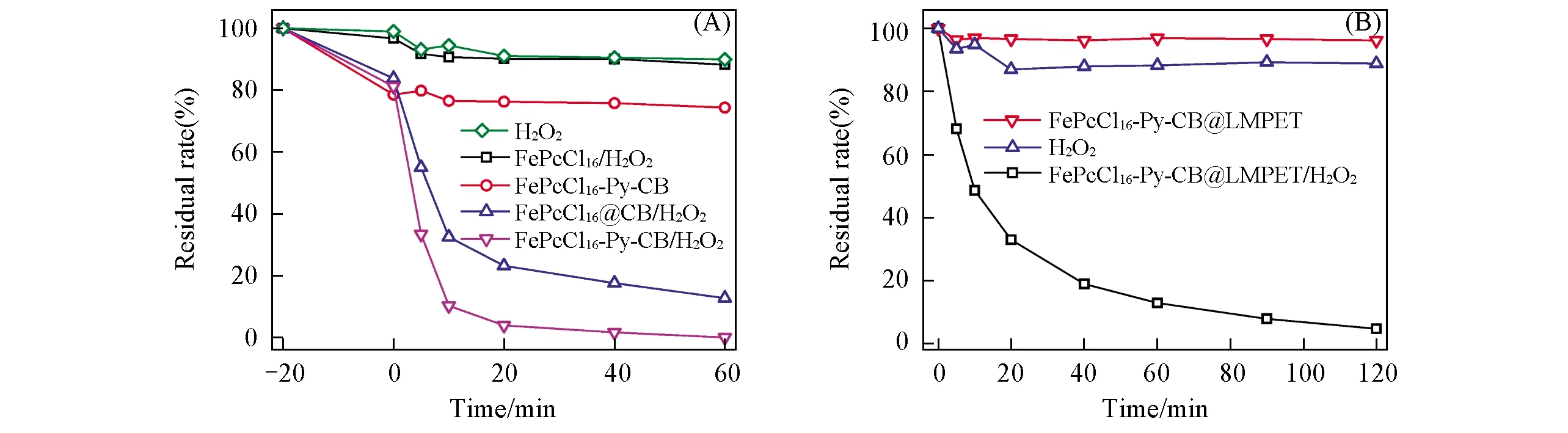
Fig.3 Catalytic activity of different system(A) [FePcCl16]=[FePcCl16@CB]=[FePcCl16-Py-CB]=0.025 g/L, [H2O2]=5 mmol/L, [DXMS]=2.5×10-5 mol/L, pH=6.70, 25 ℃; (B) [FePcCl16-Py-CB@LMPET]=5 g/L, [H2O2]=20 mmol/L, [DXMS]=2.5×10-5 mol/L, pH=6.70, 25 ℃.
2.4 循环使用性能
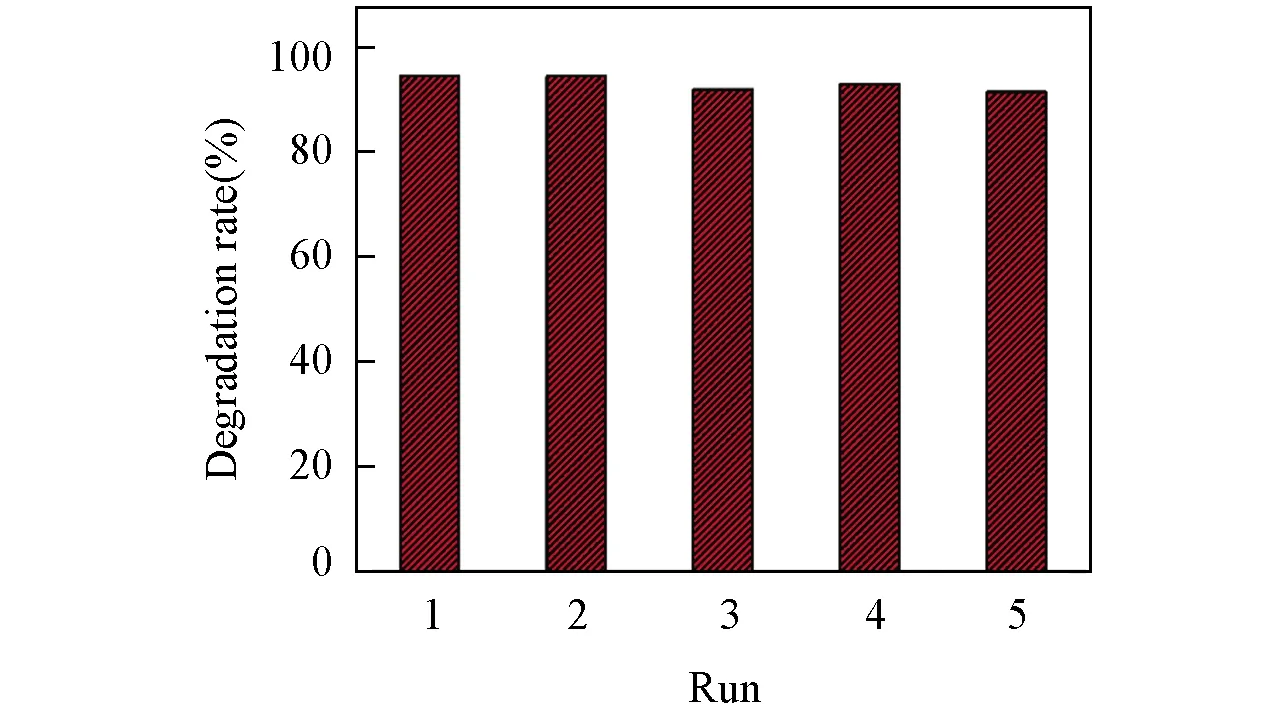
Fig.4 Cyclic catalytic oxidation of DXMS[FePcCl16-Py-CB@LMPET]=5 g/L, [H2O2]=20 mmol/L, [DXMS]=2.5×10-5 mol/L, pH=6.70, 25 ℃.
催化剂的循环使用性能在一定程度上反映了催化剂的稳定性. 每次实验结束后从反应体系中取出FePcCl16-Py-CB@LMPET, 用去离子水冲洗, 烘干后在相同的实验条件下进行下次实验, 如此重复操作, 采用DXMS的降解率评价该催化剂的循环使用性能. 如图4所示, 该仿酶催化剂经过5次循环使用后, 其对DXMS的催化降解率仍为92 %, 由此证明该催化剂的稳定性能较好, 可多次循环使用, 具有工业应用前景.
2.5 催化机理
IPA和p-BQ分别为羟基自由基和超氧自由基的捕获剂, 通常用于考察催化体系中的催化机理. 在催化体系中分别加入IPA和p-BQ, 所得结果如图5(A)和(B)所示, 体系中DXMS的降解率均下降了约10%, 说明IPA和p-BQ对催化体系均具有轻微的抑制作用. 为了证明仿酶催化剂FePcCl16-Py-CB@LMPET的抗毒化性和选择性, 采用与FePcCl16-Py-CB@LMPET的活性中心FePcCl16摩尔浓度相同的Fe2+的芬顿体系作为对照实验. 芬顿体系中H2O2的浓度、底物PCMX的浓度、IPA及p-BQ的浓度及反应温度等与仿酶催化体系均相同, pH约为3. 由图5(C)可见, 芬顿体系在120 min对DXMS的催化氧化降解率为57%. 加入IPA及p-BQ后, 体系对DXMS的降解率分别为12%和3%, 分别抑制了45%和54%. 而仿酶催化体系加入IPA和p-BQ只是轻微地抑制, 可见, 仿酶催化剂FePcCl16-Py-CB@LMPET具有良好的抗毒化性和选择性.
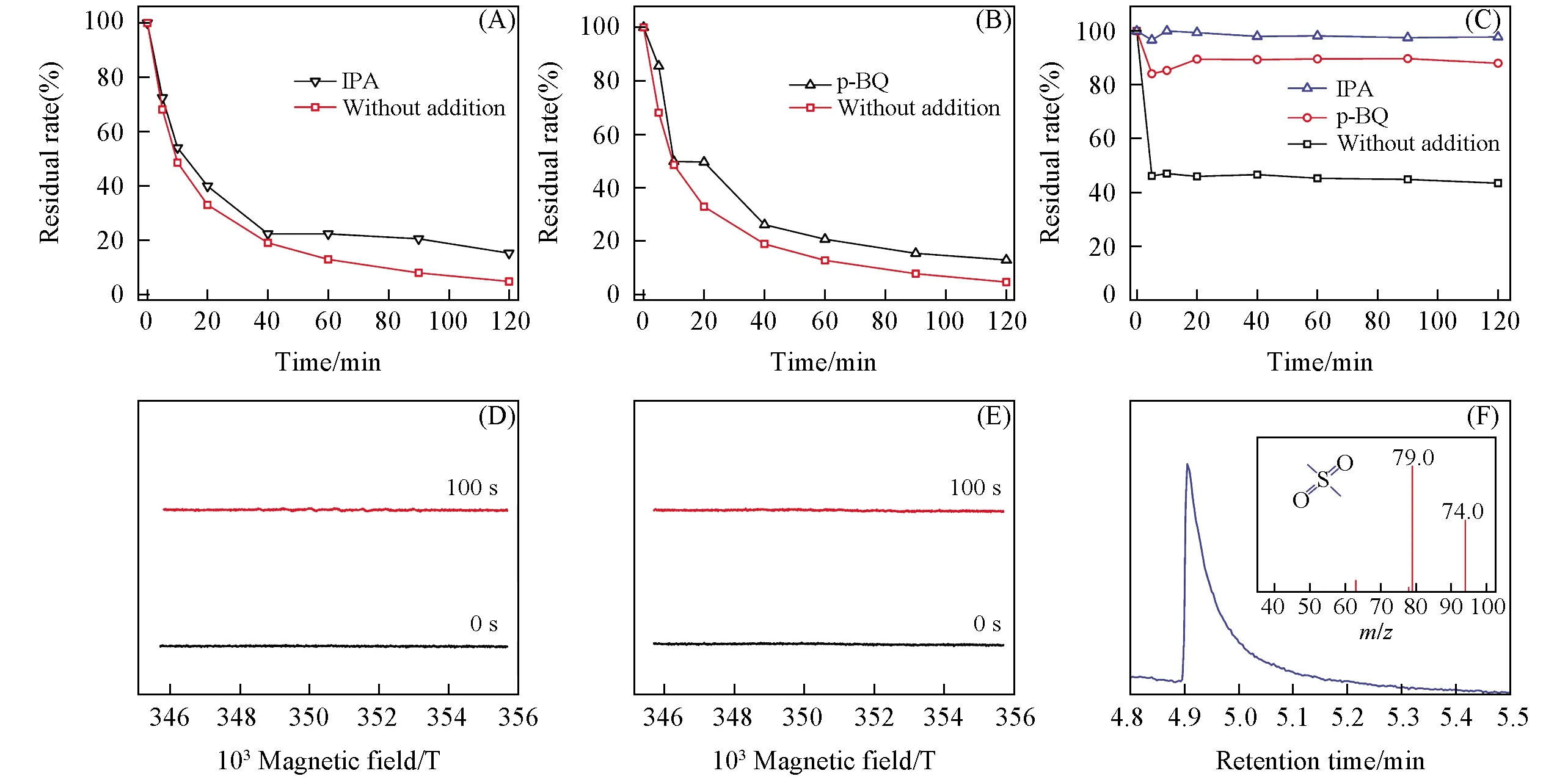
Fig.5 Effects of IPA(A)and p-BQ(B) on degradation rates of DXMS by FePcCl16-Py-CB@LMPET and Fe2+(C), DMPO spin-trapping EPR spectra in aqueous solution(D) and methanol solution(E), GC-MS chromatograms of oxidation products of DMSO catalyzed by FePcCl16-Py-CB@LMPET(F)(A, B)[FePcCl16-Py-CB@LMPET]=5 g/L, pH=6.70; (C) [FeCl2·4H2O]=0.025 g/L, pH 3.0; (D—F) [FePcCl16-Py-CB@LMPET]=5 g/L, [DMPO]=10 mmol/L, pH 6.70. The inset of (F) shows the MS spectrum of DMSO. [H2O2]=20 mmol/L, [DXMS]=2.5×10-5 mol/L, [IPA]=500 mmol/L, [p-BQ]=5 mmol/L, 25 ℃.
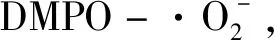

(1)

(2)

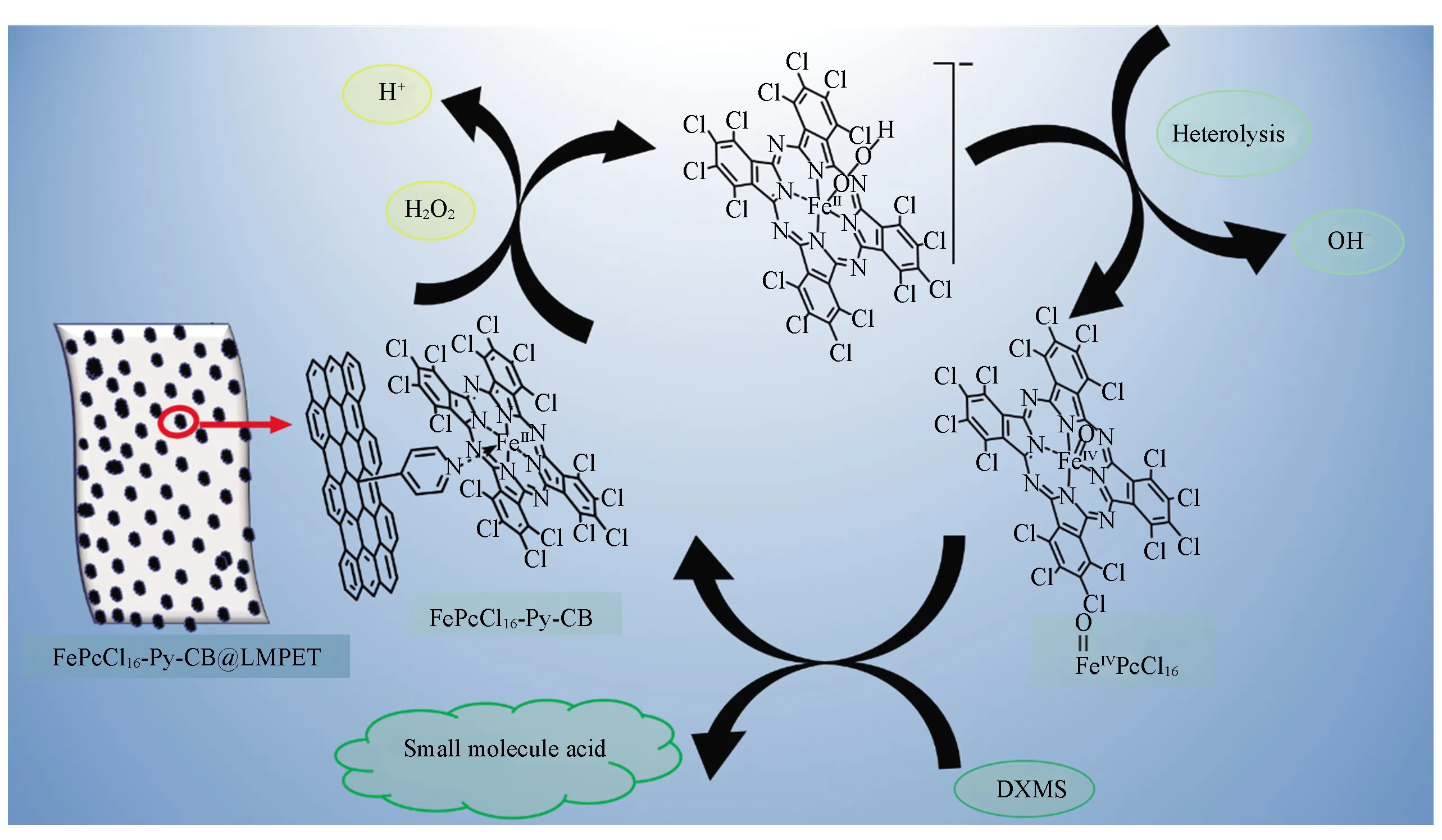
Scheme 1 Possible catalytic mechanism for degradation of DXMS by FePcCl16-Py-CB@LMPET in the presence of H2O2
2.6 降解路径

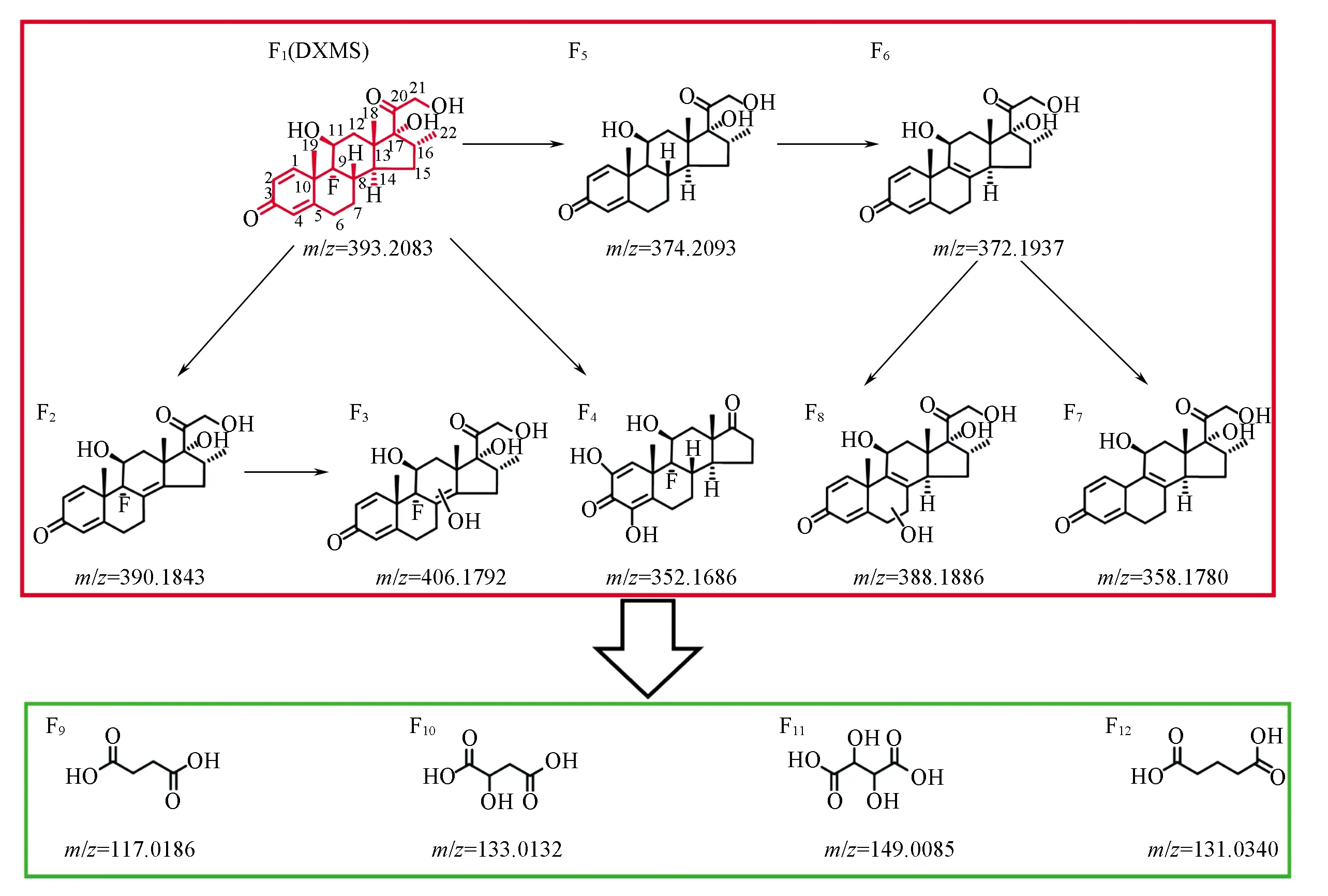
Scheme 2 Possible pathway for the degradation of DXMS
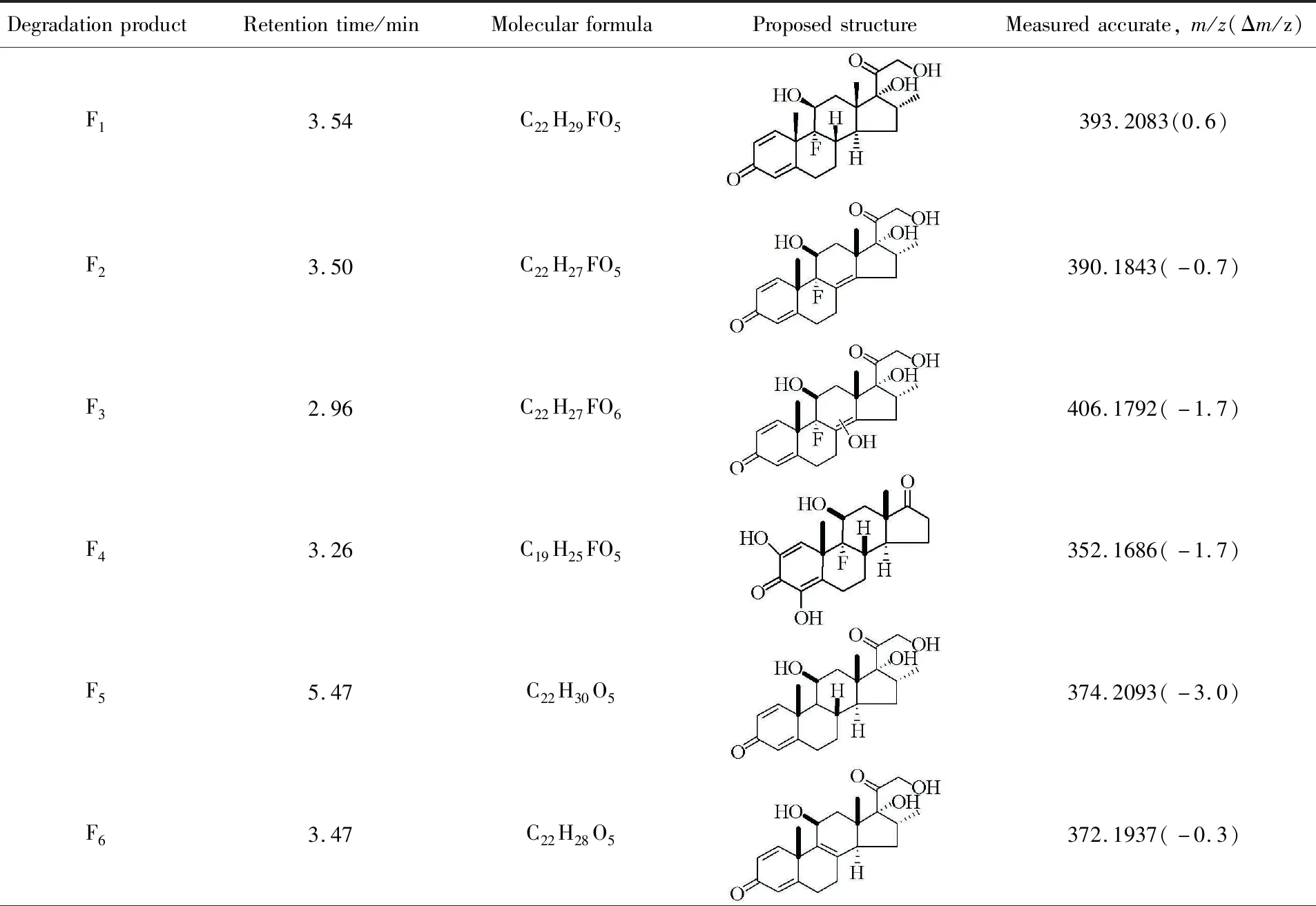
Table 1 Degradation products of DXMS by FePcCl16-Py-CB@LMPET in the presence of H2O2 examined by HDMS in positive(negative) ion mode after 120 min reaction time
Continued
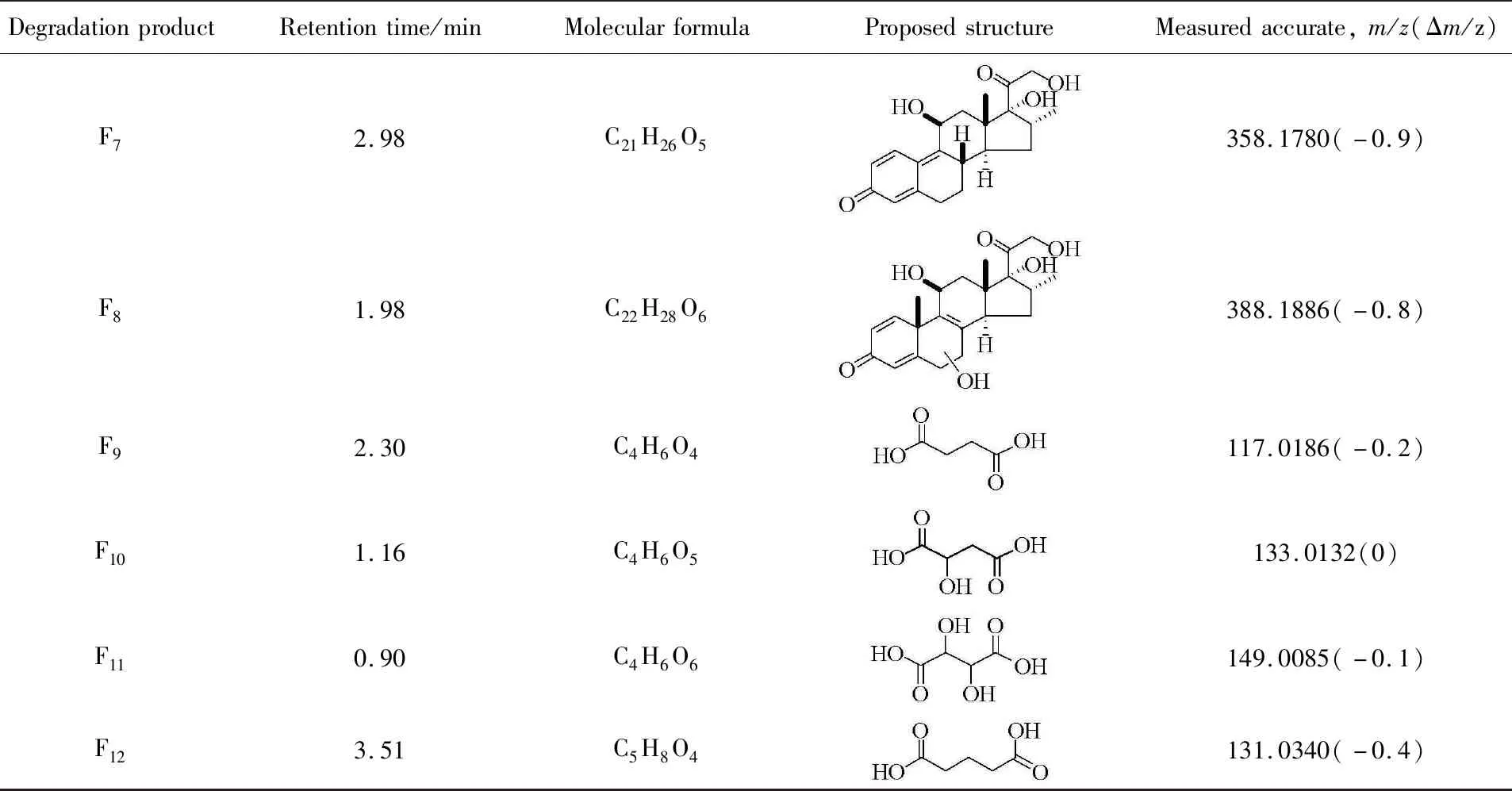
DegradationproductRetentiontime/minMolecularformulaProposedstructureMeasuredaccurate,m/z(Δm/z)F72.98C21H26O5358.1780(-0.9)F81.98C22H28O6388.1886(-0.8)F92.30C4H6O4117.0186(-0.2)F101.16C4H6O5133.0132(0)F110.90C4H6O6149.0085(-0.1)F123.51C5H8O4131.0340(-0.4)
3 结 论

