框架核酸辅助的仿生膜构建
2020-07-13毛秀海左小磊
严 磊, 毛秀海, 左小磊
(上海交通大学医学院附属仁济医院分子医学研究院, 上海市核酸化学与纳米医学重点实验室, 上海 200127)
生物膜是细胞膜及各种细胞器膜的统称, 由脂类(如磷脂和胆固醇等)、蛋白质及多糖等生物物质自组装形成[1~3]. 近年来, 为了进一步理解生物膜系统, 研究者致力于构建与其组分、结构或功能相似的仿生膜体系. 同时, 作为一种新型的多功能复合材料, 仿生膜在智能医用材料制备、疫苗开发、疾病诊断以及分子机器等领域也受到广泛关注. 其中, 设计并构建仿生功能膜蛋白是仿生膜研究领域中的重要环节, 是决定仿生膜材料的性能及应用范围的关键因素[4]. 迄今, 科研人员已经开发了一系列典型的仿生功能膜蛋白材料, 包括功能性互锁分子、复合共轭聚合物、核酸树状分子、生物仿生多肽和核酸纳米结构等[5,6]. 其中, 使用框架核酸来构建仿生功能膜蛋白是仿生膜研究领域中的重要方向. 框架核酸(Framework nucleic acids)是利用Watson-Crick碱基互补配对原则设计并合成的三维立体的具有特定形状与功能的核酸纳米结构(Nucleic acids nanostructure)[7~9]. 框架核酸具有纳米级构建精度及良好的可编程性等优势, 由其构建的仿生功能膜蛋白能够克服其它经典纳米结构的尺寸、形状及操控限制, 从而实现仿生膜的形状或结构控制、调节仿生膜内外的分子通过与信息交流、靶向递送与释放纳米药物、检测体内及体外的化学物质变化等, 为生物分析、疾病诊断和癌症治疗等领域的研究提供了新视角[10]. 本文基于框架核酸在仿生膜领域的研究价值及应用前景, 简要介绍了框架核酸的设计、组装及表征方法, 随后概括了基于框架核酸的仿生膜构建方法及机制, 最后评述了基于框架核酸的仿生膜的应用情况, 并对基于框架核酸的仿生膜材料进行了总结与展望.
1 框架核酸的构建与表征
1.1 框架核酸的构建
框架核酸作为近年来新兴的前沿交叉材料, 旨在利用DNA分子卓越的自组装和识别能力, 将其作为一种纳米材料可实现精确的自下而上的纳米构筑, 从而设计各种功能纳米结构[11~18]. 框架核酸巨大的研究价值和技术效益已经引起人们对该纳米材料的极大关注. 与传统的无机、有机、聚合物或纳米粒子等材料相比, 框架核酸具有接近原子尺寸的精度, 可以任意构建并控制纳米结构的形状与结构, 并且可以将功能化的小分子、生物大分子或纳米颗粒进行可控定点组装[图1(A)][19~24]. 更重要的是, 框架核酸具有优良的生物相容性, 它可以连接在细胞膜表面或被细胞主动吸收, 并在细胞内膜或外膜上发挥相应的功能[25~27].
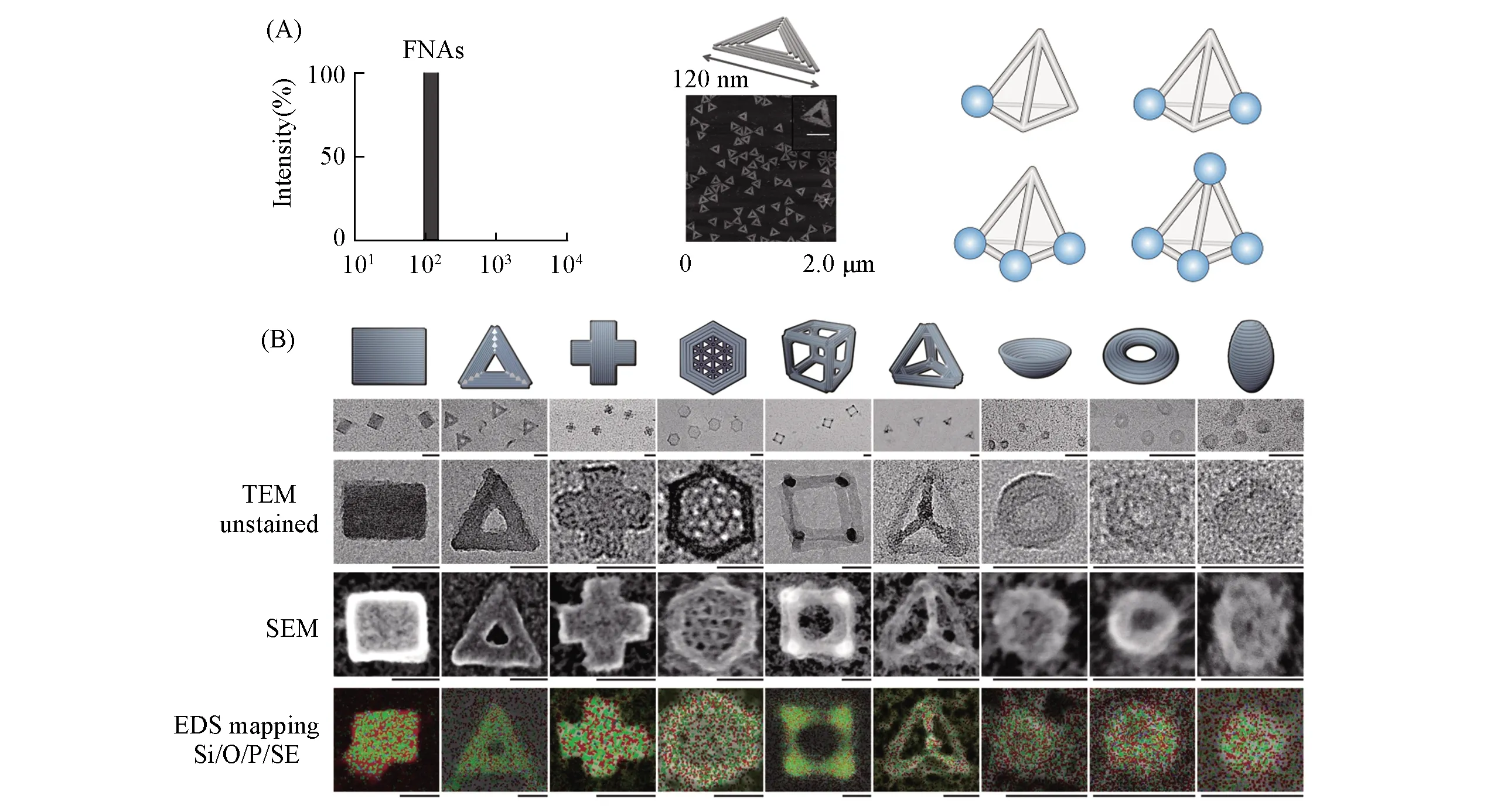
Fig.1 Schematic representations of framework nucleic acids(A) FNAs are truly monodispersed nanostructures with precise size, shape and manipulation manipulation[11]; Copyright 2018, American Chemical Society. (B) schematic of nanostructures and TEM images for framework nucleic acids with various shapes. Scale bars, zoomed-out 100 nm and zoomed-in 50 nm[32]. Copyright 2018, Springer Nature.
目前, 利用DNA纳米技术和相关的纳米结构设计软件[28,29]可构建多种不同维度及形状的框架核酸: 从简单的几何图形(三角形、正方形等)到复杂的非几何结构, 从二维的平面形状到三维的弯曲立体结构[30~32][图1(B)]. 在构筑框架核酸时, DNA折纸法是最常用的构建方法[31]. 在该方法中, 以含7千多碱基的M13单链DNA作为“模板”, 加入特定序列的数百条DNA短链; 在一定的高温下, 通过DNA互补配对原则, 这些数百条短链DNA“钉”在“模板”长链的支架上, 然后在数小时至数天的过程中缓慢冷却DNA, 使构成该结构的DNA链退火, 从而构建了各种二维和三维纳米结构[33,34]. 此外, Jungmann等[35]发现, 通过缓慢降低变性剂(如甲酰胺或尿素)的浓度, 亦可以使DNA纳米结构在恒定温度下自组装, 为DNA纳米结构的合成提供了新方法. 之后, 以该DNA纳米结构作为框架, 可将各种功能化的化学基团或纳米材料修饰在特定位置, 从而构建具有各种不同功能与形状的框架核酸.
1.2 框架核酸的表征
形状与结构的表征是构建框架核酸过程中的重要步骤. 常用的结构表征方法有电泳、原子力显微镜(AFM)、透射电子显微镜(TEM)、动态光散射(DLS)及小角X线散射(SAXS)等[36]. 由于原子力显微镜与透射电子显微镜能够清晰地展示框架核酸的精细形状及复杂排布, 因此在其结构表征中具有举足轻重的作用. 其中, 原子力显微镜不仅可以提供框架核酸的结构形态和大小信息, 同时可以实时监测框架核酸的折叠路径和反应机理. 如, Dunn等[37]利用原子力显微镜实时、原位观测了“瓷砖”框架核酸的二聚体折叠过程, 并通过加入相应的“订书钉”短链来引导该框架核酸二聚体的折叠路径, 实现了框架核酸形貌及结构的实时控制. 但是在成像过程中, AFM的悬臂梁会不断对样品施加力, 使三维的框架核酸失去形状稳定性并坍塌成平面结构, 因此原子力显微镜无法准确反映三维框架核酸的立体结构[38]. 因此, 在表征三维立体的框架核酸辅助的仿生膜时, 研究者更多选用成像效果更好的透射电子显微镜来表征其形状与结构[39]. 如, Langecker等[40]利用TEM精确地观测到框架核酸构建的仿生离子通道附着在脂质胞囊上. 此外, Andersen等[41]证明小角X线散射亦可以原位表征框架核酸的特征轮廓.
2 框架核酸辅助的仿生膜的组装类型
框架核酸与脂类聚合物的相互作用方式决定着仿生膜的结构与性能, 一直以来都是仿生膜领域的研究热点. 在组装框架核酸辅助的仿生膜的过程中, 框架核酸与脂类聚合物在各种较弱作用的共同作用下逐步形成结构有序且稳定的仿生膜系统. 具体来讲, DNA带有负电荷且亲水性强, 框架核酸无法直接嵌入到疏水的脂质聚合物中. 但是, 利用框架核酸的可寻址性和纳米级定位精度的能力, 在框架核酸上引入特定的连接基团, 从而使框架核酸嵌入到脂类聚合物中或吸附在其表面, 并实现仿生膜的界面调控和功能改造. 框架核酸辅助的仿生膜的形成主要依靠框架核酸与脂类聚集体之间的疏水作用、静电作用以及适配体-靶标分子之间的相互作用等方式(图2).

Fig.2 Schematic representations of different anchoring methods for framework nucleic acids to lipid membranes(A) Porphyrins modified Framework nucleic acids with ed onto lipid membrane via hydrophobic effect[44], Copyright 2011, Wiley-VCH; (B) schematic representation of the DNA-lipid interaction via electrostatic interaction[51], Copyright 2006, American Chemical Society; (C) aptamer specifically bind to the EpCAM protein on cell surface, triggering DNA hybridization reaction to form DNA hydrogel[59], Copyright 2017, American Chemical Society.
2.1 疏水相互作用
疏水作用是框架核酸锚定在仿生膜上最常见的非共价形式. 疏水相互作用是一种非极性分子之间弱的、非共价的相互作用. 通过在框架核酸上定点修饰疏水基团, 利用非极性分子在水相环境中具有避开水而相互聚集的特性, 从而将框架核酸锚定在脂质膜内. 其中, 卟啉作为一种疏水基团, 由于其自身具有传递电子与进行能量转移的能力, 适合作为光物理和氧化还原活性的脂锚[42,43]. 如, 为了研究疏水基团及脂质膜对框架核酸的影响, Borjesson等[44]将疏水分子——卟啉修饰在框架核酸上, 并使框架核酸锚定在细胞膜表面; 然后, 利用荧光漂白恢复技术观测框架核酸在膜上的扩散行为, 发现框架核酸在膜上可以自由扩散; 同时, 熔融实验证明框架核酸在膜上能进行热诱导的可逆组装, 为研究框架核酸的自修复机制提供了理论基础[图2(A)]. 此外, 胆固醇能自发地插入脂质双分子层, 是另一种常用的锚定基团[45~47]. 如, Johnson-Buck等[48]将胆固醇修饰在矩形的框架核酸的底面, 利用单粒子荧光显微镜观测到框架核酸在脂质双层上结合并能进行横向扩散运动. 从侧面证明框架核酸可以作为膜结构的超分辨率探针, 用于对生物膜的连续区域及位置进行高精度绘制, 从而提供一种新颖、可控的方法来表征活细胞内的生物膜和细胞骨架组织. 除胆固醇外, 聚环氧丙烷[49]和β-生育酚[50]也被用作链接基团修饰在框架核酸上, 并成功地将框架核酸结构嵌入脂膜中.
2.2 静电力作用
框架核酸与仿生膜之间的静电作用驱动的自组装也被广泛应用于仿生膜的构建中. 与疏水作用不同, 静电相互作用根据所带粒子电性不同表现出吸引力或排斥力: 带相同电荷的粒子之间表现出排斥力, 带不同电荷之间的粒子表现出吸引力. Gromelski等[51]发现, 通过调控溶液中阳离子的浓度及种类, 可以精确调整框架核酸与仿生膜的结合行为. 具体来讲, 在Mg2+或Ca2+等二价阳离子存在下, 阳离子会插入到带两性离子的脂质中, 并中和脂质的负电荷, 从而产生净正电荷. 而该带正电荷的脂质体可与带负电荷的框架核酸相互吸引, 从而介导框架核酸吸附在脂膜之上[图2(B)].
2.3 适配体-靶标分子之间的相互作用
框架核酸也能通过特定的适配体与靶标之间的相互作用形成仿生膜体系. 尽管适配体与靶标分子之间的相互作用不是共价修饰, 但是它们之间的亲和力强. 更重要的是, 适配体识别能力强、选择性高, 可特异结合仿生膜上特定的膜蛋白[52~58]. 本课题组[59]利用适配体对循环肿瘤细胞膜表面上皮细胞黏附因子的特异性结合能力, 开发出新型的基于杂交链式反应的DNA水凝胶, 并用于肿瘤循环细胞的捕获和释放. 该水凝胶的形成不会破坏细胞的活性, 为收集循环血液中关于原发性肿瘤的准确信息提供了新方法[图2(C)].
3 框架核酸辅助的仿生膜的应用领域
如前所述, 框架核酸可以通过不同的作用方式链接在脂膜上, 并形成新型的仿生膜系统及材料. 该仿生膜不仅具有框架核酸原有的性质, 而且在结构、形状、光学以及靶向能力等方面具有优异的特性, 并在仿生膜形状的调控、生物分子的检测与成像、门控运输以及纳米医学及疾病诊疗等领域具有广泛的应用.
3.1 仿生膜的形状调控
在过去的几十年里, 科研人员开发了各种构建人工囊泡或脂质膜的方法, 并作为研究细胞生物学的模型及用于开发新型的药物载体[60]. 由于生物膜的几何结构决定了其物理和化学性质(如融合原性、与蛋白质的结合亲和性及对酶修饰的敏感性等), 因此精确调控仿生膜的形状和结构是重要的研究方向[61,62]. 基于此, 利用框架核酸可编程及形状精确的特性, 可通过模仿天然膜雕刻蛋白来构建不同结构和形状的框架核酸作为仿生膜的“外骨骼”, 从而调控仿生膜的结构与形状. 如, 为了研究生物膜的曲率对细胞运输、信号传递等功能的影响, Franquelim等[63]设计了3种不同曲率的基于框架核酸的仿生雕刻蛋白, 并观测仿生膜在这些框架核酸中的生长过程及变化情况. 结果表明, 框架核酸的曲率直接决定仿生膜的形状及内陷形变程度等, 为进一步研究生物膜变形背后的物理过程及原理提供了依据[图3(A)]. 类似地, Birkholz等[64]构建了多个基于框架核酸的仿生膜蛋白并插入到脂质层中, 从而模仿并研究细胞胞吞过程中的膜受体聚集现象, 发现框架核酸会在脂质层的弯曲处富集并进一步诱导生成生物膜突起. 此外, 为了进一步控制生物膜的管状形变, Grome等[65]模仿内体分选复合体(ESCRT)机械的螺旋结构, 将框架核酸设计成一个螺旋状的卷曲结构. 这种卷曲结构会诱导Snf7蛋白在仿生膜上组装成螺旋状, 从而引起囊泡变形和小管的形成.
除了控制囊泡的形状, 精确控制脂质囊泡的大小也是重要的研究方向. 如, Yang等[66]开发了一种基于框架核酸的“外骨架”, 使仿生膜有序生长, 从而实现生物膜尺寸控制[图3(B)]. Zhang等[67]进一步对这种框架核酸“外骨架”进行组装、排列和重塑, 构建了形状复杂、弯曲的工程仿生膜. 尽管这些基于框架核酸的仿生结构尚处于初级阶段, 但为研究生物膜重塑机制提供了新方法和工具, 也为复杂的细胞机械的发展铺平道路.
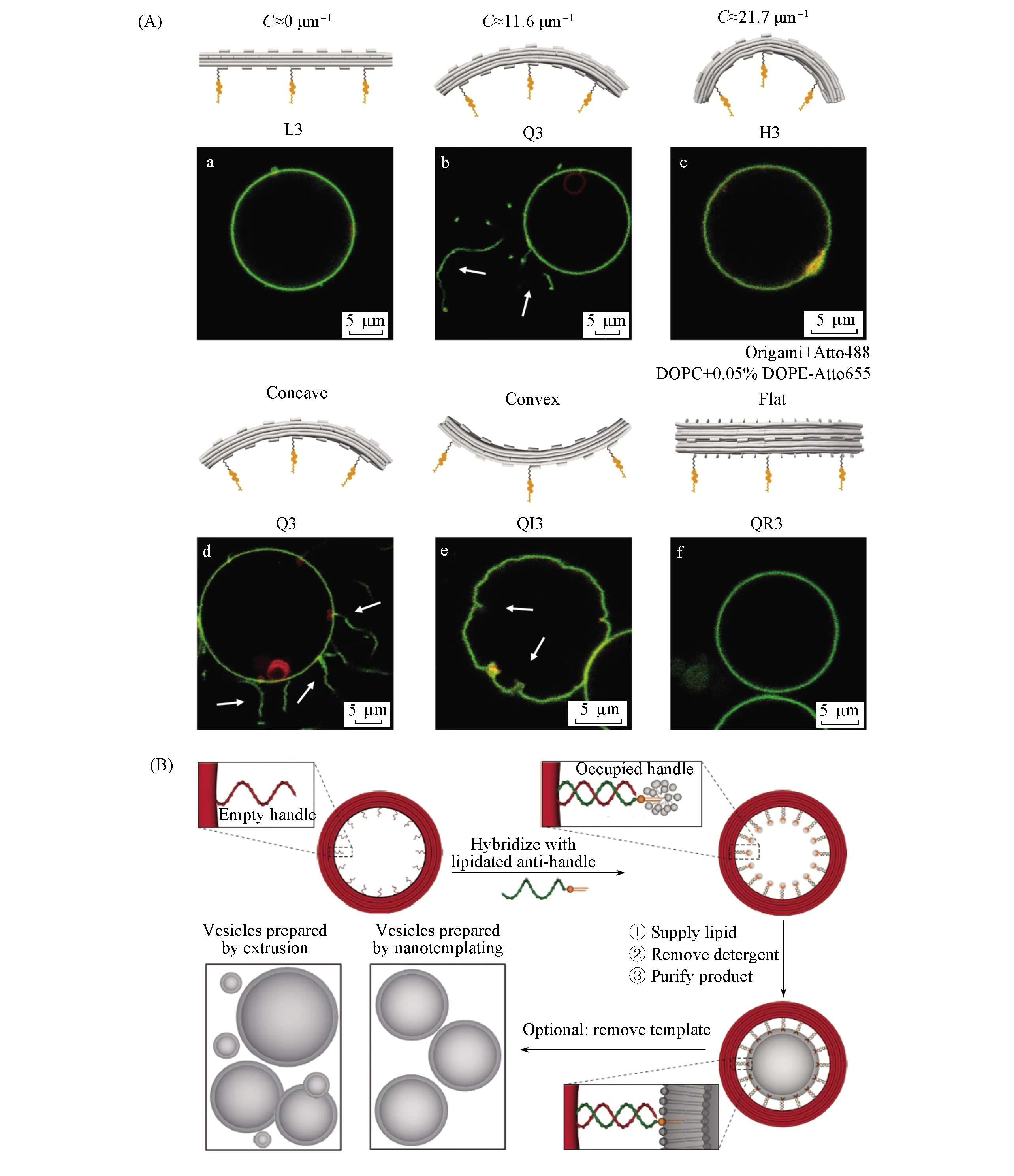
Fig.3 Representative examples of FNAs for shaping membrane(A) Framework nucleic acids with a variety of curvatures developed to study their abilities to shape membranes[68], Copyright 2018, American Chemical Society; (B) schematic of the FNA “exoskeleton” to confine the size of liposomes products[69], Copyright 2019, Wiley-VCH.
3.2 仿生“门控”蛋白的纳米通道
生物膜上的跨膜蛋白是分子进入细胞的通道, 负责控制生化物质及信号的流入和流出. 如, 离子通道可以响应化学、光或机械等刺激而打开或关闭离子传输, 选择性地控制特定离子通过膜的流动, 该离子通道的开关调节又被称为“门控”调节. 目前研究者对“门控”蛋白的仿生设计研究兴趣极大. 但因传统仿生材料(如多肽和有机聚合物等)无法精确控制其结构, 从而限制了该领域的研究和发展. 而框架核酸的精确可控性使其可被折叠成多种精确结构, 从而满足创建人工通道的各种需求. 如, 为了验证框架核酸能否仿生跨膜蛋白结构并实现其门控功能, Maingi等[70]通过中空的螺旋框架核酸与烷基组成的外部疏水带的结合将其插入到仿生膜中, 利用分子模拟计算方法研究了该框架核酸在仿生膜中的稳定性和构象动力学, 并发现框架核酸的疏水基团为其在脂质双层中的稳定性提供了能量保障.
设计动态纳米通道是实现“门控”功能的关键. 基于此, Burns等[71]设计了一个带有“分子门”的框架核酸纳米通道: 该纳米通道在底部有一个简单的DNA“锁”结构. 通过加入DNA“钥匙”, 利用DNA杂交原理可将DNA “锁”移除, 从而开启纳米通道. 他们发现, 该纳米通道对带电分子有很高的选择性, 能够实现小分子有序和可控释放[图4(A)]. 类似地, 结合分子网络技术, Peng等[72]构建了一个胆固醇修饰的桶状跨膜框架核酸, 实现了生物分子的双向智能选择性通过. 该框架核酸拥有2个不同的结合区域, 分别控制生物分子的流入与流出. 具体来讲, 在ATP存在的情况下, 外部的纳米通道会打开并让溶液中游离的Zn2+离子进入仿生膜囊泡中. 这些Zn2+离子会进一步触发仿生膜内的信号网络, 在经历信号接收、转导和响应等过程后, 发出反馈分子信号从而关闭内部的纳米通道, 最终完成反馈调节. 该框架核酸仿生膜的构建为设计更智能的分子网络体系、分子信号系统以及人工细胞提供了一种新策略[图4(B)].
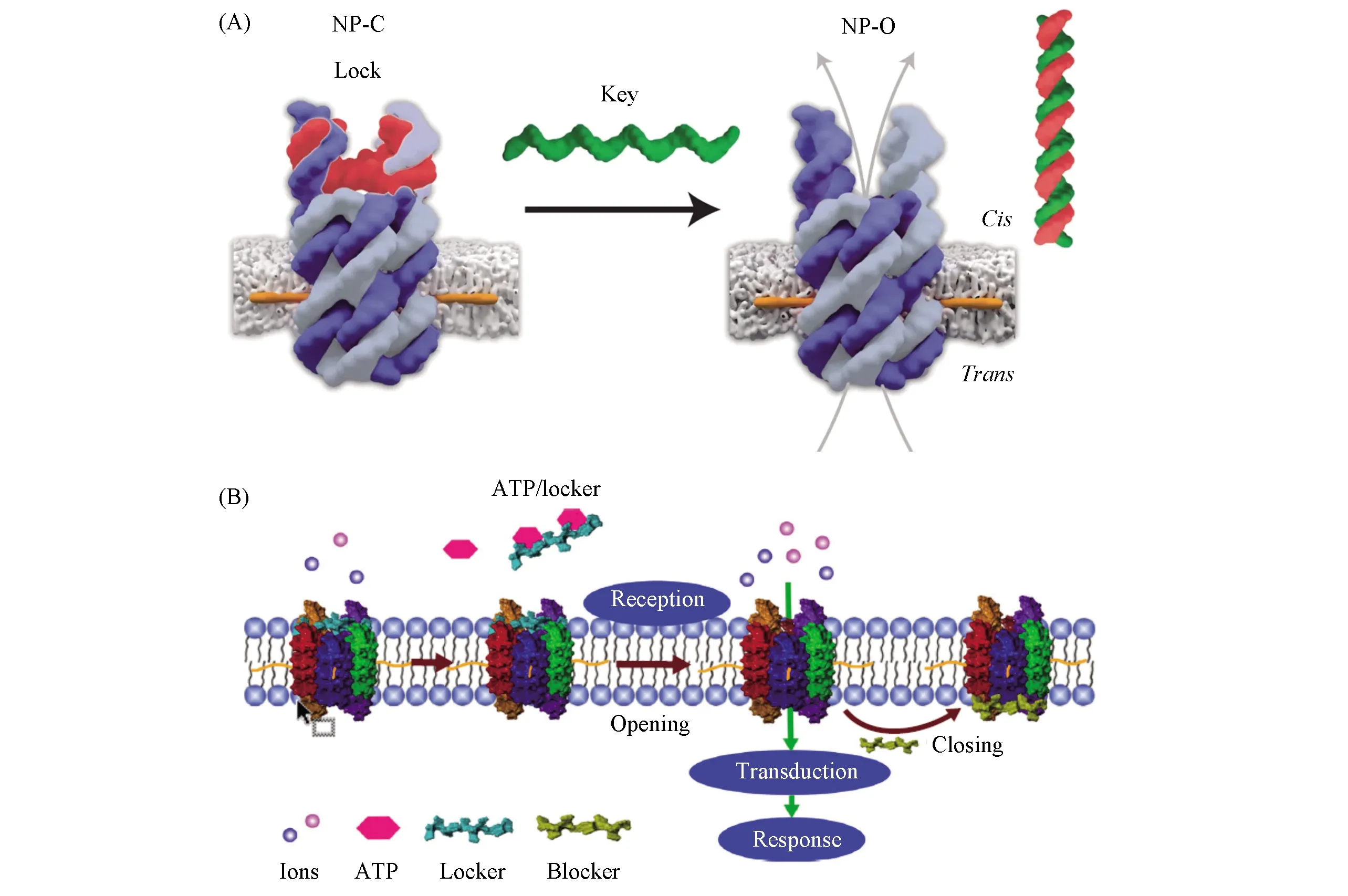
Fig.4 Representative examples of framework nucleic acids for “Gated” transportation(A) Schematic of opening the Framework nucleic acids based nanopore with single stand DNA of “key” [68], Copyright 2018, American Chemical Society; (B) schematic illustration of artificial molecular signaling system[72], Copyright 2020, Springer Nature.
除了构建纳米通道来控制分子的运输和信息的交流, 纳米通道亦被用来研究天然纳米通道的门控机制及机理. 如, 在生物体内离子类型和离子强度的变化直接决定跨膜蛋白的结构, 从而影响离子穿透膜蛋白通道的能力. 然而, 现有的技术难以观测到盐离子构浓度对跨膜蛋白通道的结构或形状的影响. 为了实现该目标, Liu等[73]设计了6-螺旋束(6HB)纳米管形状的框架核酸. 通过分子模拟, 并结合小角X射线散射和荧光分析等实验结果发现, 溶液及管道中的Mg2+离子会中和纳米管道内部的负电荷, 从而使纳米通道展现成致密状态(“II”形); 而将溶液替换为单价的Na+离子后, 则使其变为膨胀态(“O”形). 该结果直接证明纳米管道在不同生理条件下会发生形态重构, 为其实现仿生通道选择性“门控”功能的应用提供了理论基础.
3.3 生物分子检测与细胞成像
利用框架核酸构建的仿生纳米通道开发能够检测单个分子的纳米孔传感器是仿生膜研究领域中另一个重要的方向. 尽管基于天然蛋白的纳米孔检测方法展现出优异的电学性能并实现了单分子传感的目标, 但现有的蛋白质工程方法无法设计或调控纳米孔的几何形状和尺寸, 阻碍了纳米孔检测灵敏度及选择性的进一步提高, 从而限制该方法的应用[74]. 相比之下, 形状可控的框架核酸为定制化的纳米孔构建提供了新的方法和材料. 如, 受天然通道蛋白(α-溶血素)的启发, Langecker等[40]开发了一种基于桶状结构的框架核酸仿生纳米孔, 并实现了脂质双层的穿透仿生离子通道的构建. 实验结果表明, 该穿膜框架核酸纳米孔的电导约为1 ns, 比蛋白质离子通道高出几个数量级, 体现了良好的离子运输能力, 同时具有单DNA碱基错配的分辨能力(见图5). 此外, Göpfrich等[75]制备了一种截面积为6 nm的基于框架核酸的仿生孔蛋白, 可将纳米孔的电导率提高至40 ns, 为生物大分子的痕量检测奠定了基础.
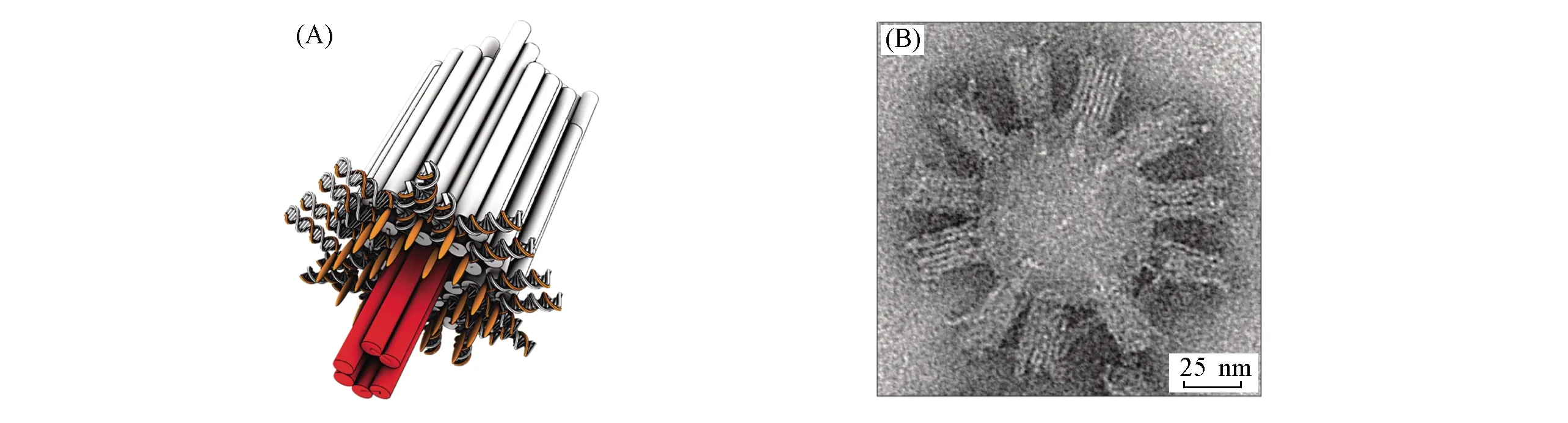
Fig.5 Framework nucleic acids based nanopore for single molecule detection[68](A) Schematic design of the channel consisting of a barrel-shaped cap(white) and a transmembrane stem(red); (B) representative TEM images of DNA channels adhering to small unilamellar vesicles(SUVs). Copyright 2018, American Chemical Society.
此外, 将框架核酸锚定在细胞膜内, 用以监测活体细胞内的生理微环境变化, 如核酸、蛋白质、离子、小分子、pH及温度等, 是另一个具有潜力与前景的应用方向[76~83]. 如, He等[84]设计了一种基于熵驱动的四面体框架核酸放大器, 该放大器能通过跨膜转运并锚定在细胞内膜上, 从而观测细胞内mRNA的浓度变化和时空分布, 并探究活细胞状态与疾病进展之间的关系. 为了研究细胞内金属稳态对细胞活性的影响, Zhou等[85]设计了一种双色编码的四面体框架核酸探针, 用于同时监测细胞内多种有毒金属离子的状态. 本课题组[86]利用多支化的杂交链式反应(HCR)获得了具有多种生物蛋白的长螺旋枝状结构, 从而捕获外周血中的循环肿瘤细胞. 该方法的检测限达到4个癌细胞, 可用于对癌症预后与肿瘤转移情况的评估.
3.4 纳米医学与疾病诊疗
药物传递和释放过程中均涉及生物膜的相互作用. 利用框架核酸仿生膜实现靶向载药与治疗是纳米医学中最有前景的研究领域[86~88]. 2011年, 本课题组[89]发现四面体框架核酸较容易被细胞内吞; Kim等[90]用四面体框架核酸将抗癌药物阿霉素(DOX)递送到耐药乳腺癌细胞, 并实现了癌细胞的靶向治疗. 之后, 为了探索框架核酸进入细胞的机制, 本课题组[91]采用分子动力学模拟方法研究了框架核酸在进入细胞膜过程中的变化. 模拟结果显示, 为了减少脂质膜与框架核酸之间的静电斥力, 正四面体框架核酸采用“角攻击”的方式接近带细胞膜, 从而与细胞膜表面的小窝蛋白结合, 并进入细胞中. 除了四面体框架核酸外, Wang等[92]测试了其它不同大小、形状的框架核酸(棒状、三角架状等)的细胞摄取情况, 发现长径比高的框架具有更高的摄取效率.
除了提高细胞的摄取效率外, 框架核酸的特异拓扑编程结构能进一步提高其对生物膜蛋白的靶向识别能力. 如, 本课题组[93]提出了四面体框架核酸控制的方法, 对细胞膜上的受体配体进行拓扑结构设计. 我们通过精确控制四面体上的适配体数量及位置, 诱导细胞膜上的配体进行拓扑重排, 引起簇状受体的主动募集-结合, 最终提高其与靶标蛋白的结合能力及捕获循环肿瘤细胞的效率[图6(A)]. 此外, Ge等[94]报道了一种靶向配体修饰框架核酸, 可作为靶向前列腺癌治疗的抗体药物偶联载体. 作为药物偶联的抗体, 抗前列腺特异性膜抗原(PSMA)被修饰到框架核酸中的6个螺旋束中, 而抗癌药物阿霉素(Dox)则通过疏水作用插入到框架核酸中的双链DNA中. 该纳米复合材料可选择性地将Dox传递到表达PSMA的癌细胞系中[图6(B)]. 此外, Ma等[95]在四面体框架核酸上锚定了一个乳腺癌生物标志物HER2的适配体, 该框架核酸会特异性结合乳腺癌细胞膜上的乳腺癌膜蛋白HER2, 从而诱导该癌细胞溶酶体降解及细胞凋亡.

Fig.6 Representative examples of framework nucleic acids for biomedical engineering and drug delivery(A) Schematic illustration of the FNA based n-simplexes and recruitment-binding induced EpCAM cluster on the cell membrane with increased binding affinity[93], Copyright 2019, American Chemical Society; (B) schematic illustration of the framework nucleic acids as drug carriers[94], Copyright 2020, Wiley-VCH.
4 总结与展望
随着DNA纳米技术的发展, 人们已经可以构建复杂、动态的框架核酸. 将具有纳米精度可控的形状及操控分子能力的框架核酸与基于脂质的生物膜体系组装, 可以构建具有诸多功能的仿生膜体系及新型材料, 并成为仿生膜的重要构建方式以及研究途径. 通过在框架核酸上修饰疏水基团和特异性适配体, 或调控溶液中离子浓度和种类, 可使亲水性高、带负电性的框架核酸稳定地嵌入在仿生膜中或吸附在仿生膜表面, 并发挥相应的仿生功能. 同时, 受天然膜蛋白的启发, 目前已开发出多功能的框架核酸仿生膜材料, 并在纳米技术、纳米医学、仿生学、细胞生物学和合成生物学等领域被广泛应用. 如, 构建膜上各组分有序排布的组装体系; 模仿离子通道控制分子递送; 模仿膜雕刻蛋白对细胞膜形状的调控等; 通过对碱基进行特定的修饰(如适配体等)实现细胞高效捕获、智能定向载药及癌症靶向治疗等. 由于框架核酸的结构与细胞膜上的天然蛋白质簇相似, 框架核酸可以作为细胞内外运输的人工门控部件, 用于调控细胞环境和调控细胞信号. 更重要的是, 将框架核酸与细胞膜结合将进一步推动人工细胞工程、细胞组装的进一步发展. 框架核酸在检测分析中仍然面临诸多挑战. 例如, 如何最大限度地减少体内核酸酶对框架核酸的降解, 以维持框架核酸在细胞及活体环境下的稳定性并减轻不必要的免疫反应, 是亟待解决的科学问题. 由于血清中的蛋白质(如白蛋白)可与两亲性框架核酸形成稳定的复合物[78], 从而阻止或破坏框架核酸的结构稳定性与功能, 因此另一个大的挑战是如何开发出新方法防止两亲性框架核酸与血清蛋白相互作用, 保持两亲性框架核酸在生物膜上的活性, 以扩大其在生物医学方面的应用. 同时, 利用框架核酸仿生膜进行天然膜蛋白之间的相互作用及动态变化过程等方面的研究有待进一步深入. 此外, 受天然膜机器丰富多样性的启发, 更精细的框架核酸结构具有与更复杂的脂质膜(如核膜)共同发挥作用的潜力. 因此, 需构建更多具有精细功能的框架核酸仿生膜来实时调控生命活动的运行, 深入推进框架核酸辅助的仿生膜系统在癌症靶向治疗和临床诊疗等领域中的应用.
