抑制微小染色体支持蛋白2的表达可增强卵巢癌对卡铂的敏感性
2020-07-13王书博谭文华
王书博,谭文华
(1.威海市妇女儿童医院,山东 威海 264200;2.哈尔滨医科大学附属第二医院,黑龙江 哈尔滨 150078)
卵巢癌是目前女性生殖系统肿瘤中死亡率最高的恶性肿瘤。据报道,2017年,世界上有22 240位女性罹患卵巢癌,14 080 例患者死于卵巢癌[1]。尽管检测技术及治疗手段不断更新,但晚期卵巢癌细胞对化疗耐药等因素导致的卵巢癌死亡率逐年增加。化疗耐药是当前治疗卵巢癌遇到的主要挑战,其耐药机制尚未完全明确。微小染色体支持蛋白2(MCM2)对调节DNA复制极为重要。在细胞周期的G1期,复制起点复合体诱导细胞进行有丝分裂,DNA复制因子1和MCM2组成了复制前复合物,为DNA复制做准备[2-3]。在细胞分裂S期,细胞周期激酶激活MCM2复合物,细胞开始复制。既往研究表明酵母的MCM2基因突变可导致染色体缺失、DNA破坏及基因重组[4]。有研究表明,MCM2表达下降可导致大鼠患淋巴瘤[5]。大量研究表明MCM2可促使癌细胞增殖,且可作为胃癌、乳腺癌、结肠癌判断预后的重要标志物,比起传统的肿瘤标志物如Ki67敏感性更高[6]。曾有研究报道,在高度恶性的肿瘤细胞中MCM2的表达要远高于低度恶性的癌细胞,且MCM2高表达与肿瘤分期晚、预后差明显相关[7]。本文旨在研究降低MCM2的表达是否可以增加卵巢癌细胞对卡铂的敏感性,从而延长患者的无进展生存期。报告如下。
1 材料与方法
1.1 材料
本实验用的卡铂注射液购于山东威海妇女儿童医院,A2780卵巢癌细胞株及239T细胞株购于中国科学研究委员会。
1.2 方法
1.2.1 细胞培养
A2780卵巢癌细胞株被置于含10%胎牛血清、1%青霉素链霉素溶液的培养基中;239T细胞被置于DMEM培养基进行细胞培养,孵育温度为37 ℃。
1.2.2 免疫印迹试验
应用免疫印迹试验(western blot)检测蛋白质的表达,采用不同一抗封闭细胞膜蛋白,接着用辣根过氧化物酶二抗进行孵育。使用化学成像发光仪观察免疫反应带。
1.2.3 细胞增殖试验
收集对数期细胞,调整浓度为每孔1×103个,将细胞种植于96孔板中,待细胞贴壁后加药,3.5% CO2,37 ℃孵育2 h。每孔中加入10 μL CCK-8溶液,培养1~4 h,取出96孔板,将其置于酶联免疫检测仪上,振荡15 s,然后在450 nm下测量吸光,结果进行统计分析。
1.2.4 细胞周期试验
取对数生长期的细胞,按4×105个/mL,以1 mL接种24孔板或2 mL接种于6孔板内,培养16~24 h。800 r/min离心5 min,收集细胞沉淀,弃上清,用预冷PBS洗涤两次,加入预冷75%乙醇,于4 ℃固定4 h以上。1 500 r/min离心5 min,弃上清,以3 mL的PBS洗涤一次,加入400 μL溴化乙啶(PI,50 μg/mL),100 μL RNase A(100 μg/mL),4 ℃避光孵育30 min。用流式细胞仪以标准程序检测,一般计数2~3万个细胞,结果用细胞周期拟和软件ModFit分析。
1.2.5 集落形成试验
收集对数期细胞,采用常规消化传代方法,制成细胞悬液。细胞悬液反复吹打,使细胞充分分散,单个细胞百分率应在95%以上。根据细胞增殖能力,将细胞悬液倍比稀释。一般按照每皿含50,100,200个细胞的浓度分别接种于5 mL细胞悬液到培养皿(直径60 mm)中,以十字方向轻轻晃动培养皿,使细胞分散均匀。培养皿置37 ℃,5%CO2中培养2~3周,中间根据培养液pH变化适时更换新鲜培养液。当培养皿中出现肉眼可见克隆时,终止培养,弃去培养液,PBS小心浸洗2次,空气干燥。甲醇固定15 min,弃甲醇后空气干燥。用Giemsa染液染色10 min,流水缓慢洗去染液,空气干燥。
1.3 统计学方法
2 结 果
2.1 逆转录病毒转染的人卵巢癌A2780细胞株
为了研究卵巢癌细胞中MCM2的表达,使用shRNA(短卡RNA)转染的卵巢癌细胞株中的MCM2 (shMCM2-1 and shMCM2-2)作为实验组,无shRNA转染的MCM2(shCON)作为对照组。使用western blot法检测A2780卵巢癌细胞株中MCM2的表达。与对照组相比,shMCM2-1及shMCM2-2蛋白表达分别下降了(50.6±4.0)%和(49.1±3.6)%(见图1)。

shMCM2-1,shMCM2-2为shRNA转染的MCM的表达,无shRNA转染的MCM2(shCON)作为对照组
图1Western blot法检测卵巢癌A2780细胞株中的MCM2的表达
2.2 下调MCM2的表达对A2780卵巢癌细胞增殖和细胞周期及细胞凋亡的影响
与对照组相比,下调MCM2的表达明显抑制A2780卵巢癌细胞株的增殖(见图2)。用流式细胞仪检测MCM2对细胞周期的调节,在4~5天时卵巢癌细胞增殖明显受到抑制。由图3可知shRNA转染的MCM2细胞中G1及G2期细胞的数量明显减少。研究结果表明抑制MCM2的表达可增加G1期卵巢癌细胞数量,减少G2期卵巢癌细胞数量。
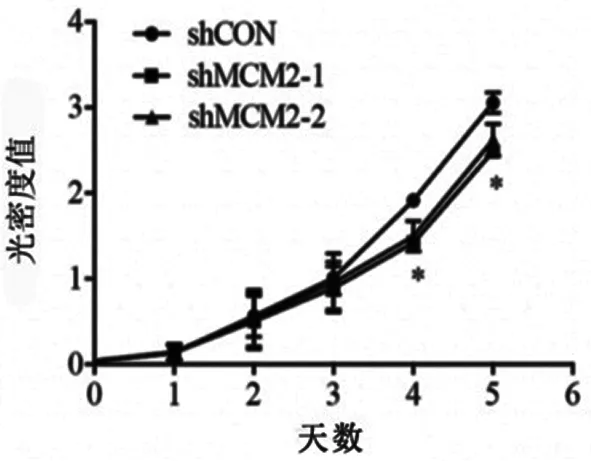
图2 shRNA转染卵巢癌细胞后MCM2的表达情况
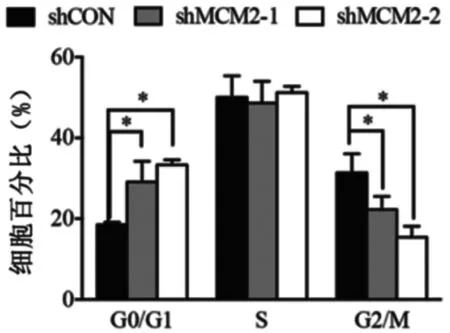
图3 流式细胞仪对不同细胞周期卵巢癌细胞数量的检测
2.3 下调MCM2的表达可增强卵巢癌细胞对卡铂的敏感性
使用集落形成试验检测下调MCM2的表达是否可增强卵巢癌细胞对卡铂化疗的敏感性。对照组细胞及MCM2表达下调的细胞均使用不同浓度的卡铂注射液进行处理。结果表明,使用不同浓度卡铂溶液(0,2.5,3.5,5.0和7.5 μg/mL)处理后的shMCM2及对照组MCM2集落形成数量明显减少(见图4)。
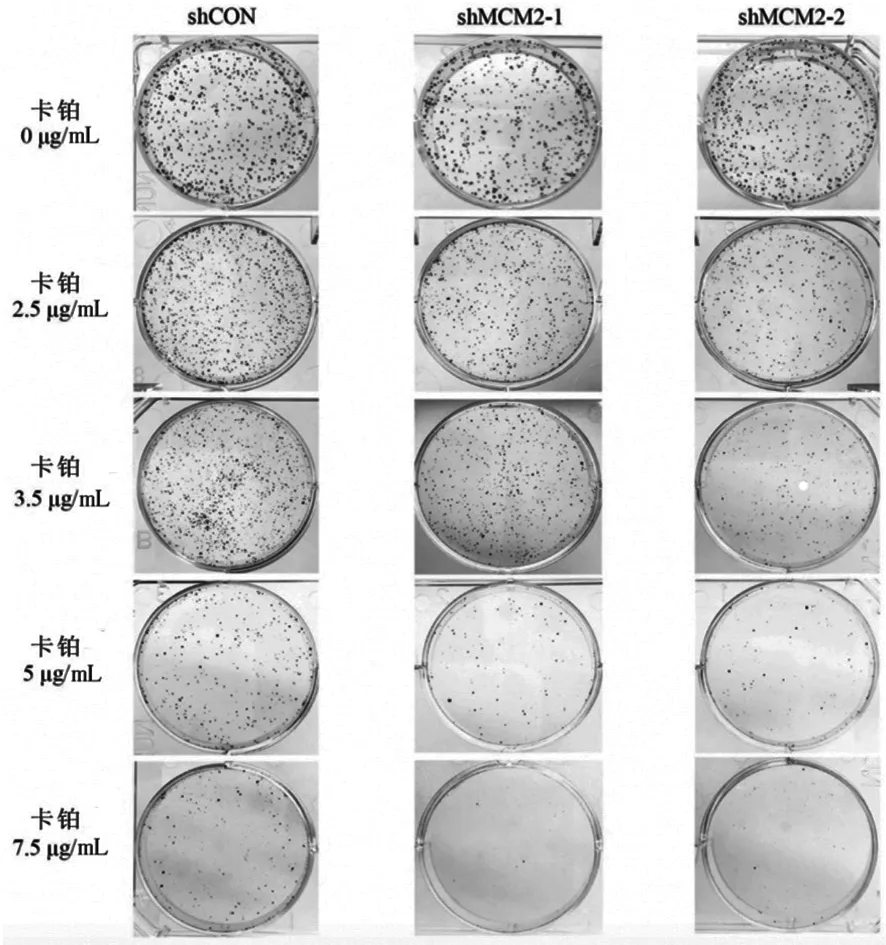
图4 使用不同浓度卡铂溶液处理后的shMCM2及对照组MCM2集落形成数量
3 讨 论
以卡铂为基础的化疗是治疗进展期卵巢癌标准的一线治疗方案,但化疗耐药是导致治疗失败的主要原因,所以逆转卡铂耐药是多学科治疗卵巢癌的焦点问题[8]。过去的研究表明顺铂耐药后的卵巢癌细胞株PE01CDDP中MCM2的表达比正常的PE01细胞中高两倍,因此研究人员推测MCM2可能与卵巢癌患者的化疗耐药有关[9]。微小染色体蛋白家族是DNA复制启动区域的重要因子,其在细胞分裂周期G1期与DNA结合,在S期被激活,参与DNA复制。据报道,MCM2/5活性区域作为ATP依赖的门户发挥作用,在各种类型的癌细胞中MCM2的表达显著增加,且被认为与肿瘤进展及预后差有关[10]。此外,MCM2表达增加与一项重要的细胞增殖标志物Ki67升高有关。过去的研究表明MCM2的表达对于维持染色体稳定性至关重要[7]。因此,本文旨在研究A2780卵巢癌细胞株中的MCM2表达下调对DNA复制的影响。目前的研究表明MCM2表达下调影响细胞的增殖及细胞周期,并未影响细胞凋亡[3]。研究资料表明A2780卵巢癌细胞株在接受卡铂化疗后,通过抑制MCM2的表达可提高其对卡铂的敏感性,从而抑制卵巢癌细胞的增殖。在有限的DNA复制条件下,细胞可能会需要更多的复制起始点来修复已被破坏的复制叉。这种假说可能是MCM2下调抑制DNA复制的原因。潜在大量的DNA复制起始点不仅能修复被破坏的DNA复制叉,同时对于维持染色体的稳定性至关重要,故下调MCM2的表达水平可大幅增加大鼠患癌症的概率[11]。此外,过去的研究表明DNA复制起始点的增加可以减少基因受损的概率[12-13]。
本研究表明下调MCM2的表达水平可增强A2780卵巢癌细胞株对卡铂化疗的敏感性,因此下调MCM2联合卡铂化疗会有效克服卵巢癌细胞的化疗耐药性,为进展期卵巢癌的治疗提供参考和新思路。
