T 淋巴细胞亚群、MMP 9、MMP 2在原发性肺癌中的表达及临床意义△
2020-07-13张辉吴秋歌张坤李立敬朱静静李艳娟王静
张辉,吴秋歌,张坤,李立敬,朱静静,李艳娟,王静
郑州大学第一附属医院呼吸与危重症医学科,郑州450000
原发性肺癌(primary lung cancer,PLC)是全球最常见的恶性肿瘤之一,发病率较高,非小细胞肺癌为其最常见的一种类型[1-2]。早期肺癌无典型症状,大部分患者就诊时已进展至中晚期或伴远处转移,失去了最佳治疗时机,预后差[3]。近年来,T淋巴细胞介导的细胞免疫在肿瘤发病过的程中起关键作用[4]。细胞免疫是机体拮抗肿瘤的关键免疫机制;T淋巴细胞是细胞免疫的重要效应细胞,其功能和数量发生异常时可能导致机体免疫调节功能紊乱,抗肿瘤能力降低,更易出现侵袭、转移[5]。基质金属蛋白酶(matrix metalloproteinase,MMP)是锌离子依赖性蛋白水解酶,参与细胞外基质(extracellular matrix,ECM)的降解过程[6]。肿瘤细胞与ECM的相互作用在肿瘤的发病及进展中起关键作用[7]。MMP2、MMP9过表达与多种恶性肿瘤的发生密切相关[8-9]。关于PLC发病过程中T淋巴细胞亚群、MMP2、MMP9水平变化与肿瘤恶性生物学行为的关系的报道较少。本研究通过对PLC患者的外周血淋巴细胞亚群及血清MMP2、MMP9水平进行检测,以期为PLC的诊疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年2月至2019年3月郑州大学第一附属医院收治的PLC患者。纳入标准:①经组织病理学检查确诊为肺癌;②未接受放疗、化疗、手术或靶向抗肿瘤治疗;③临床分期和组织学分型均依据国际肺癌研究协会制定的肺癌TNM分期标准(第8版)修订建议[10];④临床资料完整。排除标准:①合并其他恶性肿瘤;②合并重要脏器功能障碍;③合并全身系统性炎症性疾病;④合并急性、慢性感染;⑤合并血液系统疾病;⑥合并严重脑血管疾病;⑦合并严重精神类疾病;⑧合并自身免疫性疾病。根据纳入和排除标准,本研究共纳入89例PLC患者作为PLC组,其中,男58例,女31例;年龄32~79岁,平均(60.95±10.52)岁;病理类型:鳞癌56例,腺癌27例,小细胞癌6例。选取同期体检的30例健康者作为对照组,均经体检证实心、肝、肺、肾功能正常,其中,男19例,女11例;年龄30~78岁,平均(59.55±11.52)岁。
1.2 检测方法
PLC组患者于入院次日、对照组受试者于体检当日均采集外周空腹静脉血约5 ml,离心分离后低温保存待测。采用购自美国贝克曼库尔特公司的DxFLEX型流式细胞仪测定外周血中T淋巴细胞亚群水平,血样标本制成单细胞悬液(1×106/ml),恒温水浴速溶,离心沉淀,弃去枸橼酸缓冲液和上清,加入10 μl异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记鼠抗人单克隆抗体或藻红蛋白(phycoerythrin,PE)荧光素标记免疫球蛋白G(Immunoglobulin G,IgG)抗体,离心混匀,避光反应0.5 h,离心后弃上清,加入含牛血清白蛋白的磷酸盐缓冲液3 ml,离心混匀,弃上清,再次加入磷酸盐缓冲液2 ml,混匀后上流式细胞仪测定,计数细胞10 000个,以同型抗体作为阴性对照。采用酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)测定血清中MMP9、MMP2水平,ELISA试剂盒购自美国R&D公司,均严格按试剂使用说明操作,采用购自美国Thermo公司的多功能酶标仪读取各孔吸光度值,应用电脑自动计算血清MMP9、MMP2浓度。所有血液样本均检测1次,各试剂批内变异系数<5%,批间变异系数<13%,符合精密度要求。
1.3 观察指标
比较两组受试者外周血中的T淋巴细胞亚群CD3-CD19+、CD8+CD28+水平及血清中 MMP9、MMP2水平,分析上述指标在不同病理特征PLC患者中的表达差异;分析PLC患者外周血中T淋巴细胞亚群水平与血清中MMP9、MMP2水平的相关性;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析T淋巴细胞亚群、MMP9、MMP2水平对PLC发生远处转移的预测价值。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,多组间比较采用完全设计随机方差分析;计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher确切概率法;相关性分析采用Pearson直线相关分析法;采用ROC曲线分析T淋巴细胞亚群、MMP9、MMP2水平对PLC发生远处转移的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者外周血中 T淋巴细胞亚群及血清中MMP 9、MMP 2水平的比较
PLC组患者外周血中CD3-CD19+、CD8+CD28+水平均明显低于对照组受试者,血清中MMP9、MMP2水平均明显高于对照组受试者,差异均有统计学意义(P<0.01)。(表1)
表1 两组受试者外周血中 T淋巴细胞亚群及血清MMP 9、MMP 2水平的比较(±s)
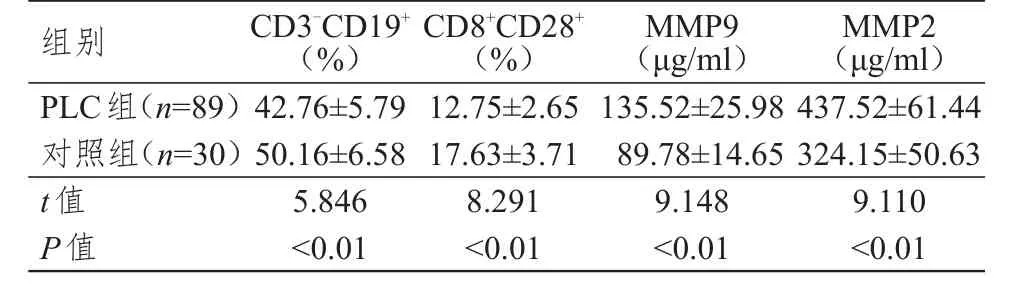
表1 两组受试者外周血中 T淋巴细胞亚群及血清MMP 9、MMP 2水平的比较(±s)
组别CD3-CD19+CD8+CD28+MMP9MMP2(%) (%) (μg/ml) (μg/ml)PLC组(n=89)42.76±5.7912.75±2.65135.52±25.98437.52±61.44对照组(n=30)50.16±6.5817.63±3.7189.78±14.65324.15±50.63 t值5.8468.2919.1489.110 P值 <0.01<0.01<0.01<0.01
2.2 不同病理特征PLC患者外周血中 T淋巴细胞亚群及血清中MMP 9、MMP 2水平的比较
不同病理类型PLC患者外周血中T淋巴细胞亚群及血清中MMP9、MMP2水平比较,差异均无统计学意义(P>0.05)。不同N分期PLC患者血清中的MMP9、MMP2水平比较,差异均无统计学意义(P>0.05)。Ⅲ~Ⅳ期、低分化、N1~3期、M1期的PLC患者外周血中CD3-CD19+水平均明显低于Ⅰ~Ⅱ期、中高分化、N0期、M0期的患者,差异均有统计学意义(t=4.732、5.446、4.174、5.023,P<0.01);Ⅲ~Ⅳ期、低分化、N1~3期、M1期的 PLC 患者外周血中CD8+CD28+水平均明显低于Ⅰ~Ⅱ期、中高分化、N0期、M0期的患者,差异均有统计学意义(t=6.759、6.077、4.456、7.408,P<0.01)。Ⅲ~Ⅳ期、低分化、M1期的PLC患者外周血中MMP9水平均明显高于Ⅰ~Ⅱ期、中高分化、M0期的患者,差异均有统计学意义(t=5.955、3.891、3.556,P<0.01);Ⅲ~Ⅳ期、低分化、M1期的PLC患者外周血中MMP2水平均明显高于Ⅰ~Ⅱ期、中高分化、M0期的患者,差异均有统计学意义(t=14.245、9.432、10.812,P<0.01)。(表2、表3)
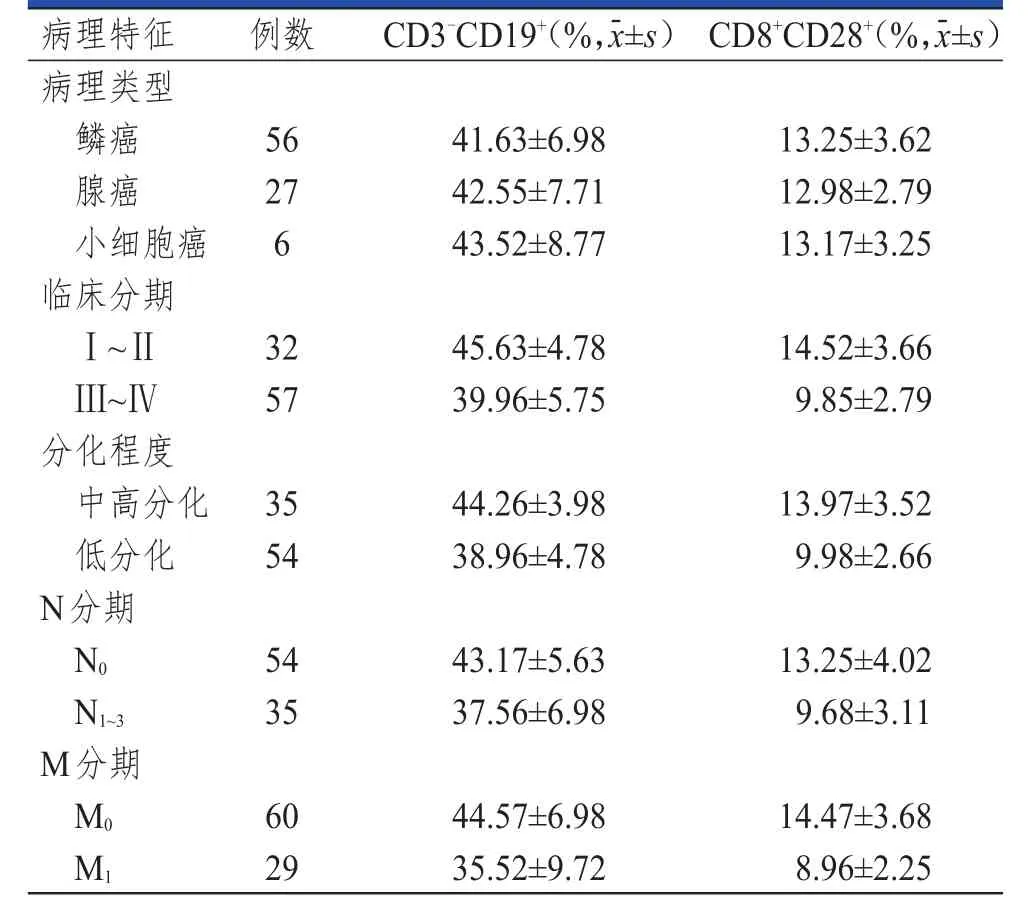
表2 89例不同病理特征PLC患者的外周血 T淋巴细胞亚群水平
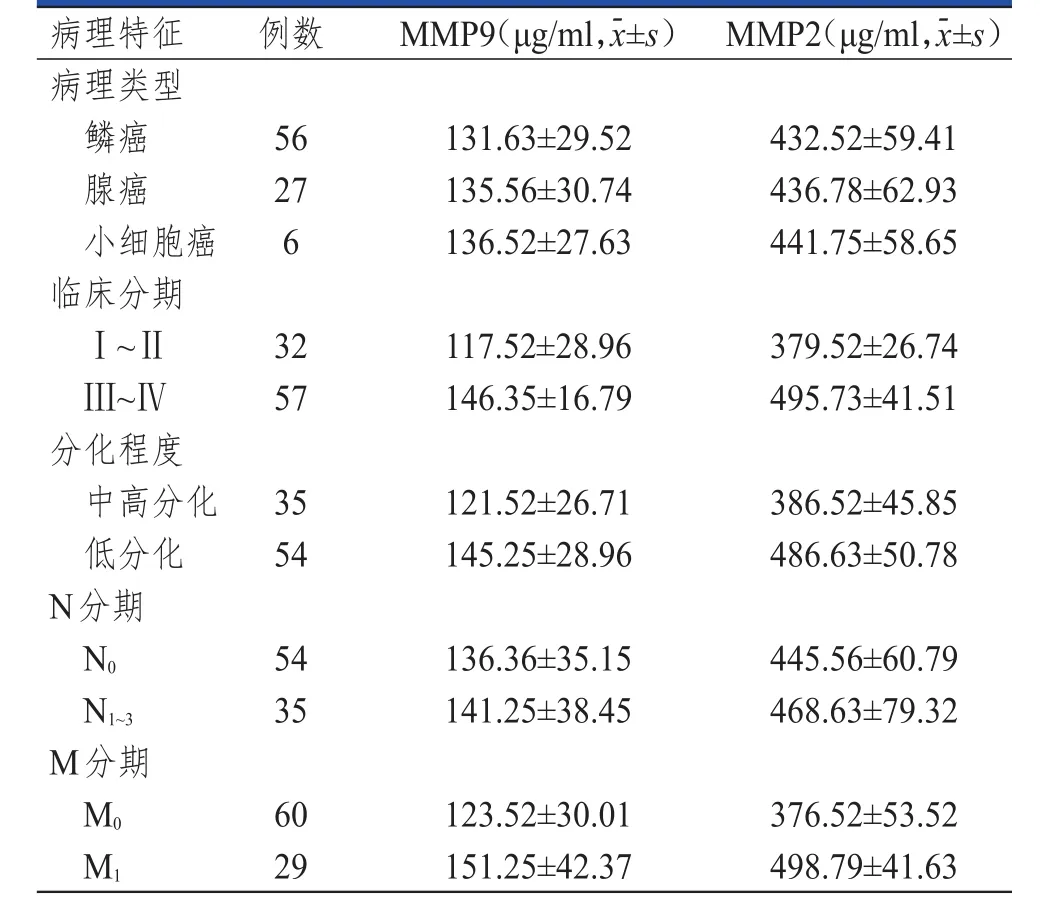
表389 例不同病理特征PLC患者的血清MMP 9、MMP 2水平
2.3 PLC患者外周血中 T淋巴细胞亚群与血清中MMP 9、MMP 2水平的相关性分析
相关性分析结果显示,PLC患者外周血中CD3-CD19+、CD8+CD28+水平与血清中 MMP9、MMP2水平均呈负相关(P<0.05)。(表4)

表4 89例PLC患者外周血 T淋巴细胞亚群与血清MMP 9、MMP 2水平的相关性分析
2.4 PLC患者外周血 T淋巴细胞亚群与MMP 9、MMP 2水平对PLC远处转移的预测价值
ROC曲线分析发现,MMP9水平对PLC发生远处转移的预测价值最高,约登指数最大时对应的cut-off值>143.14,曲线下面积(area under curve,AUC)为 0.93,灵敏度、特异度分别 为86.67%、88.14%;其次为CD3-CD19+,约登指数最大时对应的cut-off值<40.50,AUC为0.91,灵敏度、特异度分别为96.67%、81.36%。(表5)
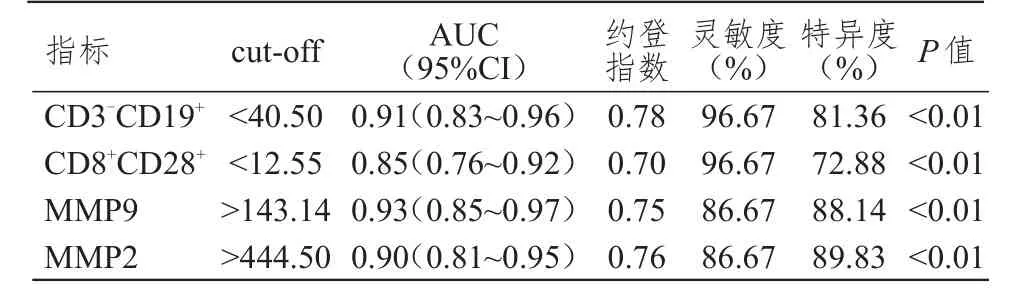
表5 89例PLC患者外周血 T淋巴细胞亚群与血清MMP 9、MMP 2水平对PLC远处转移的预测价值
3 讨论
T淋巴细胞是参与机体肿瘤免疫反应的重要细胞,已被证实其可调控机体的抗肿瘤免疫反应[11]。CD3抗原是成熟T淋巴细胞表面特异性抗原,表达于人T淋巴细胞表面,含多种肽链,可与T淋巴细胞识别抗原受体形成复合物,传递活化信号至T淋巴细胞内部[12]。CD19为分布于成熟B淋巴细胞表面的抗原,其与CD3抗原组成共同代表体内T淋巴细胞总数目[13]。CD8分子分布于杀伤性T淋巴细胞与抑制性T淋巴细胞表面,CD28位于外周成熟细胞毒性T细胞表面,CD8+和CD28+共同组合成细胞毒性T淋巴细胞亚群,调控肿瘤细胞免疫,主要通过与靶细胞结合释放大量细胞杀伤因子,促进肿瘤细胞坏死,并起到杀灭肿瘤细胞的作用[14]。研究发现,恶性肿瘤的发生、发展与细胞免疫功能低下密切相关[15-16]。T淋巴细胞亚群作为介导机体抗肿瘤免疫反应的关键细胞因子,可能能够作为肿瘤患者免疫系统紊乱研究的新靶点[17]。本研究发现,PLC 患者的CD3-CD19+、CD8+CD28+水平均明显低于健康者,提示PLC患者存在明显的细胞免疫低下的表现,且随着临床分期的上升、肿瘤分化程度的降低,CD3-CD19+、CD8+CD28+水平降低得更明显;同时发生远处转移的PLC患者的CD3-CD19+、CD8+CD28+水平明显低于未发生远处转移的患者,进一步提示PLC具有明显的免疫抑制的特点,且随着肿瘤恶性程度的增加,患者的免疫抑制特点更明显,推测免疫系统紊乱与PLC的发生、发展有关。进一步的ROC曲线分析结果发现,CD3-CD19+、CD8+CD28+对PLC发生远处转移均有较高的预测价值,可为监测PLC病情进展提供重要依据。
浸润、转移是恶性肿瘤典型的生物学特点,也是肿瘤致死的重要原因[18]。ECM降解是肿瘤浸润、转移的关键环节[19]。MMP9、MMP2均为明胶酶类分子,由可能存在恶性倾向的肿瘤细胞、巨噬细胞分泌,共同参与ECM降解过程,破坏基底膜完整性,在恶性肿瘤的血管化、肿瘤细胞的浸润及转移灶的形成过程中起重要作用[20-21];同时,MMP9、MMP2可促成肿瘤新生血管形成,导致血管局部基底膜降解,创造促血管生成微环境,促成肿瘤细胞的侵袭、转移[22]。本研究发现,PLC患者的血清MMP9、MMP2水平均明显高于对照组;Ⅲ~Ⅳ期、低分化、发生远处转移(M1期)的PLC患者的血清MMP9、MMP2水平均明显高于Ⅰ~Ⅱ期、中高分化、未发生远处转移(M0期)的患者,这与陈鹏等[23]和Zergoun等[24]的结论相同,证实MMP2、MMP9均与PLC的发生和发展有关。此外,本研究发现,外周血T淋巴细胞亚群与血清MMP9、MMP2水平对PLC是否发生远处转移均有较高的预测价值。另外,相关性分析发现,PLC患者的外周血CD3-CD19+、CD8+CD28+与血清MMP9、MMP2水平均呈负相关,推测外周T淋巴细胞亚群与MMP可能协同参与PLC发病、浸润、转移的过程。考虑其原因为在巨噬细胞、肺泡上皮细胞炎症浸润的刺激下,趋化因子、免疫细胞向肺组织浸润,加重肺部炎性反应,而炎症信号可激活肿瘤细胞及外周组织释放大量的MMP进入血液循环,通过正向反馈作用进一步促进炎症、趋化因子和免疫细胞的浸润,促使ECM降解,同时导致机体出现免疫耐受,更有利于肿瘤细胞的浸润、增殖和迁移,导致肿瘤恶性表型发生转化[25]。
综上所述,外周血T淋巴细胞亚群、MMP9、MMP2可能协同参与PLC的发病及进展,其水平与PLC患者的临床分期、分化程度、远处转移情况密切相关,可作为预测PLC是否发生远处转移的重要依据。但是,本研究为回顾性分析,存在一定的局限性,且观察时间短,样本量少,尚未分析以上因子对PLC预后的影响,且尚未研究PLC患者MMP组织抑制因子-1的表达情况及其与以上因子的关系,有待扩充样本量、延长随访时间进一步研究。
