AMACR在前列腺癌中的表达及沉默AMACR基因对前列腺癌DU145细胞增殖凋亡的影响
2020-07-13李华华岳姣姣牛虹唐静雯岳光星
李华华,岳姣姣,牛虹,唐静雯,岳光星
1郑州大学附属肿瘤医院(河南省肿瘤医院)中西医结合科,郑州450003
2河南中医药大学第三附属医院脑病科,郑州450003
前列腺癌是老年男性的易发疾病,且转移率较高,肥胖、高脂饮食以及雄激素水平异常是该疾病的高危因素[1-2]。多类原癌基因和抑癌基因表达已在前列腺癌的侵袭转移中发挥重要的预测作用[3]。α-甲基酰基辅酶A消旋酶(alpha-methylacyl-CoAracemase,AMACR)可参与支链脂肪酸的β-氧化过程[4]。目前认为AMACR是前列腺癌形成的早期事件[5],但其是否参与前列腺癌增殖分化等生物学进程,有待进一步研究。本研究首先采用免疫组化法对前列腺癌组织中AMACR的表达进行检测,探究其与患者临床特征的关系,并进一步判断AMACR基因在前列腺癌生物学行为中的预测作用,以期阐述该基因在前列腺癌细胞增殖凋亡中的作用机制,从而为临床诊治和预后预测提供参考指标,现报道如下。
1 资料与方法
1.1 一般资料
收集2014年3月至2016年3月郑州大学附属肿瘤医院收治的前列腺癌患者的病历资料。纳入标准:均经过诊断确诊为前列腺癌,诊断符合中国前列腺癌诊断治疗指南中的诊断标准。排除标准:①术前接受过任何治疗(如手术、放化疗、内分泌治疗等);②存在继发性恶性肿瘤;③严重机能障碍。根据纳入、排除标准,共纳入55例前列腺癌患者,所有患者均为男性,年龄52~72岁,平均年龄(58.46±8.50)岁,取55例患者经手术切除或穿刺活检采集的前列腺癌组织。同时,选取同期在郑州大学附属肿瘤医院行经膀胱前列腺摘除手术的32例良性前列腺增生症患者,年龄49~73岁,平均(62.12±9.03)岁,取32例患者的良性前列腺增生组织作为对照。所有采集组织均经10%中性甲醛溶液固定,并石蜡包埋,4 μm连续切片,供后续研究。
1.2 主要试剂和仪器
AMACR免疫组化单克隆抗体购自福建迈新生物技术公司;RPMI-1640购自武汉普诺赛生命科技有限公司;Lipofectamine2000和Trizol试剂盒均购自美国Invitrogen公司;PrimescriptTMRT Reagent Kit逆转录试剂盒和SYBR®Premix Ex TaqTMⅡ试剂盒均购自日本TaKaRa公司;ABI PRISM®7300系统购自美国ABI公司;RIPA试剂盒购自北京索莱宝科技有限公司;Western blot抗体购自英国Abcam公司;CCK-8溶液购自上海申实生物科技有限公司;膜联蛋白V(Annexin V)细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;质粒均购自于南京恩晶有限公司;流式细胞仪购自美国Coulter Electronics公司。
1.3 免疫组化检测
采用免疫组织化学链酶菌抗生素蛋白-过氧化物酶法(streptavidin-perosidase,SP)[6]检测前列腺癌组织和良性前列腺增生组织中AMACR的表达。将采集标本以10%中性甲醛溶液固定,常规石蜡包埋;常规脱蜡后梯度酒精脱水,微波抗原热修复,并滴加3%山羊血清室温封闭;滴加AMACR一抗,4℃孵育过夜;磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗后加入适量山羊抗鼠或山羊抗兔的二抗工作液;PBS冲洗3次×5 min,二氨基联苯胺(diaminobenzidine,DAB)显色 3~5 min,自来水充分冲洗。以已知阳性的前列腺癌切片为阳性对照,以PBS代替一抗为阴性对照。AMACR阳性表达呈棕黄色颗粒,无着色为阴性表达。
1.4 细胞培养与分组转染
将前列腺癌细胞株DU145接种于培养基中,培养在37℃、5%CO2饱和湿度恒温箱中备用。培养基由10%胎牛血清、RPMI-1640培养基、青链霉素组成。每隔24~48 h更换培养基,0.25%胰酶消化、传代。选取对数生长期的细胞进行实验,将细胞分为:Blank组、pcDNA-AMACR组(转染AMACR过表达质粒)、pcDNA-AMACR NC组(转染AMACR过表达NC质粒)、siRNA-AMACR组(转染siRNA-AMACR质粒)、siRNA-AMACR NC组(转染siRNA-AMACR NC质粒)。转染前24 h将细胞接种于6孔板中,待细胞融合度达50%~80%时,在脂质体Lipofectamine2000的介导下瞬时转染前列腺癌细胞,转染6 h换液,培养48 h后收集细胞用于后续实验。
1.5 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction ,qRT-PCR)检测转染后各组细胞中相关mRNA表达水平
采用Trizol法提取细胞总RNA,测定RNA的浓度和纯度。按照PrimescriptTMRT Reagent Kit逆转录试剂盒说明书将样品RNA反转录为cDNA,总体系25 μl。将反转录获得的cDNA中加入DEPC水稀释,并充分混匀。取cDNA进行荧光定量PCR,参照SYBR®Premix Ex TaqTMⅡ试剂盒说明书进行荧光定量PCR操作。采用ABI PRISM®7300系统进行荧光定量PCR。检测AMACR、核因子-kappa B抑制蛋白(inhibitor of nuclear factor kappa B,IκBα)、核因子κB(nuclear factor of kappa B,NF-κB)、Ki-67、B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)、B细胞淋巴瘤-2相关X蛋白(Bcl-2-associated X protein,BAX)mRNA表达水平。引物内参为GAPDH。2-ΔΔCt表示实验组与对照组目的基因表达的倍比关系。实验重复3次,取均值。
1.6 Western blot检测转染后各组细胞中相关蛋白表达水平
转染48 h后,使用总蛋白提取液RIPA试剂盒提取细胞总蛋白,用二喹啉甲酸(bicinchoninic acid,BCA)方法测定蛋白浓度。根据不同浓度进行定量,采用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacryl amide gel electrophoresis,SDS-PAGE)分离蛋白后通过电转移将蛋白转至硝酸纤维素膜上,5%脱脂奶粉(TBS溶解)室温下封闭1 h后滴加稀释的一抗,GAPDH为参照。二抗为HRP标记的山羊抗兔IgG抗体。将膜浸入电化学发光(electrochemiluminescence,ECL)液中发光,在暗室显影后观察结果并拍照。检测转染后各组细胞中AMACR、IκBα、NF-κB、Ki-67、Bcl-2、BAX蛋白表达水平。实验重复3次,取均值。
1.7 CCK-8法检测各组细胞转染后增殖能力
常规消化离心收集细胞,新鲜培养液重悬计数,并接种于96孔板,每孔200 μl。为防止蒸发,96孔板外圈滴加无菌生理盐水封边,同时对照孔用空白培养液进行设置。将96孔板放入37℃培养箱过夜,观察细胞贴壁融合情况。将贴壁融合细胞继续培养48 h,随后每孔加入20 μl CCK-8溶液。经1 h孵育后,采用预热酶标仪测量并记录各孔在450 nm处的吸光度值。实验重复3次,取均值。
1.8 流式细胞仪检测各组细胞转染后凋亡情况
按照Annexin V细胞凋亡检测试剂盒说明书进行操作。离心收集细胞,PBS洗3次,再次离心弃上清,细胞重悬于150 μl Binding Buffer中,加入10 μl Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和 5 μl碘化丙啶(propidium iodide,PI),轻轻混匀,避光室温反应15 min,再加入150 μl Binding Buffer。采用流式细胞仪测定,结果以细胞凋亡率表示。实验重复3次,取均值。
1.9 统计学分析
采用SPSS 21.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,两组比较采用t检验,多组比较采用单因素方差分析和重复测量方差分析,多组间两两比较采用q检验;计数资料以例数及率(%)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌组织和良性前列腺增生组织中AMACR表达情况的比较
前列腺癌组织中AMACR的阳性表达率为74.55%(41/55),明显高于良性前列腺增生组织的31.25%(10/32),差异有统计学意义(χ2=15.633,P=0.000)。(图1)
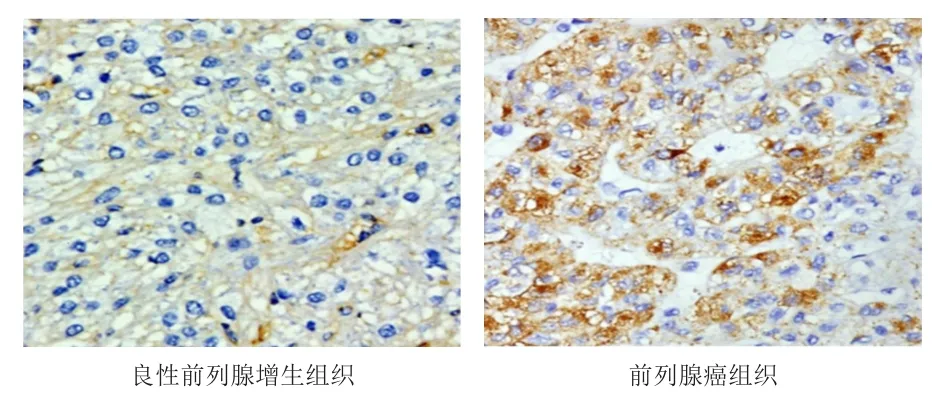
图1 前列腺癌组织和良性前列腺增生组织中AMACR的表达情况(免疫组化染色,×200)
2.2 不同临床特征的前列腺癌患者的前列腺癌组织中AMACR表达情况的比较
不同年龄的前列腺癌患者的前列腺癌组织中AMACR表达情况比较,差异无统计学意义(P>0.05);不同TNM分期、病理分级(Gleason分级)、肿瘤分期、术前列腺特异性抗原(prostate specific antigen,PSA)水平及有无远处转移的前列腺癌患者的前列腺癌组织中AMACR表达情况比较,差异均有统计学意义(P<0.05)。(表1)

表1 不同临床特征的前列腺癌患者的前列腺癌组织中AMACR表达情况的比较( n=55)
2.3 各组细胞转染后相关基因mRNA表达情况的比较
Blank组、pcDNA-AMACR NC组和siRNAAMACR NC组AMACR、IκBα、NF-κB、Ki-67、BAX、Bcl-2的mRNA表达水平比较,差异均无统计学意义(P>0.05)。与pcDNA-AMACR NC组相比,pcDNA-AMACR 组AMACR、IκBα、NF-κB、Ki-67、Bcl-2的mRNA表达水平均上升,BAX mRNA表达水平下降(P<0.05)。与siRNA-AMACR NC组相比,siRNA-AMACR组的AMACR、IκBα、NF-κB、Ki-67、Bcl-2的mRNA表达水平均下降,BAXmRNA表达水平上升(P<0.05)。(表2)
表2 各组细胞转染后相关基因mRNA表达情况的比较(±s)

表2 各组细胞转染后相关基因mRNA表达情况的比较(±s)
注:a与pcDNA-AMACR NC组比较,P<0.05;b与siRNA-AMACR NC组比较,P<0.05
组别Blank组pcDNA-AMACR NC组pcDNA-AMACR组siRNA-AMACR NC组siRNA-AMACR组F值P值AMACR 1.00±0.03 0.99±0.01 1.99±0.08a 0.94±0.03 0.51±0.03b 483.8<0.01 IκBα 1.03±0.06 1.00±0.06 2.34±0.06a 1.01±0.05 0.60±0.04b 444.1<0.01 NF-κB 0.99±0.06 1.04±0.04 2.16±0.08a 1.01±0.04 0.73±0.05b 325.5<0.01 Ki-67 1.02±0.06 1.03±0.05 1.32±0.08a 0.98±0.02 0.54±0.06b 71.2<0.01 BAX 1.02±0.04 0.96±0.06 0.36±0.04a 0.98±0.03 1.47±0.08b 166.0<0.01 Bcl-2 0.98±0.05 1.02±0.04 1.65±0.08a 1.05±0.05 0.47±0.04b 180.0<0.01
2.4 各组细胞转染后相关蛋白表达情况的比较
Blank组、pcDNA-AMACR NC组和siRNAAMACR NC组 AMACR、IκBα、NF-κB、Ki-67、BAX、Bcl-2蛋白表达水平比较,差异均无统计学意义(P>0.05)。与pcDNA-AMACR NC组相比,pcDNA-AMACR 组 AMACR、IκBα、NF-κB、Ki-67、Bcl-2蛋白表达水平均上升,BAX表达水平下降(P<0.05)。与siRNA-AMACR NC组相比,siRNAAMACR组AMACR、IκBα、NF-κB、Ki-67、Bcl-2蛋白表达水平均下降,BAX表达水平上升(P<0.05)。(表3)
表3 各组细胞转染后相关蛋白表达情况的比较(±s)
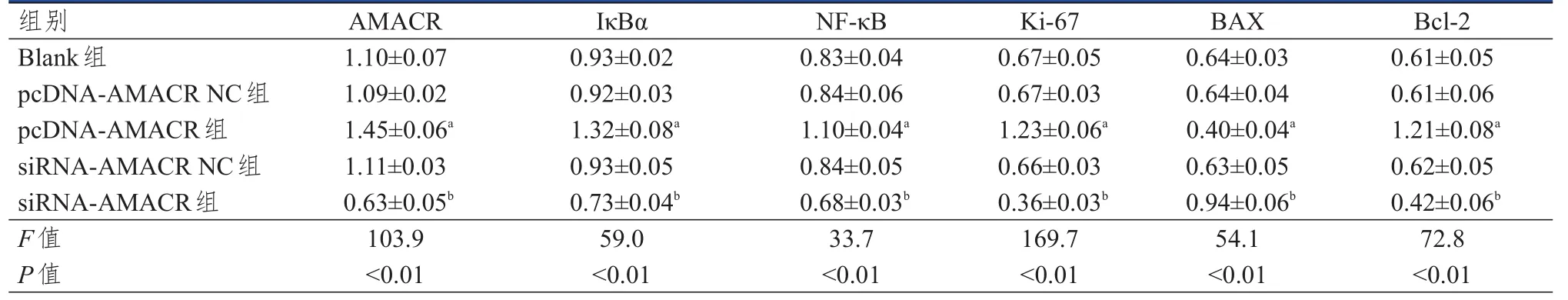
表3 各组细胞转染后相关蛋白表达情况的比较(±s)
注:a与pcDNA-AMACR NC组比较,P<0.05;b与siRNA-AMACR NC组比较,P<0.05
组别Blank组pcDNA-AMACR NC组pcDNA-AMACR组siRNA-AMACR NC组siRNA-AMACR组F值P值AMACR 1.10±0.07 1.09±0.02 1.45±0.06a 1.11±0.03 0.63±0.05b 103.9<0.01 IκBα 0.93±0.02 0.92±0.03 1.32±0.08a 0.93±0.05 0.73±0.04b 59.0<0.01 NF-κB 0.83±0.04 0.84±0.06 1.10±0.04a 0.84±0.05 0.68±0.03b 33.7<0.01 Ki-67 0.67±0.05 0.67±0.03 1.23±0.06a 0.66±0.03 0.36±0.03b 169.7<0.01 BAX 0.64±0.03 0.64±0.04 0.40±0.04a 0.63±0.05 0.94±0.06b 54.1<0.01 Bcl-2 0.61±0.05 0.61±0.06 1.21±0.08a 0.62±0.05 0.42±0.06b 72.8<0.01
2.5 各组细胞增殖能力的比较
24 h时各组细胞吸光度值比较,差异无统计学意义(P>0.05)。48、72、96 h时,Blank组、pcDNAAMACR NC组和siRNA-AMACR NC组吸光度值比较,差异均无统计学意义(P>0.05);与pcDNAAMACR NC组相比,pcDNA-AMACR组细胞吸光度值均上升(P<0.05);与siRNA-AMACR NC组相比,siRNA-AMACR组细胞吸光度值均下降(P<0.05)。(表 4)
2.6 各组细胞凋亡情况的比较
Blank组、pcDNA-AMACR NC组和siRNAAMACR NC组细胞凋亡率比较,差异无统计学意义(P>0.05)。与pcDNA-AMACR NC组相比,pcDNA-AMACR组细胞凋亡率下降(P<0.05)。与siRNA-AMACR NC组相比,siRNA-AMACR组细胞凋亡率上升(P<0.05)。(图2、表5)
3 讨论
随着分子生物学研究的深入,基因治疗在肿瘤治疗中逐渐普遍应用。前列腺癌的基因治疗通常基于如下途径:沉默促癌基因功能或修复抑癌基因功能的矫正性基因治疗[7];提高机体免疫力的肿瘤免疫性基因治疗[8]、自杀性基因治疗[9]等。基因治疗已在众多实验研究中取得一定进展,但其临床应用尚存在较多局限。在沉默促癌基因功能研究中,RNA干扰技术媲美基因敲除,可特异性、高效持久地实现对特定基因表达的干扰,因而已成为前列腺癌基因研究中的常见工具。例如,Xu等[10]就在前列腺癌PC3细胞系研究中发现采用shRNA靶向IgG基因能显著提高PC3细胞对放疗的敏感性,解释以IgG基因为靶点的干扰RNA联合放疗在治疗前列腺癌中的有效性。Yang等[11]报道Ezrin在前列腺癌组织中高度表达,Ezrin基因沉默导致E-钙黏蛋白水平上调,N-钙黏蛋白水平下调,从而抑制前列腺癌PC3细胞的增殖和侵袭。基于既往研究支持和本实验验证,证实干扰AMACR基因表达在前列腺癌基因治疗中的潜在价值。
表4 各组细胞吸光度值的比较(±s)
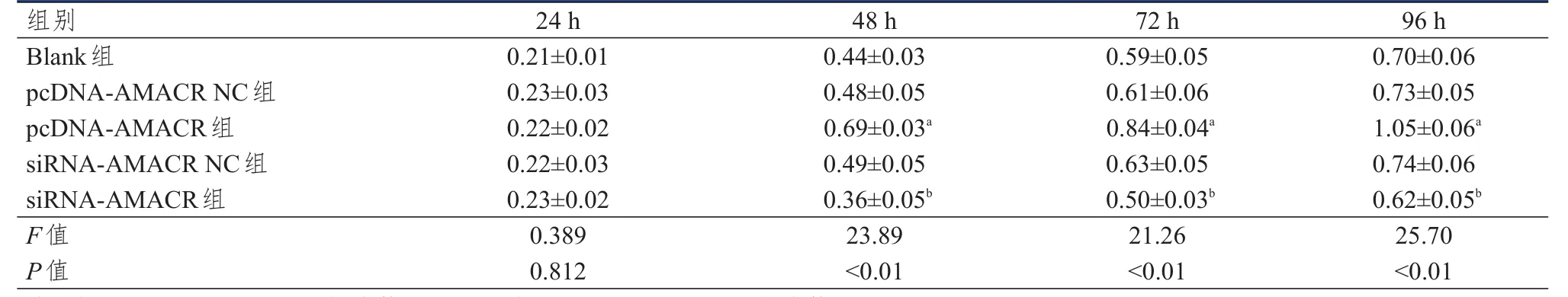
表4 各组细胞吸光度值的比较(±s)
注:a与pcDNA-AMACR NC组比较,P<0.05;b与siRNA-AMACR NC组比较,P<0.05
组别Blank组pcDNA-AMACR NC组pcDNA-AMACR组siRNA-AMACR NC组siRNA-AMACR组F值P值24 h 0.21±0.01 0.23±0.03 0.22±0.02 0.22±0.03 0.23±0.02 0.389 0.812 48 h 0.44±0.03 0.48±0.05 0.69±0.03a 0.49±0.05 0.36±0.05b 23.89<0.01 72 h 0.59±0.05 0.61±0.06 0.84±0.04a 0.63±0.05 0.50±0.03b 21.26<0.01 96 h 0.70±0.06 0.73±0.05 1.05±0.06a 0.74±0.06 0.62±0.05b 25.70<0.01

图2 流式细胞术检测各组细胞凋亡情况
表5 各组细胞凋亡率的比较(±s)

表5 各组细胞凋亡率的比较(±s)
注:a与pcDNA-AMACR NC组比较,P<0.05;b与siRNA-AMACR NC组比较,P<0.05
组别Blank组pcDNA-AMACR NC组pcDNA-AMACR组siRNA-AMACR NC组siRNA-AMACR组F值P值细胞凋亡率(%)9.01±0.55 8.93±0.60 6.02±0.43a 8.97±0.56 15.67±0.78b 107.6<0.01
AMACR在支链氨基酸的氧化和衍生过程中作用显著,其已部分应用于临床前列腺癌诊断中[12]。本研究首先采用免疫组化验证AMACR在前列腺癌患者中的表达并揭示其与患者临床特征的关系,提示AMACR表达与前列腺癌患者TNM分期、淋巴结转移、病理分级、肿瘤分期和术前PSA水平有关。该结果为后文AMACR与前列腺癌细胞生物学特性探究奠定一定基础。本实验通过AMACR过表达和沉默表达质粒转染,观察pcDNAAMACR和siRNA-AMACR对体外培养的DU145细胞相关因子表达的影响,以及对细胞增殖及凋亡的作用。由于pcDNA-AMACR和siRNA-AMACR本身可能会产生一定的细胞增殖促进或抑制作用,其可能会影响结果的判断和理解,因此,本实验同时设立pcDNA-AMACR NC组和siRNAAMACR NC组作为阴性对照,提高实验结果的可信度。本实验结果发现:与pcDNA-AMACR NC组相比,pcDNA-AMACR组 AMACR、IκBα、NF-κB、Ki-67、Bcl-2蛋白和mRNA表达水平均上升,BAX蛋白和mRNA表达水平均下降,细胞增殖能力上升,细胞凋亡率降低。同时,与siRNA-AMACR NC组相比,siRNA-AMACR组AMACR、IκBα、NF-κB、Ki-67、Bcl-2蛋白和mRNA表达水平均降低,BAX蛋白和mRNA表达水平均上升,细胞增殖能力降低,细胞凋亡率升高。具体分析可知,通过qRTPCR和Western blot检测发现,pcDNA-AMACR转染的AMACR促表达处理导致AMACR表达上调,以及NF-κB 信号通路相关因子 IκBα和 NF-κB[13]、细胞增殖标志物Ki-67[14]、抑制细胞凋亡因子Bcl-2的表达呈上调趋势,而抑制促凋亡因子BAX[15]的表达水平;反之,siRNA-AMACR转染的AMACR抑制表达处理导致AMACR表达下调,并抑制IκBα、NF-κB、Ki-67、Bcl-2表达水平,而促进BAX的表达。推测调控AMACR基因表达可通过调节NF-κB信号通路的激活,进而对前列腺癌细胞增殖和凋亡产生影响。鉴于此,本实验进一步采用CCK-8法和流式细胞术验证上述推测,揭示上调AMACR基因表达可促进细胞增殖,降低细胞凋亡,而下调AMACR基因表达则可抑制细胞增殖,促进细胞凋亡。
综上所述,本实验通过沉默AMACR基因,抑制IκBα、NF-κB、Ki-67、Bcl-2表达水平,促进BAX表达,进而抑制NF-κB信号通路的激活,从而抑制前列腺癌细胞增殖并诱导细胞凋亡。本实验为AMACR基因作为前列腺癌诊疗的一种特异性肿瘤标志物提供了一定的实验参考。
