胆绿素还原酶在抗肿瘤治疗中作用的研究进展△
2020-07-13周阳刘慧张华朱大岭刘芳
周阳,刘慧,张华,朱大岭,刘芳#
1哈尔滨医科大学附属肿瘤医院呼吸内科三病区,哈尔滨150081
2秦皇岛市卫生学校教务科,河北 秦皇岛066000
3哈尔滨医科大学大庆校区中心实验室,黑龙江大庆163319
二十世纪60年代,作为一种将胆绿素转化为胆红素的关键酶,胆绿素还原酶(biliverdin reductase,BVR)首次被发现。BVR最初仅被认为在血红素的代谢过程中发挥作用,但随着研究的不断深入,人们发现其在肾癌、食管癌和肺癌等多种肿瘤的细胞中过表达,且其表达具有明显的组织特异性,与肿瘤的发生、发展的关系密切。此外,BVR在肿瘤细胞上皮间质转化(epithelial-mesenchymal transition,EMT)的过程中亦发挥着重要作用,从而参与肿瘤细胞的转移。虽然BVR调控肿瘤的机制目前已取得一些初步的研究结果,但尚不为人所知。本文系统阐述了BVR与肿瘤的关系、调控肿瘤的具体机制、在细胞内外转运物质的机制、在细胞内发挥抗氧化功能的特性以及作为转录因子调控蛋白质合成的机制,旨在为肿瘤发生、发展机制的研究提供新的思路,为临床抗肿瘤治疗提供潜在靶点。
1 BVR的结构和功能
BVR是一种烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)依赖酶,在NADPH存在的情况下,可以将胆绿素还原成胆红素[1]。巯基(sulfhydryl group,SH)是BVR酶功能存在的基础,作为一种相对少有的双重特异性蛋白激酶,BVR既能使丝氨酸/苏氨酸磷酸化,又能使酪氨酸磷酸化,因此,其成为蛋白质磷酸化的关键酶[2]。BVR具有特征性的功能结构,包括亮氨酸拉链DNA序列、核定位序列和核输出序列。受刺激后,BVR能进入细胞核或细胞质膜,与启动子同源序列绑定,发挥核转录因子的作用,在转录水平调控基因的表达[3-4]。这些大数量的多功能序列结构使BVR成为功能信号转录途径中的重要调节因子。此外,BVR具有2个酪氨酸激酶Src同源区2(Src homology 2,SH2)结构域,SH2结构域介导的蛋白结合在多种酪氨酸激酶始动的细胞增殖信号中发挥着重要作用。Src家族同源结构域正逐渐成为新的抗肿瘤治疗靶点[4]。BVR主要通过以下3种方式对肿瘤细胞发挥调节作用:①作为还原酶;②作为双特异性激酶;③作为碱性区-亮氨酸拉链(basic region-leucine zipper,bZIP)型转录因子。因此,基于BVR的多种作用途径及其蛋白质多重结构的特征,其与整个细胞信号级联网络的关系密切。
2 BVR与肿瘤的关系
在多种酶和细胞因子的作用下,异常细胞信号通路的转导和激活是肿瘤发生、发展的分子基础。早在1999年,Maines等[5]首先采用免疫荧光等方法发现BVR在肾癌细胞中过表达,活化后的BVR定位于细胞核,调控细胞周期相关基因的的异常表达。随后,Zhang等[6]发现人胆绿素还原酶(human biliverdin reductase,hBVR)在食管鳞状细胞癌组织中呈高表达,并通过蛋白质组学等方法证实BVR可作为食管鳞状细胞癌的肿瘤标志物。此外,Hellman等[7]利用患者的新鲜组织标本,采用二维凝胶电泳和MALDI-TOF质谱技术分析证明BVR可作为联合诊断阴道癌的有效分子标志物,尤其对于早期宫颈癌的的筛查有重要意义。这些研究进一步验证了BVR在恶性肿瘤发生、发展中的重要地位。
近年来,研究发现,BVR在肿瘤的转移中发挥重要作用,在一定因素下可促进肿瘤细胞发生EMT。EMT以上皮细胞失去极性获得间叶细胞样细胞形态和功能为特征,是肿瘤转移的基础[8]。2008年有研究首先发现BVR通过磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,也称AKT)信号转导通路介导了低氧诱导的肾小管上皮细胞EMT,是导致慢性肾纤维化从而发生肾功能衰竭的主要原因[9]。随后,朱大岭教授课题组发现BVR在乳腺癌组织中的表达水平明显高于正常组织,BVR通过调控细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)信号通路诱导乳腺癌细胞发生EMT[10]。此外,在肺癌方面,该课题组采用免疫组化、免疫荧光、蛋白质印迹法(Western-blot,WB)和si-hBVR等方法证明了BVR能够介导肝细胞生长因子(hepatocyte growth factor,HGF)诱导的非小细胞肺癌细胞的EMT[11]。hBVR在肝癌和皮肤癌等恶性肿瘤中均过表达,且与患者的分期和预后有关,但在少数肿瘤中无表达[12],说明BVR在肿瘤组织中的表达具有明显组织特异性。
3 BVR调控肿瘤的机制
3.1 BVR调节肿瘤相关信号通路
3.1.1 MAPK信号通路 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在调控肿瘤细胞的代谢、增殖、运动、分化和凋亡过程中发挥重要作用,是促进多种恶性肿瘤发生、发展的经典通路[13]。它是一个从迅速加速纤维肉瘤蛋白(rapidly accelerated fibrosarcoma,RAF)到丝裂原活化的胞外信号调节激酶(mitogen-activated extracellular signal regulated kinase,MEK)再到MAPK的核心级联反应。ERK是MAPK家族的主要亚族,包括ERK1和ERK2两个亚型,是将信号从细胞膜传导至细胞核的关键。研究表明,hBVR对ERK的激活具有重要意义(图1a)。胰岛素样生长因子(insulinlike growth factor,IGF)-1作为IGF/MAPK通路中的配体可以激活ERK[4]。hBVR是ERK的底物,在BVR过表达的情况下,ERK可以与之形成复合物,并发挥双向转运体的功能。当信号通路处于静止状态时,ERK固定于细胞质中;一旦ERK被磷酸化,hBVR可将其转运入细胞核[4]。此外,在细胞核中,hBVR还可使ERK1/2与转录激活因子ETS样蛋白1(ETS-like 1,ELK-1)接近,磷酸化并激活ELK-1,调控肿瘤细胞的增殖、分化、凋亡等生物学行为[14]。
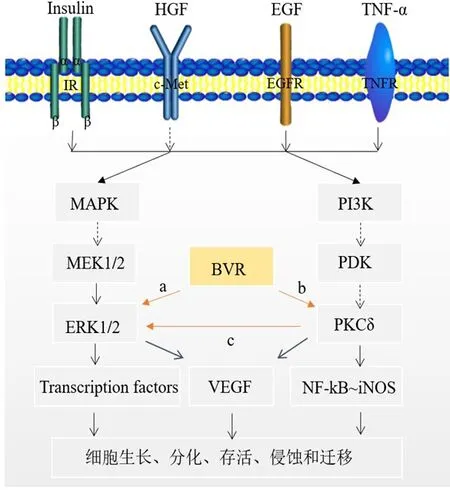
图1 BVR调控肿瘤相关信号通路示意图
3.1.2 PI 3K/AKT信号通路PI3K/AKT信号通路是影响肿瘤发生、发展的经典信号通路之一[15]。PI3K家族包括许多脂质激酶,由一个调节亚基(p85)和一个催化亚基(p110)组成。AKT是PI3K重要的下游分子,对于调控PI3K/AKT信号通路具有重要作用[16]。BVR可与PI3K-p85相互作用,促进AKT信号转导和白细胞介素-10(interleukin-10,IL-10)的产生[17]。BVR结构中存在两个SH2结合位点,包括Y198MKM和Y228LSF,它们是调控PI3K/AKT通路的关键结合位点。其中,Y198MKM是PI3K调控亚基p85的理想结合位点,而Y228LSF与BVR蛋白质酪氨酸磷酸化功能的发挥关系密切[18]。此外,BVR作为一种保护细胞的信号蛋白,还可以通过激活PI3K通路发挥氧化应激的功能。因此,BVR在PI3K/AKT信号通路调控肿瘤的生长和转移中扮演了重要的角色。
3.1.3 PKC家族与BVR的关系 蛋白激酶C(protein kianse C,PKC)既是细胞内重要的信号传导因子,参与细胞的发生、发展,也是多种信号通路的关键控制点和连接枢纽[19]。依据PKC调节区结构和酶学特点的不同,PKC家族分为3个亚组和众多亚型。其中,PKCδ可作为G蛋白偶联受体系统中的效应物在多种信号通路中发挥重要作用,是控制细胞生长、增殖及葡萄糖信号传导的关键调节因子[20]。研究表明,BVR可以通过锌离子螯合半胱氨酸残基的机制结合至PKC的C1结构域上(图1b),触发PKCδ构象发生改变,调控其功能发生变化[21]。研究已证实,PKCδ在MAPK和PI3K/AKT双重通路中起着枢纽的作用,发挥着Cross talk的功能(图1c)。因此,BVR可通过调控PKCδ的活性调节此两条经典肿瘤相关信号通路的功能[17]。
3.1.4 BVR、Erk 1/ 2、PKC δ复合物 有研究显示,BVR可与Erk1/2、PKCδ形成复合物,从而激活BVR,促进肿瘤生长因子如核因子κB(nuclear factor of kappa B,NF-κB)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)活性的增加[4]。hBVR含有C盒和D盒序列,其中,C盒序列是hBVR与ERK结合的关键序列,而D-盒序列是hBVR与PKCδ相互作用的关键序列[14]。因此,在此复合物中,BVR作为支架,使底物ERK与其激活的PKCδ或MEK接近,不仅提供了蛋白相互作用的平台,还起到了维持蛋白质活性构象的功能。此外,该复合物还可以利用BVR的抗氧化应激作用保护PKCδ避免被分解,从而抑制细胞凋亡。因此,通过此复合物使BVR发挥调控Erk1/2和PKCδ相关信号通路的功能,是多种肿瘤发生、发展的关键[22]。
3.2 BVR的转录激活功能
BVR除了磷酸化修饰功能外(图2a),还具有转录激活功能。BVR的DNA结构含有亮氨酸拉链特征性功能序列,该序列是重要的结构模体,见于多种转录因子,具有转录激活作用。受刺激后,BVR能进入细胞核与启动子同源序列绑定,在转录水平调控基因的表达[3]。研究显示,激活蛋白-1(activator protein 1,AP-1)启动子序列含有BVR结合位点,是BVR作为转录因子直接作用的靶点。AP-1也是亮氨酸zipper蛋白的转录因子,其DNA序列含有EMT相关基因Snail1、Snail2等启动子结合位点。因此,BVR可通过转录激活AP-1调控EMT相关基因的表达[23(]图2b)。此外,有研究通过微阵列分析等方法发现,高表达的BVR使活化转录因子 2(activating transcription factor-2,ATF-2)及环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)的编码基因表达上调,进而激活血管内皮生长因子,刺激肿瘤血管生成,促进肿瘤的发展[24]。
3.3 BVR作为细胞内转运体
BVR广泛分布于大多数细胞内,可通过耗能的方式将信号和调控分子转运至细胞内或细胞核中,从而发挥跨膜转运的功能[25]。上述研究介绍了BVR在细胞质和细胞核之间转运ERK的功能,就是BVR发挥跨核膜转运功能的一个例子(图2c)。同样,BVR还可在细胞内转运血红素,从而在红细胞分化过程中发挥作用。血红素可以与人BVR的C端的7个氨基酸结合,共同被转运至细胞核,然后经过一系列信号转导激活β-珠蛋白和血红素加氧酶1(Heme oxygenase 1,HO-1)基因。因此,BVR在细胞质和细胞核内转运血红素的功能对β-珠蛋白和HO-1在红细胞分化过程中的表达具有重要意义。
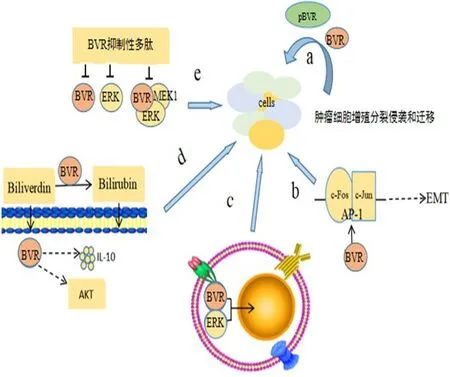
图2 BVR不同功能的示意图
3.4 BVR的抗氧化特性
活性氧(reactive oxygen species,ROS)水平的升高可激活信号通路,促进细胞的增殖、代谢及血管生成,加速肿瘤的发展。因此,ROS水平升高是肿瘤细胞株的特征。作为BVR的底物和产物,胆绿素和胆红素是已知的抗氧化剂。首先,胆红素与谷胱甘肽具有相似的细胞保护作用,两者相辅相成。亲水性谷胱甘肽在细胞质和细胞核中发挥作用,而亲脂性的胆红素则保护细胞膜不受损害[26]。其次,胆绿素具有细胞保护功能,可在休克和急性肝炎的动物模型中,通过细胞表面的BVR诱导AKT信号转导和IL-10表达,抑制动物体内的炎症反应[27(]图2d)。此外,胆汁色素可在胃癌的发展过程中发挥其抗突变特性[28]。有研究认为,胆汁色素可能对其他ROS介导的疾病起保护作用,如动脉粥样硬化与循环胆红素浓度呈负相关。尤为重要的是,ROS与肿瘤的发生密切相关,BVR通过其抗氧化特性抑制肿瘤的发生,发挥了细胞保护作用[29]。
3.5 BVR多肽作为潜在的细胞生长调节剂
3种BVR多肽中,肽KYCCSRK能激活BVR激酶的活性,而肽KKRILHC和肽KRNRYLSF均能抑制BVR激酶的活性[30]。其中,抑制性多肽不仅能影响BVR自身的活性,还能影响一些激酶的活性,如抑制ERK的激活。此外,多肽还可以通过破坏BVR的支架作用,抑制BVR、MEK1和ERK1/2复合物的形成(图2e)。ERK1/2不受控制的激活是恶性肿瘤的特点之一[10]。因此,基于BVR的抑制多肽的治疗药物有望成为抗肿瘤治疗的新途径。
4 小结与展望
综上所述,基于BVR结构的特征性和功能的多样化,BVR以多种方式参与着肿瘤的发生与发展。BVR可以直接或间接调控两条经典肿瘤相关信号通路(MAPK/ERK和PI3K/AKT)的活性;功能上,其不但具有传统意义上的蛋白磷酸化作用,还具有转录因子、转运物质、抗氧化以及作为多肽调节底物的特性。因此,基于BVR在肿瘤调控方面的多样性和重要性,并随着对其探索得不断深入,有望成为抗肿瘤治疗的新靶点。
