过表达ADAM10通过Notch/Akt信号通路抑制急性心肌梗死大鼠心肌细胞凋亡
2020-07-13左和平刘泽岩丁旵东
张 浩,左和平,刘泽岩,丁旵东
急性心肌梗死(acute myocardial infarction,AMI)是临床上较为常见的、致死率较高的心血管疾病,冠状动脉急性或持续性缺血缺氧造成的心肌细胞死亡是AMI早期的重要事件,也是引起心肌重构及心力衰竭的重要因素之一[1]。因而通过寻找有效分子靶点来阻断心肌细胞凋亡,已逐渐成为研究AMI损伤修复的热点领域。解整合素金属蛋白酶10(a disintegrin and metalloproteinase 10,ADAM10)是一种锚定于细胞膜表面的I型跨膜蛋白,参与细胞黏附、融合以及膜蛋白脱落和蛋白水解等多种生物学过程[2]。有研究[3]显示,ADAM10能够水解Notch蛋白膜外段受体,该过程是Notch通路活化的最关键步骤。而Notch信号通路不仅在哺乳动物胚胎期心脏发育中发挥重要作用,还参与哺乳动物成年后各类心脏疾病的调控[4],包括AMI。尤其在心肌缺血时,激活Notch信号通路可通过诱导血管生成、抑制心肌细胞凋亡,发挥改善心肌缺血再灌注损伤的作用[5]。因而据此推测ADAM10有可能通过Notch途径参与AMI所致心肌细胞凋亡的调控,但目前鲜有报道。现通过心肌原位注射ADAM10腺病毒,观察ADAM10过表达对AMI大鼠心肌细胞凋亡的影响,并探讨其作用机制是否是经激活Notch/Akt信号通路实现,以期为AMI的治疗提供新的潜在分子靶点。
1 材料与方法
1.1 动物与试剂6~7周龄健康清洁级雄性SD大鼠40只,体质量250~300 g,购自长沙市天勤生物技术有限公司,动物生产许可证号:SCXK(湘)2014-0010。所有大鼠均在(23±2)℃,相对湿度40%~70%,12/12 h光照周期条件下饲养,并自由饮食和摄水。ADAM10过表达质粒(GV345)构建及其腺病毒(2×1010PFU/ml)包装、浓缩和纯化均由上海吉凯基因化学技术有限公司完成;TRIzol试剂购自美国ThermoFisher Scientific公司;BeyoFastTMSYBR Green qPCR Mix试剂盒、TUNEL细胞凋亡检测试剂盒均购自上海碧云天生物技术有限公司;2,3,5-氯化三苯基四氮唑(2,3, 5-triphenyl tetrazolium chloride,TCC)染色试剂购自北京索莱宝科技有限公司;兔抗ADAM10多克隆抗体购自美国Novus Biologicals公司;兔抗Akt多克隆抗体、兔抗磷酸化Akt(Ser473)单克隆抗体、兔抗Cleaved-caspase-3多克隆抗体、兔抗Bax多克隆抗体、兔抗Bcl-2单克隆抗体、兔抗GAPDH单克隆抗体、兔抗Hes家族bHLH转录因子1(Hes1)均购自美国CST公司;兔抗Notch受体1(Notch1)单克隆抗体购自美国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1AMI模型建立及分组处理 40只大鼠被随机均分为假手术(sham)组、AMI组、空载腺病毒(Ad-NC)组和ADAM10腺病毒(Ad-ADAM10)组。除sham组外,其余各组大鼠均采用冠状动脉左前降支结扎术[6]建立AMI模型,而sham组大鼠仅采取冠状动脉左前降支穿线而不结扎。若观察到结扎局部下方或左心室变白,心率较为缓慢,并且Ⅱ导联心电图ST段抬高呈弓背向上型,表明AMI模型制备成功[7]。随后,AMI组、Ad-NC组和Ad-ADAM10组于心肌梗死区域选择3个位点分别注射10 μl生理盐水、空载腺病毒(2×1010PFU/ml)和ADAM10腺病毒(2×1010PFU/ml),sham组于相同区域注射等量生理盐水。术后72 h大鼠全部存活并处死大鼠,取心脏于-80℃保存备用。
1.2.2超声心动图评估心脏功能 术后72 h,腹腔注射10%水合氯醛麻醉大鼠,对大鼠进行心脏超声检测,记录左室射血分数(left ventricular ejection fraction,LVEF)、左室缩短分数(left ventricular shortening score,LVFS)、左室舒张末期内径(left ventricular end-diastolic diameter,LVDd)和左室收缩末期内径(left ventricular end-systolic diameter,LVDs)。
1.2.3RT-PCR检测心肌组织中ADAM10mRNA表达水平 取各组大鼠心脏梗死边缘区域心肌组织,采用TRIzol法提取组织总RNA,分光光度计测量RNA纯度。取2 μg RNA逆转录成cDNA,随后以cDNA为模板,按照SYBR Green qPCR Mix说明书操作进行PCR扩增。引物序列:ADAM10上游引物为5’-AAGAAGCTT CCCACAAGGCA-3’,下游引物为5’-TGTGTACGCAGAGTATCTAACTGG-3’; GAPDH上游引物为5’-ACTAGGCGCTCACTGTTCTC-3’,下游引物为5’-ATCC GTTGACTCCGACCTTC-3’。PCR条件:95 ℃预变性15 min;95℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环;以GAPDH为内参,采用2-ΔΔCt法计算ADAM10 mRNA相对表达量。
1.2.4TCC染色评估心肌梗死面积 取冻存心脏组织,在心尖到结扎点间进行冰冻切片,厚度4 μm,将切片置于1%的TCC染液中,于水浴箱中37 ℃避光孵育15 min,正常心肌区域被染成红色,梗死区域被染成白色,染色后即可拍照观察。采用Image-Pro Plus 6.0软件计算心肌梗死面积所占百分比,梗死面积百分比=白色区域面积/切面总面积×100%。
1.2.5TUNEL染色检测心肌细胞凋亡 取冻存的结扎线以下部分左心室心肌,置于4%多聚甲醛溶液中固定24 h,常规石蜡包埋后切片,按照TUNEL细胞凋亡检测试剂盒说明书进行操作,光镜下拍照观察。凋亡细胞的细胞核被染成棕褐色,每张切片随机选取5个视野,统计阳性细胞和总细胞数目,凋亡率=阳性细胞数/总细胞数×100%。
1.2.6Western blot检测相关蛋白表达水平 取冻存的结扎线以下部分左心室心肌组织,加入适量RIPA裂解液后冰上研磨20 min,4 ℃下12 000 r/min 离心25 min,收集上清液,采用BCA法进行蛋白定量。取20 μg蛋白进行10% SDS-聚丙烯酰氨凝胶电泳,再将蛋白转移PVDF膜上,5%脱脂牛奶室温封闭30 min,分别加入ADAM10(1 ∶1 000)、Cleaced-caspase-3(1 ∶1 000)、Bax(1 ∶1 000)、Bcl-2(1 ∶1 000)、Notch1(1 ∶500)、Hes1(1 ∶500)、Akt(1 ∶1 000)、p-Akt(ser473)(1 ∶1 500)和GAPDH(1 ∶2 000)等一抗,4 ℃孵育过夜。次日,洗涤后加入辣根过氧化物酶标记的山羊抗兔或抗小鼠IgG二抗(1 ∶10 000),室温孵育1 h,洗涤后加入ECL超敏发光液,显影。以目的条带灰度值与内参GAPDH灰度值的比值表示目的蛋白相对表达量。

2 结果
2.1 过表达ADAM10对大鼠心肌组织中ADAM10表达的影响如图1所示,与sham组比较,AMI组大鼠心肌组织中ADAM10 mRNA和蛋白水平降低(P<0.05);与AMI组比较,Ad-ADAM10组大鼠心肌组织中ADAM10 mRNA和蛋白水平升高(P<0.05),而Ad-NC组与AMI比较差异无统计学意义(P>0.05)。
2.2 过表达ADAM10对大鼠心脏功能及心肌梗死的影响如表1所示,与sham组比较,AMI组大鼠心脏功能参数值LVEF和LVFS降低(P<0.05),LVDd和LVDs升高(P<0.05);与AMI组比较,Ad-ADAM10组大鼠心脏功能参数值LVEF和LVFS升高(P<0.05),LVDd和LVDs降低(P<0.05),而Ad-NC组与AMI组比较差异无统计学意义(P>0.05)。此外,sham组大鼠未见心肌梗死,与AMI组比较,Ad-ADAM10组大鼠心肌梗死面积减小(P<0.05),而Ad-NC组与AMI组比较差异无统计学意义(P>0.05)。
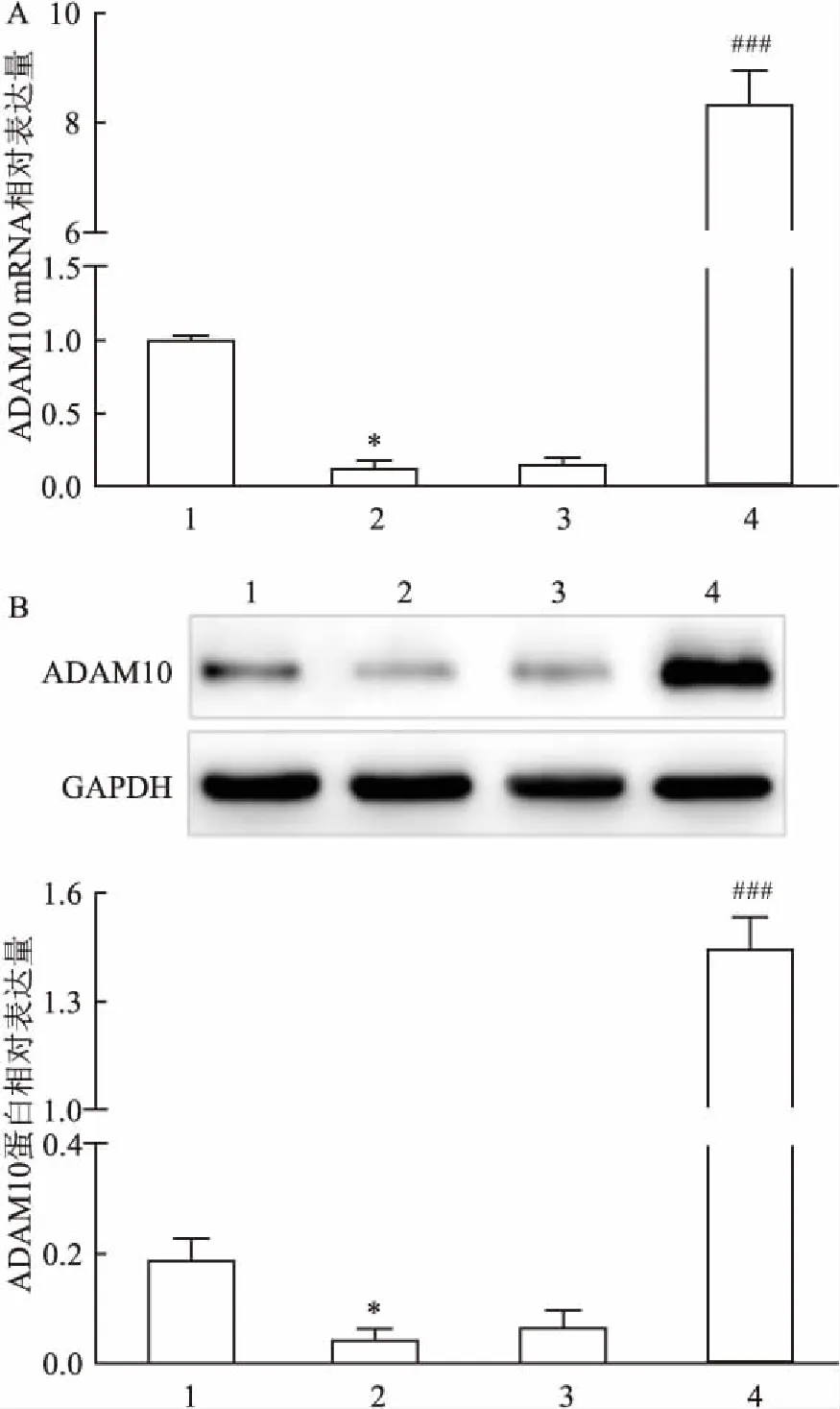
图1 各组大鼠心肌组织中ADAM10蛋白及mRNA的表达
A:ADAM10 mRNA;B:ADAM10 蛋白;1:sham组;2:AMI组;3:Ad-NC组;4:Ad-ADAM10组;与sham组比较:*P<0.05;与AMI组比较:###P<0.001
2.3 过表达ADAM10对大鼠心肌组织细胞凋亡的影响如图2所示,sham组心肌TUNEL染色切片呈现的棕褐色阳性染色细胞少,凋亡率低;与sham组比较,AMI组切片呈现的阳性染色细胞增多,细胞凋亡率升高(P<0.05);与AMI组比较,Ad-ADAM10组切片呈现的阳性染色细胞又减少,细胞凋亡率降低(P<0.05),而Ad-NC组与AMI组比较差异无统计学意义(P>0.05)。同时,与sham组比较,AMI组心肌组织凋亡蛋白Cleaved-caspase-3和Bax表达水平增加(P<0.05),抗凋亡蛋白Bcl-2表达水平降低(P<0.05);而与AMI组比较,Ad-ADAM10组Cleaved-caspase-3和Bax蛋白表达水平又降低(P<0.05),Bcl-2蛋白表达水平又升高(P<0.05),且Ad-NC组与AMI组比较差异无统计学意义(P>0.05)。见图3。

图2 TUNEL染色 ×100
1:sham组;2:AMI组; 3:Ad-NC组;4:Ad-ADAM10组;与sham组比较:**P<0.01; 与AMI组比较:#P<0.05
表1 各组大鼠心脏功能及心肌梗死面积比较
与sham组比较:*P<0.05,**P<0.01;与AMI组比较:#P<0.05,##P<0.01
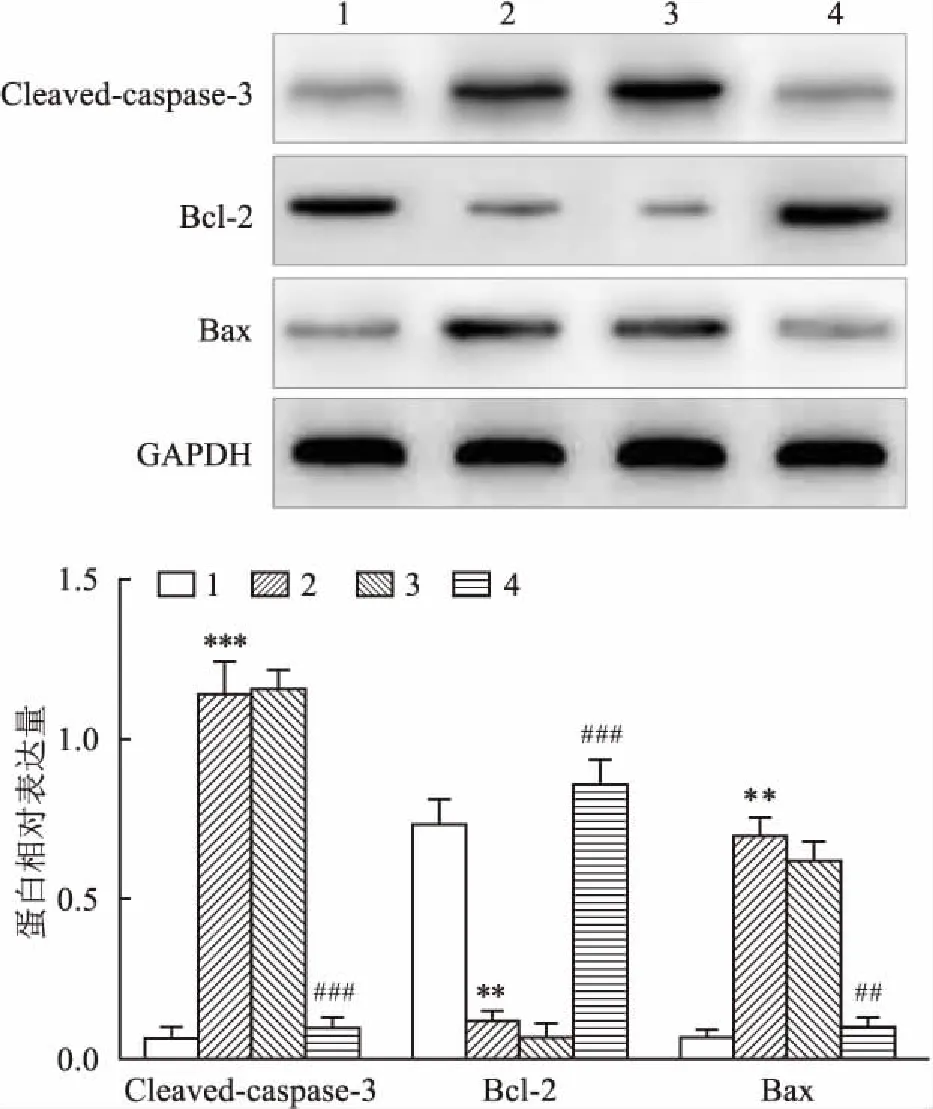
图3 各组大鼠心肌组织中凋亡相关蛋白表达水平
1:sham组;2:AMI组;3:Ad-NC组;4:Ad-ADAM10组;与sham组比较:**P<0.01,***P<0.001;与AMI组比较:##P<0.01,###P<0.001
2.4 过表达ADAM10对大鼠心肌组织Notch/Akt信号通路的影响如图4所示,与sham组比较,AMI组大鼠心肌组织中Notch1、Hes1蛋白表达水平以及Akt磷酸化水平降低(P<0.05);与AMI组比较,Ad-ADAM10组Notch1、Hes1蛋白表达水平以及Akt磷酸化水平升高(P<0.05),而Ad-NC组与AMI组比较差异无统计学意义。
3 讨论
ADAM10是一种具有多个功能结构域的跨膜蛋白,其不仅参与其他膜蛋白的水解过程,而且还参与细胞黏附及各种细胞信号的转导过程,在正常生理以及病理状态下均发挥重要作用。ADAM10在脊髓动物心脏发育及血管形成过程中也起到关键作用。例如,Farber et al[8]研究显示,ADAM10通过Notch通路调控小鼠冠状动脉的分化,其缺失将导致冠状动脉分化的缺陷。Li et al[9]报道称,通过阻断ADAM10水解N-cadherin蛋白可有效改善扩张型心肌病大鼠的心室重构。王博石 等[10]研究证实,ADAM10基因突变可导致人类先天性心脏缺陷。此外,ADAM10是Notch活化的关键调控因子[3],而Notch信号元件的突变或缺失也会导致心脏瓣膜畸形、心脏心室发育不全、心室分隔障碍等众多心脏疾病[11]。因此,ADAM10与多种心脏疾病的发生发展密切相关,然而ADAM10是否经Notch信号通路参与AMI调控,目前还未曾报道。本研究显示,心肌原位注射ADAM10过表达腺病毒能够抑制AMI大鼠心肌细胞凋亡,改善心功能,并激活Notch/Akt信号通路,提示ADAM10可能成为治疗AMI的一个潜在靶点。
1:sham组;2:AMI组;3:Ad-NC组;4:Ad-ADAM10组;与sham组比较:*P<0.05;与AMI组比较:###P<0.001
AMI是冠状动脉急性、持续性缺血缺氧所引起心肌坏死的过程。本研究采用冠状动脉左前降支结扎术构建AMI模型,能够较好的再现AMI的发病过程,使研究更贴近实际病理条件,也使研究结果更加可信。此外,AMI常伴有进行性心电图变化及心功能改变,因此心脏超声检查是评价AMI时心功能的重要辅助手段。本研究结果显示,与sham组比较,AMI组大鼠LVEF和LVFS值降低,LVDd和LVDs值升高,并且AMI组大鼠出现较大面积的心肌梗死和较高心肌细胞凋亡率,表现出明显的心功能下降及严重的心肌梗死和心肌细胞凋亡的现象。为了进一步探讨ADAM10在心肌梗死过程中的作用,本研究通过心肌组织原位注射ADAM10过表达腺病毒以提高心肌组织中ADAM10表达水平,结果表明ADAM10过表达能提高AMI大鼠心功能LVEF和LVFS值、降低LVDd和LVDs值,并降低心肌梗死面积和心肌细胞凋亡率,提示ADAM10过表达能改善AMI大鼠心功能,抑制心肌细胞凋亡。然而,李小鸥 等[12]研究发现敲低ADAM10表达能改善阿霉素诱导的扩张型心肌病大鼠心功能,这可能是由于扩张型心肌病与AMI病理机制不一致以及ADAM10行使功能不同所导致。
心肌细胞凋亡是AMI心肌梗死区最重要的病理特征,而细胞凋亡是一种受多种基因调控的程序性死亡过程。在细胞凋亡早期,Bax可介导线粒体内外膜间隙中凋亡启动因子Cyt C释放至胞质,激活Caspase-9启动Caspase级联反应,最终由Caspase-3执行凋亡作用,而抗凋亡蛋白Bcl-2可与Bax结合成二聚体抑制Bax行使功能[13]。本研究结果显示,与sham组比较,AMI组大鼠心肌组织中Cleaved-caspase-3水平及Bax蛋白表达增加,Bcl-2蛋白水平降低,说明AMI大鼠心肌细胞凋亡水平较高。然而,ADAM10过表达可降低Cleaved-caspase-3和Bax蛋白水平,提高Bcl-2蛋白表达水平,说明ADAM10过表达可抑制AMI大鼠心肌细胞凋亡。
有研究[14]显示,在胚胎期未成熟的心肌细胞中Notch1被激活以促进其发育和增殖,然而在出生后成熟的心肌细胞中Notch1被下调。同时,Zhou et al[15]研究显示,过表达Notch1能够促进缺氧复氧条件下心肌细胞的存活。此外,Notch1还可以通过激活下游Akt途径抑制心肌细胞凋亡[16]。鉴于是Notch活化的关键调控因子,据此推测ADAM10过表达有可能通过激活Notch/Akt信号通路抑制AMI心肌细胞凋亡。结果显示,与AMI组比较,ADAM10过表达也可提高Notch1、Hes1蛋白表达水平以及Akt磷酸化水平,说明ADAM10过表达是通过激活心肌组织中Notch/Akt信号通路来抑制心肌细胞凋亡,从而改善AMI大鼠心功能。
综上所述,本研究结果证实过表达ADAM10能够通过激活Notch/Akt信号通路抑制心肌细胞凋亡,改善AMI大鼠心功能。因而,ADAM10有可能为AMI的靶向治疗提供新的线索和论据。
