LukS-PV通过下调HDAC3抑制肝癌细胞增殖
2020-07-13汪自然丁篷生马筱玲
汪自然,马 凡,丁篷生,马筱玲
肝癌(hepatocellular carcinoma,HCC)是临床上尤为常见的消化道恶性肿瘤之一,在全球癌症相关死亡的主要原因中排名第二位[1]。虽然近年来HCC的诊疗水平已有了较大程度提升,但临床疗效依旧不理想,晚期HCC患者的5年生存率仍旧处于较低水平。因此,寻找新的靶向治疗药物对于降低HCC的死亡率意义重大。LukS-PV是金黄色葡萄球菌分泌的一种毒素—杀白细胞素(Panton-Valetine leukocidin , PVL)中的S组分。课题组前期研究[2]表明,LukS-PV靶向C5aR诱导白血病细胞株THP-1凋亡。最近研究[3]表明,LukS-PV能够抑制乳腺癌细胞株MAD-MB-231增殖,促进其凋亡,并诱导其周期阻滞。目前,LukS-PV对HCC细胞的影响及作用机制仍不清楚。组蛋白去乙酰化酶3(histone deacetylase 3, HDAC3)是一种在真核细胞中广泛表达的Ⅰ类组蛋白去乙酰化酶[4]。HDAC3能够通过调控相关基因转录催化组蛋白的去乙酰化,并参与肝脏的各种生物代谢过程[5]。该研究首先研究LukS-PV对HCC细胞增殖的作用,进一步检测泛乙酰化水平改变以及使用定量蛋白组学测序,初步探讨LukS-PV对HCC细胞增殖的影响及机制。
1 材料与方法
1.1 主要材料人HCC细胞株HepG2和Huh7购于上海中科院细胞库;DMEM高糖培养基及胎牛血清购于以色列BI公司;青-链霉素、胰酶、BCA蛋白浓度测定试剂盒购于上海碧云天公司;CCK-8试剂购于合肥睿捷生物科技公司;Opti-MEM、转染试剂Lipofectamine2000购于美国Invitrogen公司;HDAC3干扰序列由上海吉玛公司合成;逆转录酶和SYBR试剂购于日本TaKaRa公司;HDAC3、GAPDH引物由安徽通用生物公司合成;一抗HDAC3、GAPDH抗体购于武汉三鹰生物公司;一抗泛乙酰化抗体购于杭州景杰生物科技有限公司;二抗(羊抗鼠IgG和羊抗兔IgG)购于武汉Abclonal公司;SDS-PAGE配胶试剂盒、快速封闭液、化学发光液ECL购于上海雅酶生物公司。
1.2 方法
1.2.1细胞培养 HCC细胞株HepG2、Huh7在添加了10%胎牛血清、100 U/ml青-链霉素的DMEM培养基中培养。
1.2.2LukS-PV的制备 LukS-PV按照常文娇等[6]提供的方法表达、纯化,并进行蛋白定量。
1.2.3CCK-8法检测细胞增殖能力 取对数生长期的HepG2、Huh7细胞计数,按4 000个/孔铺于96孔中,过夜贴壁后加入不同浓度(0.25、0.5、0.75、1 μmol/L)的LukS-PV处理,分别在处理后12、24、36 h每孔加入10 μl的CCK-8试剂,继续孵育2 h后使用酶标仪测每孔在450 nm处的吸光度(optical density,OD)。每组分别设置5个复孔,同时设置空白孔。按照细胞存活率=OD(实验组-空白组)/OD(对照组-空白组)×100%公式计算评估各组细胞增殖能力。
1.2.4定量蛋白组学 定量蛋白组学由杭州景杰生物科技有限公司完成。取对数生长期的HepG2细胞分为2组进行培养,一组加入0.5 μmol/L的LukS-PV,另外一组加入等量的PBS作为对照。培养24 h后离心收集细胞,去除培养液,加入裂解液超声裂解,4 ℃、12 000 r/min离心15 min留取上清液并使用BCA试剂盒测定蛋白浓度。酶解后的肽段采用TMT标记并使用高ph反向HPLC分级,处理后的肽段再采用液相色谱-串联质谱分析。二级质谱数据最后使用 Maxquant (v1.5.2.8)进行检索并进行生物信息学分析。
1.2.5TCGA数据库分析HDAC3在HCC中的作用 使用UALCAN网站分析TCGA数据库中HDAC3基因在HCC组织及正常肝组织中的表达差异以及高表达和低表达HDAC3患者的预后差异。
1.2.6实时荧光定量PCR(RT-PCR) 提取细胞RNA,并对RNA浓度进行定量,RNA纯度OD260/OD280需在1.8~2.0之间方可进行后续实验。按逆转录酶2 μl,RNA 500 ng,总体系10 μl进行逆转录,反应条件为37 ℃、15 min,85 ℃、 5 s。PCR定量使用罗氏480仪器,PCR体系为TB 10 μl, ddH2O 7.2 μl,上下游引物各0.4 μl,cDNA 2 μl。反应条件为95 ℃预变性30 s;PCR扩增95 ℃、 5 s,60 ℃、 30 s,共计40个循环;融解曲线分析95 ℃、 5 s,60 ℃、 1 min。以GAPDH为内参基因,采用2-ΔΔCt法计算HDAC3 mRNA相对表达量。
1.2.7Western blot分析蛋白表达量 预冷的PBS清洗细胞3次,加入蛋白裂解液冰上放置15 min,使用细胞刮将细胞刮至一侧后继续置于冰上裂解20 min,期间多次吹打细胞与裂解液使其充分混匀。4 ℃、12 000 r/min离心20 min后留取上清液使用BCA试剂盒进行蛋白定量。获得的蛋白样本使用10%的SDS-PAGE分离后,转至NC膜上,转膜条件为200 mA,90 min。使用雅酶快速封闭液室温封闭30 min后,分别放入一抗HDAC3、GAPDH和泛乙酰化抗体(1 ∶1 000)中4 ℃摇晃孵育过夜。次日,使用TBST洗去未结合的一抗,加入羊抗鼠或者羊抗兔IgG的二抗(1 ∶5 000)中,室温孵育2 h,TBST洗去未结合的二抗。最后使用ECL显影液于天能曝光仪中显影。
1.2.8细胞转染 分别取对数生长期的HepG2和Huh7细胞铺于6孔板中,待细胞汇合度达到50%~70%时转染。分别取5 μl的SiRNA和5 μl的Lipofectamine2000轻轻加入125 μl的Opti-MEM中,室温静置5 min后将二者混合继续室温孵育20 min。期间将各孔培养液更换为无血清DMEM培养基,并将上述混合物加入各组细胞中。培养箱中孵育6 h后将培养液更换为含10%血清的完全培养基后继续培养48 h。提取细胞检测HDAC3 mRNA和蛋白表达量确定敲低效率较高后再进行后续实验。

2 结果
2.1 LukS-PV对HepG2和Huh7细胞增殖的影响采用不同浓度的LukS-PV作用HepG2和Huh7细胞,并使用CCK-8方法于12、24、36 h检测细胞增殖能力的改变。结果显示随着LukS-PV浓度的增加,细胞抑制率逐渐增高,且细胞抑制率随着作用时间延续增加更为明显,表明LukS-PV可以降低HCC细胞的增殖能力且呈时间依赖性和浓度依赖性。见图1。
2.2 定量蛋白组学表明LukS-PV作用后HDAC3下调蛋白翻译后修饰在肿瘤的发生发展中起到了重要的作用。近年来,乙酰化作为一种常见的表观遗传学修饰在肿瘤中的作用引起了广泛的关注。为了探究LukS-PV抑制HCC细胞增殖的机制,首先使用泛乙酰化抗体检测LukS-PV作用后总体乙酰化水平的改变。结果显示,0.5 μmol/L LukS-PV作用24 h后HepG2细胞中蛋白的总体乙酰化水平与PBS组相比增高(图2B)。进一步使用定量蛋白组学分析LukS-PV作用后蛋白表达谱的改变。通过检索定量蛋白组学结果显示HDAC3表达下调(图2A)。为了初步探究HDAC3在HCC中的作用,课题组分析了TCGA数据库中HCC数据,其中HCC组织371例,正常肝组织50例。图2C结果表明,HCC组织中HDAC3 mRNA表达水平(中位数26.146)明显高于正常组织中HDAC3 mRNA表达水平(中位数17.996),差异有统计学意义(P<0.05)。图2D生存分析结果进一步表明高表达HDAC3的患者生存期明显低于低表达患者(P<0.05)。因此,HDAC3可能是HCC中的一个重要的致癌基因。
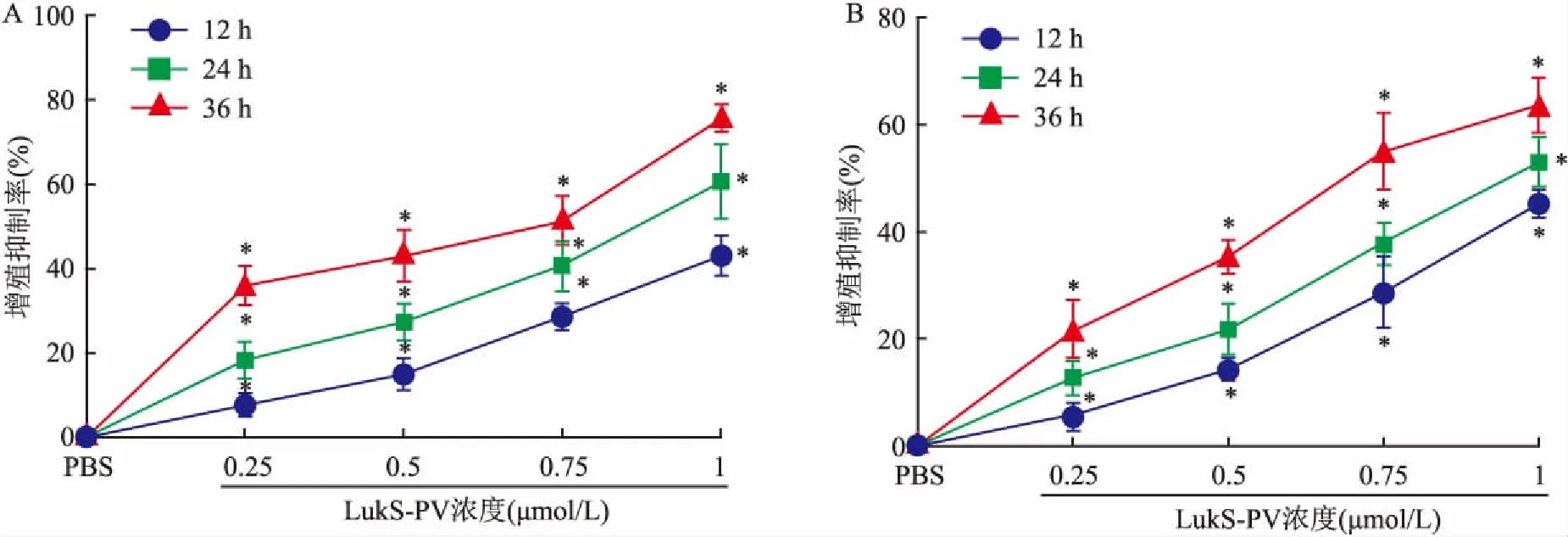
图1 不同浓度LukS-PV对HCC细胞增殖的影响

图2 HDAC3表达下调及在HCC中的作用
A:蛋白组学热图;B:LukS-PV作用后总体乙酰化水平改变;C:HDAC3在HCC组织和正常组织表达差异;D:高表达HDAC3和低表达HDAC3患者预后差异;marker:分子量标准
2.3 RT-PCR和Western blot验证HDAC3下调基于定量蛋白组学结果显示HDAC3下调,且HDAC3在HCC组织中高表达,与患者预后密切相关,可能是LukS-PV作用的重要靶点。进一步使用RT-PCR和Western blot核实不同浓度LukS-PV作用后HDAC3 mRNA水平和蛋白水平的改变。结果表明,LukS-PV在HepG2和Huh7细胞株中可以下调HDAC3的mRNA(F=14.33,P<0.05;F=12.47,P<0.05)和蛋白水平(F=33.66,P<0.05;F=57.97,P<0.05),且呈浓度依赖性。见图3。
2.4 HDAC3基因敲低验证为了探讨HDAC3在HCC中的作用,实验使用特异性SiRNA转染HepG2和Huh7细胞干扰HDAC3的表达,并用RT-PCR和Western blot检测敲低效率。RT-PCR结果显示,与NC组相比,干扰组HDAC3 mRNA表达量下降,差异有统计学意义(t=13.23,P<0.05;t=23.21,P<0.05),见图4A、B。进一步使用Western blot发现干扰组的HDAC3的蛋白表达水平降低,见图4C、D。
2.5 HDAC3敲低后对HCC细胞增殖的影响确定HDAC3基因干扰效率较高后,课题组进一步探究HDAC3基因敲低对HCC细胞增殖能力的影响。图5结果表明,敲低HDAC3后36 h开始可以降低HCC细胞HepG2和Huh7细胞的增殖能力(t=3.32,P=0.04;t=3.501,P=0.02)。
3 讨论
细菌毒素因其与靶细胞结合的特异性和细胞毒性已成为抗肿瘤药物开发的热点,部分细菌毒素已应用于临床。例如,从白喉杆菌中提取的白喉毒素,在各种临床试验中显示出抗肿瘤活性,包括肾上腺皮质癌、胶质母细胞瘤、皮肤T细胞淋巴瘤、乳腺癌和宫颈腺癌[7-8]。课题组前期研究[2-3]表明,LukS-PV对白血病细胞、乳腺癌细胞均展现出良好的抗肿瘤作用。进一步研究[9]发现,LukS-PV靶向C5aR诱导白血病细胞凋亡。而Hu et al[10]报道,C5aR在HCC中高表达,且C5aR刺激后能激活ERK1/2通路,促进HCC的侵袭转移。因此,课题组推测LukS-PV可能对高表达C5aR的HCC细胞也有作用。
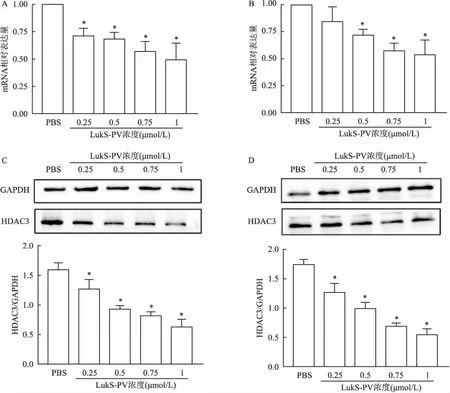
图3 不同浓度LukS-PV下调HDAC3表达
A、B:RT-PCR检测不同浓度LukS-PV作用HepG2与Huh7细胞后HDAC3 mRNA表达改变;C、D:Western blot检测不同浓度LukS-PV作用HepG2与Huh7细胞后HDAC3蛋白表达改变;与PBS组比较:*P<0.05
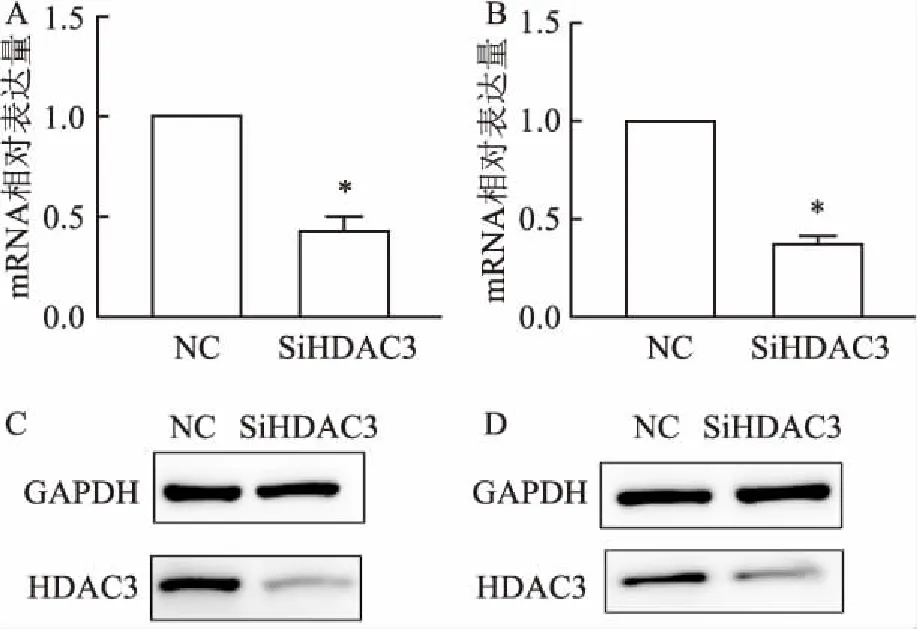
图4 HDAC3基因敲低验证
A、B:RT-PCR检测HepG2与Huh7细胞敲低HDAC3后HDAC3 mRNA表达量改变;C、D:Western blot检测HepG2与Huh7细胞敲低HDAC3后HDAC3 蛋白表达量改变;与NC组比较:*P<0.05

图5 HDAC3敲低后对HCC细胞增殖能力的影响
A:HepG2细胞;B:Huh7细胞;与NC组比较:*P<0.05
近年来,在肿瘤发生发展过程中起重要作用的表观遗传调控异常逐渐引起关注。乙酰化,尤其是组蛋白乙酰化,通过调控染色质结构的稳定性和相关基因的转录,进而影响细胞的增殖、凋亡和分化。而组蛋白的乙酰化主要受组蛋白乙酰基转移酶和组蛋白去乙酰化酶调控。HDAC3作为组蛋白去乙酰化家族(HDACs)中的重要成员,已有多项研究[11-13]表明其参与HCC的发生发展。朱柯亭 等[11]报道,HDAC3在HCC组织中表达上调,能够通过上调p-STAT3促进HCC的复发。Wu et al[12]报道HDAC3可以与TRAF6结合增加致癌基因c-myc的稳定性,促进其表达。李瑞宝 等[13]报道,伏立诺他衍生物N25能够通过下调HDAC3进而诱导HCC细胞凋亡。因此,HDAC3可能是HCC中的一个重要致癌基因,可能成为未来HCC诊疗的新靶点。LukS-PV可抑制HDAC3表达,这种广泛的去乙酰化作用导致细胞增殖作用降低,其中可能的机制较为复杂。Lou et al[14]报道HDAC3可以与人附睾蛋白4结合并活化PI3K/AKT信号通路促进卵巢癌细胞的增殖。Lu et al[15]研究表明沉默HDAC3后胞质中ac-STAT3向p-ATAT3的转化过程被破坏,STAT3信号通路被抑制进而抑制HCC细胞的增殖。
本研究首先研究了LukS-PV对HCC细胞增殖的影响,显示LukS-PV能够抑制HepG2和Huh7细胞的增殖。为了进一步探索其机制,课题组采用泛乙酰化检测和定量蛋白组学研究LukS-PV作用后蛋白水平的变化。结果表明LukS-PV作用于HepG2细胞后,其蛋白整体乙酰化水平增高。定量蛋白组学研究表明HDAC3下调,与乙酰化水平检测结果相一致。通过对TCGA数据库中HCC数据的分析,显示HDAC3在HCC中高表达,且高表达HDAC3的患者预后不良,表明HDAC3可能是HCC发生发展中的重要致癌基因,其功能可以进一步研究。课题组使用RT-PCR和Western blot验证了蛋白组学的结果,LukS-PV可以下调HDAC3的表达。进一步使用特异性的SiRNA干扰HDAC3的表达后,HCC细胞HepG2和Huh7的增殖能力降低,表明HDAC3可能在HCC细胞增殖调控过程中发挥重要的作用。因此,本研究揭示了LukS-PV可能通过下调HDAC3的表达抑制HCC细胞的增殖,为HCC的精准靶向治疗提供了新的研究思路。当然,LukS-PV调控HDAC3的具体机制仍需进一步深入研究。
