维生素D及维生素D受体在慢性乙型肝炎患者体内表达水平及抗病毒相关机制的研究
2020-07-13汪玲妹管世鹤严荣荣李太平
汪玲妹,管世鹤,张 浩,杨 凯,汪 静,严荣荣,李太平,李 姣
维生素D(vitamin D,Vit D)是一种常见的维生素,既往认为其主要参与机体骨钙磷代谢,最新研究[1]表明Vit D具有调节先天性免疫和适应性免疫的重要作用,且Vit D缺乏与各种自身免疫性疾病、病原体感染等风险增加相关。Vit D的基线水平与VDR基因多态性影响病毒性肝炎的自然病程以及聚乙二醇化干扰素(pegylated interferon,Peg-IFN)治疗的反应[2-3]。进一步研究[4]发现,Vit D能够通过增强IFN-α诱导的基因表达,增强IFN-α对丙型肝炎病毒复制的抑制作用,而非活性维生素D受体(vitamin D receptor,VDR)能够结合STAT1进而抑制JAK-STAT信号转导途径。目前,关于Vit D、VDR在CHB中作用尚未完全清楚, 为此该研究分析了CHB患者Vit D、VDR表达与乙型肝炎相关指标关系,同时通过体外细胞系研究Vit D和IFN-α单独及联合处理对HBV复制水平的影响及其可能存在的机制,从而为临床抗HBV治疗提供线索。
1 材料与方法
1.1 材料
1.1.1试剂和仪器 MEM培养液购自美国 Hyclone 公司;胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司;细胞培养双抗购自上海碧云天生物科技有限公司;IFN-α购自合肥安科生物公司;Vit D试剂购自上海阿拉丁公司;抗干扰素调节因子9(IFN regulatory factor-9,IRF-9)抗体、抗粘病毒A蛋白(Mx GTPase A,MxA)抗体、抗-VDR抗体均购自英国 Abcam 公司;抗-β-actin 抗体购自美国Affinity公司;山羊抗兔 IgG抗体购自北京中杉金桥生物技术有限公司; ECL底物发光试剂盒购自美国Pierce公司。
1.1.2病例资料 选取2018年1~12月在安徽医科大学第二附属医院感染科收治的CHB患者共计 81例,男63例,女18例。CHB的诊断符合《慢性乙型肝炎防治指南(2015 年版)》。排除标准:① 存在其他肝脏疾病如丙型病毒性肝炎、脂肪肝、酒精性肝病、药物性肝病、自身免疫性肝病、肝硬化等;②曾接受干扰素和或核苷(酸)类药物抗病毒治疗;③ 癌症或其他严重的慢性疾病;④ 近3个月服用Vit D制剂。选择同期体检人群健康者40例作为健康对照(health control,HC)组。
1.2 方法
1.2.1肝功能指标、Vit D及HBV相关指标定量检测 肝功能指标如:丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、白蛋白(albumin,ALB)、总胆红素(total bilirubin,TBIL)、碱性磷酸酶(alkaline phosphatase,ALP)、r-谷氨酰基转移酶(gamma-glutamyl transferase,GGT) 由德国西门子全自动生化分析仪 Dimension EXL TM with LM检测,Vit D及 HBV血清学指标分别由瑞士罗氏全自动电化学发光分析仪 Cobas e602和雅培全自动化学发光分析仪 i4000 SR检测。HBV DNA 定量检测按照检测试剂盒(上海复星长征医学科学有限公司)说明书步骤操作。
1.2.2免疫组织化学染色检测CHB患者肝组织中VDR表达 肝穿标本经超声引导下穿刺取得,采用Power Vision TM二步法对肝组织标本进行染色,操作严格按照产品说明书进行,染色结果由光学显微镜下观察得到。
1.2.3细胞培养及处理 HepG2.2.15细胞以 MEM 培养液添加10% FBS、105IU/L青霉素、105IU/L链霉素,置于37 ℃、5% CO2条件下培养。细胞计数后, 按5×105/孔接种于12孔板,待HepG 2.2.15细胞生长到70%~80%融合时进行处理,分为空白组、IFN-α(105IU/L)处理组、Vit D(1 μmol/L)处理组和联合处理组。加药处理后置于37 ℃、5% CO2培养箱中培养48 h。
1.2.4Western blot技术分析 细胞PBS冲洗3次,各孔加含PMSF(体积比1 ∶100)的RIPA裂解液100 μl,冰上裂解30 min后刮取细胞至EP管,离心(15 000 r/min、30 min,4 ℃)后收集上清液,BCA法进行蛋白定量,加入5×蛋白上样缓冲液,沸水中煮10 min,冷却,配胶(10%分离胶+5%浓缩胶)电泳分离,半干转法转移到PVDF膜上,室温下用封闭液(5%的牛奶)封闭1 h,TBST清洗3次,加入一抗(抗-IRF-9抗体:1 ∶2 000;抗-MxA抗体:1 ∶1 000;抗-VDR抗体:1 ∶1 00)中4 ℃震荡过夜,第2天清洗后于室温下二抗(山羊抗兔 IgG抗体:1 ∶5 000)中孵育1 h,清洗待用。吸取等量的ECL 2种试剂,混合均匀后均匀涂抹在PVDF膜表面,在自动显影仪上曝光,β-actin 作为内参。

2 结果
2.1 人口学资料及实验室指标本研究纳入CHB组81例,健康对照组(health control,HC)40例,两组年龄及性别特征无统计学差异。与HC组比较,CHB组患者肝功能指标ALT、AST、ALB、ALP、GGT差异有统计学意义(P≤0.001)(表1)。
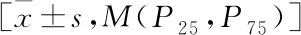
表1 研究对象基本资料
2.2 CHB患者血清Vit D含量及分布血清Vit D含量在CHB组和HC组分别为(25.04±7.50) ng/ml和(27.71±5.55)ng/ml,差异有统计学意义(P<0.05)。目前广泛接受的Vit D含量定义为正常(>30 ng/ml)、不足(20 ~30 ng/ml)、缺乏(<20 ng/ml)[5]。CHB组中患者血清Vit D含量正常、不足、缺乏比例分别为24.69%(20/81),45.68%(37/81)、29.63%(24/81);HC组中Vit D含量正常、不足、缺乏比例分别为30%(12/40)、65%(26/40)、5%(2/40),CHB患者不同含量Vit D构成与HC组相比差异有统计学意义(P<0.001)(图1)。
2.3 CHB患者血清Vit D水平与肝功能、HBV血清学指标相关性ALT、AST、ALB和 TBIL 是评估CHB严重程度常用的生化指标,尤其 ALT 和AST在CHB临床分期和治疗中具有重要意义。通过Pearson和Spearman相关分析,CHB组血清Vit D水平与ALB呈正相关性(r=0.339,P=0.002),而与其它肝功生化指标 ALT、AST、TBIL、ALP、GGT间无相关性;CHB 患者血清Vit D水平与HBV DNA呈负相关性(r=-0.274,P=0.013),与HBsAg 、HBcAb无相关性。HBeAg阳性患者血清Vit D水平(23.43±7.86)ng/ml与HBeAg阴性患者Vit D水平(26.77±6.78)ng/ml相比差异有统计学意义(P<0.05)(图2)。
2.4 CHB分期与血清Vit D、肝组织中VDR表达关系据ALT、AST、TBIL、ALB等指标将CHB患者分为轻度(n=19)、中度(n=49)、重度(n=13)。血清Vit D水平与CHB严重程度相关,中度CHB患者血清Vit D水平(25.46±6.53)ng/ml及重度CHB患者血清Vit D水平(17.19±3.04)ng/ml低于轻度CHB患者血清Vit D(29.98±7.77)ng/ml,且重度CHB患者血清Vit D水平低于中度CHB患者血清Vit D(图3A)。免疫组化染色显示,CHB患者肝组织VDR表达较健康人群降低,且随肝炎严重程度加重而表达下降(图3B)。
2.5 Vit D和IFN-α单独及联合处理HepG2.2.15细胞后HBV血清学指标及VDR、MxA、IRF-9蛋白表达水平分析经 Vit D单独及联合IFN-α处理HepG2.2.15细胞后,与空白组相比,IFN-α+Vit D联合处理组对 HepG2.2.15细胞分泌 HBsAg、HBeAg的抑制作用大于 IFN-α组和Vit D组;与IFN-α 组相比,IFN-α+Vit D联合处理组上清液中HBsAg、HBeAg分泌下降,其中HBsAg差异有统计学意义(P<0.05)。运用实时荧光定量 PCR分析细胞上清液HBV DNA,各处理组未见明显抑制作用(表2)。经Vit D单独及联合IFN-α处理后,HepG2.2.15 内VDR、IRF-9 和MxA 蛋白的表达量增高(图4)。

图1 CHB组和HC组血清Vit D含量及分布

图2 CHB患者血清Vit D水平与ALB、HBV DNA关系
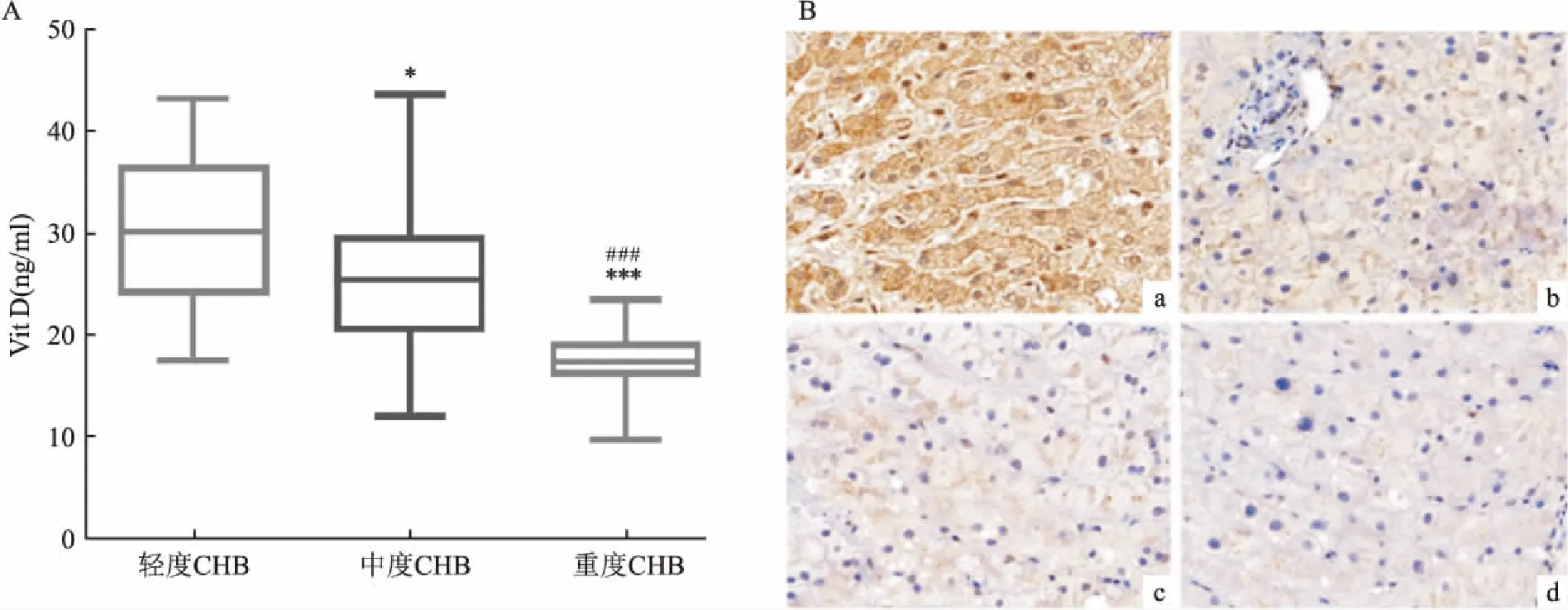
图3 CHB分期与血清Vit D、肝组织中VDR表达水平关系 ×200
A:不同程度CHB患者血清Vit D水平;B:VDR在CHB患者及正常肝组织中的表达;a:正常;b:轻度;c:中度;d:重度;与轻度CHB比较:*P<0.05,***P<0.001; 与中度CHB比较:###P<0.001
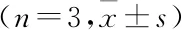
表2 Vit D和IFN-α单独及联合处理后细胞培养上清液HBV血清学指标
与空白组比较:*P<0.05,**P<0.01; 与IFN-α组比较:#P<0.05
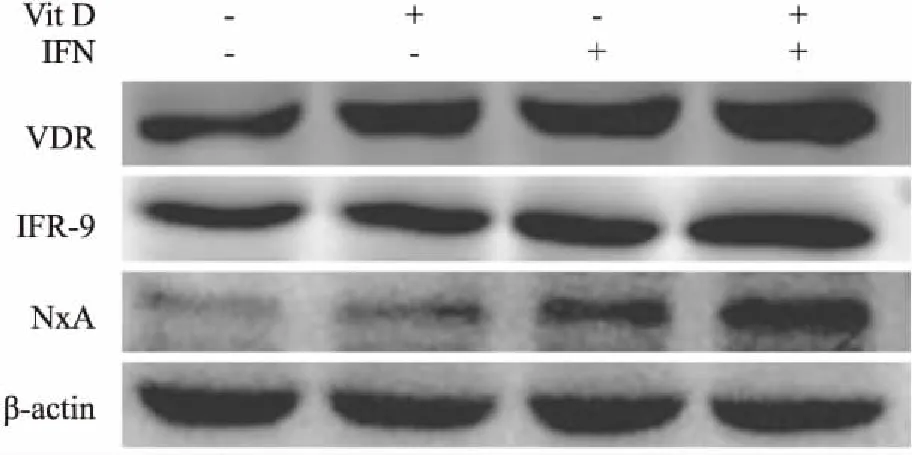
图4 Vit D和IFN-α单独及联合处理后细胞VDR、MxA、IRF-9蛋白表达水平
3 讨论
Vit D活性形式为1, 25(OH)2D3,一般认为经食物或光照来源的Vit D前体首先在肝脏中被羟化成25(OH)D3,随后在肾脏中被羟化成1, 25(OH)2D3。近来研究[6]发现,Vit D代谢酶也存在于多种组织中,如胎盘、皮肤和免疫细胞,同时,某些信号如IFN或Toll样受体可刺激相关酶表达,使巨噬细胞产生具有生物活性的代谢物1, 25(OH)2D3。Chen et al[7]长期随访128例初治CHB患者发现,CHB患者基线Vit D水平明显低于健康人群,与血清HBV DNA载量呈负相关,经过核苷(酸)类似物治疗后,整体Vit D水平有所上升,且发生e抗原转换CHB患者血清Vit D水平高于e抗原持续阳性患者,提示CHB患者体内Vit D水平对抗病毒疗效有一定的预测价值。本研究通过分析健康体检者、初治CHB患者血清Vit D水平与实验室参数间关系,表明CHB患者血清Vit D水平低于健康体检者,与HBV DNA载量、e抗原状态相关,这也与Chen et al[7]研究一致。
VDR是一种48 ku大小的可溶性蛋白,属于核受体超家族成员,几乎所有组织中都有表达,与Vit D通过配体-受体模式激活,作用于靶基因上的特定DNA序列,进而调节结构基因的表达[8]。研究[9]表明慢性丙型肝炎患者肝脏VDR表达显著低于健康人群,与肝脏损伤严重程度密切相关,并且在获得完全病毒学应答的患者中肝脏VDR表达高于未获得患者,提示慢性丙型肝炎患者体内可能存在Vit D/VDR信号通路的功能下降,进而影响抗病毒效果乃至疾病进程。同样,有体外实验[10]发现VDR在HBV转染细胞中表达下调,相应减少了CAMP、TNF-α等因子表达,不利于Vit D发挥对HBV转录和翻译的抑制作用。此外,有研究[11]报道Vit D可通过VDR抑制TGF-1/SMAD3信号通路,从而抑制肝星状细胞激活以此减轻肝纤维化,通过长期随访提出Vit D基因多态性与丙型肝炎进展有关。本研究显示CHB患者血清Vit D、肝组织中VDR表达与CHB严重程度负相关,提示CHB患者体内可能也存在Vit D/VDR信号通路的功能下降,这可能不利于药物发挥抗病毒作用,甚至加速CHB转变为肝纤维化乃至肝硬化的进程。
有研究[12]表明,Vit D可诱导IFN介导的信号通路的表达,进而发挥抗丙型肝炎病毒效应。本研究显示Vit D处理后HepG2.2.15细胞内抗病毒蛋白MxA表达升高,同时细胞分泌的HBV相关抗原出现下降趋势,提示Vit D可能通过作用于IFN-α JAK-STAT通路,上调抗病毒蛋白MxA表达,进而影响病毒复制。另有研究[6]发现,Vit D与 IFN-α发挥协同效应,增强IFN-α抗病毒活性。本研究进一步采用 Vit D与IFN-α联合处理HepG2.2.15 细胞,显示IRF-9 和MxA 蛋白的表达及对HBV抗原抑制作用较IFN-α单独处理增强,与其研究一致,表明Vit D可能通过增强HepG2.2.15细胞JAK-STAT途径分子IRF-9及下游抗病毒蛋白MxA的表达,抑制HepG2.2.15细胞HBV抗原分泌,增强IFN-α的药效。同时,Bi et al[13]发现较IFN-α单独处理,Vit D与IFN-α联合处理乙型肝炎模型小鼠病毒复制及抗原分泌显著降低,有较好的预后,这可能是加强了药物疗效带来的良好反应。因此,定期监测及维持CHB患者体内一定的Vit D水平可能有助于CHB患者的病情评估以及疾病控制。
