毛竹释放挥发物对空气负离子及微生物的影响
2020-07-12吕嘉欣项亨旺韦赛君张汝民
吕嘉欣,王 翔,项亨旺,韦赛君,王 彬,高 岩,张汝民
(1.浙江农林大学亚热带森林培育国家重点实验室,浙江杭州311300;2.浙江省森林资源监测中心,浙江杭州310020;3.亨旺生态旅游发展有限公司,浙江德清313200)
植物生长过程中除了通过根系分泌或雨水淋洗叶片向土壤中增加他感化合物外,还会通过花、叶或其他营养器官释放挥发性有机气体(Volatile Organic Compounds,VOCs)[1]。植物VOCs具有多种生理生态功能,在净化空气、抑菌杀菌、人体保健等方面具有重要价值[2]。香茅草(Cymbopogoncitratus)及紫苏(Perilla frutescens)释放的柠檬醛、芳樟醇、大根香叶烯等萜类化合物不但会改变大气的化学组成,还会对周围生物产生影响[3-6]。谢占芳[7]发现8种菊花(Dendranthemamorifolium)释放的VOCs对金黄色葡萄球菌(Staphylococcusaureus)、白色念珠菌(CandidaAlbicans)等均有不同程度的抑制作用。孙和龙[8]通过活体实验,发现壬醛可作为活体抑菌剂,对番茄青霉和灰霉具有明显的抑制效果。Fadil等[9]研究发现百里香(Thymusvulgaris)和香桃木(Myrtuscommunis)精油对鼠伤寒沙门氏菌具有协同抑菌作用。佟棽棽[10]对迷迭香(Rosmarinusofficinalis)挥发性香气研究发现其中的樟脑和香樟醇等可作为重要的抗抑郁成分。植物VOCs中大部分是可挥发的中性气体分子,当浓度越高时,受Lenard效应(喷桶效应)的影响,可产生较多的空气负离子(Negative air ion,NAI),从而增加NAI的数量[11]。NAI具有较高的生态意义,它的形成与植物自身及周围环境(温度、湿度等)均具有密切关系[12]。研究表明,大气中正离子通常具有害作用,而空气负离子作为活性氧,生物活性高、还原性强,能够破坏细菌、病毒等的屏障及酶的活性,从而抑制细菌和真菌等微生物的生长[13]、减少微生物气溶胶的数量。因此,NAI浓度是生态环境和空气质量评价体系中的重要指标之一。
目前,有关毛竹(Phyllostachysedulis)的研究主要集中在光合特性[14]、糖代谢[15]、非生物胁迫[16]、基因组鉴定与表达分析[17]等方面,而对其林内不同季节挥发物对微生物综合影响研究较少。因此,研究选取毛竹为对象,测定了毛竹叶片释放的VOCs和不同毛竹林内空气VOCs的组分与含量、林内空气负离子和微生物浓度,探讨了毛竹林VOCs对于抑菌、净化空气及人体保健的作用,为毛竹作为森林康养建设树种提供理论依据。
1 研究地概况
研究地位于浙江省湖州市德清县西部莫干山,其地理位置为119°52′E、30°36′N,属亚热带气候,四季分明,雨量充沛,年平均气温13.3℃,年降水量1 893 mm,年均相对湿度81%,年均日照数1 407.8 h。拥有93.5%的绿化覆盖率,植被主体为毛竹。
2 材料及方法
2.1 试验材料
选取长势良好、无病虫害、无机械损伤的毛竹为研究对象,其树龄为2 a,胸径18 cm,高约15 m左右。毛竹林为纯林,土壤类型为红黄壤,郁闭度0.7-0.8。对照地林缘较空旷,无树木影响。
2.2 VOCs采集及分析
单株VOCs采集:2019年5月选择晴朗无风的天气,于上午9∶00-11∶00使用QC-2型大气采样仪采用动态顶空气体循环法采集毛竹单株VOCs。采样选择毛竹中冠层向阳叶片,使用塑料袋将枝叶包裹,采样仪一端用聚四氟乙烯管与塑料袋连接,吸附管插入塑料袋与采样仪另一端相连,形成闭合回路。气体循环流量为100 mL·min-1,采气时间1 h。根据树木平均高度采用5点法选择5株毛竹,每株作为一个独立实验,采集完毕后将袋内叶片剪下,带回实验室烘干后称重。
空气VOCs采集:于2019年5月、8月和11月上午10∶00采用开放式采样法,在距地面1.5 m处采集林内空气VOCs。用聚四氟乙烯管将吸附管连接于采样仪进气口,气体流量为100 mL·min-1,采气时间1 h,共选择5个采样点,每个地点作为1个独立实验,共重复5次。
GC与MS条件:参照GAO等[18]方法设置GC-MS条件。通过TDS-GC-MS技术分析,获得VOCs的总离子流量色谱图后,利用NIST 2008谱库查询,以色谱峰的峰面积计算相对含量,并兼顾色谱保留时间,结合手工检索定性。
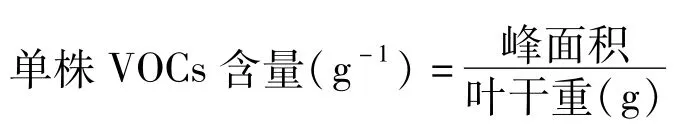
2.3 空气负离子的测定
使用翼鬃麒科技有限公司研发的YZQ-308A森林康养监测系统,分别在春、夏、秋季竹林与林缘选择5个采样点,在高度1.5 m处测定空气负离子浓度,每个采样点监测12 h(6∶00~18∶00),每2 min收集一组数据,选择5组数据取平均值。
2.4 培养基的制备
按照肖明[19]的方法配制细菌培养基(牛肉膏蛋白胨培养基)、真菌培养基(马丁式培养基)和放线菌培养基(淀粉琼脂培养基)。在无菌条件下制备单体基质(罗勒烯、乙酸、癸醛和叶醇;sigma公司生产),在每个标准单体中加入2滴吐温-80,用纯水中稀释100倍、200倍和1 000倍浓度,与培养基混合,单体∶培养基=1∶9。
2.5 微生物的采集
采用自然沉降法[18],分别于春、夏、秋季的上午10∶00在毛竹林内及林缘各设3个采样点,每个采样点重复5次,将带有不同培养基的培养皿置于离地1.2~1.5 m高的平板支架上,打开培养皿盖,采集空气中自然漂浮的微生物(细菌、真菌和放线菌)。培养基在空气中暴露10 min后,将培养皿封好后带回实验室置于25℃恒温培养箱中培养。细菌、真菌、放线菌菌落统计分别在培养24、48和72 h后进行。在林缘进行单体微生物的收集,收集方法和培养方法与林内一致。
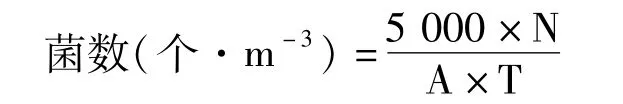
N为培养皿中菌落平均数(个);A为培养皿的面积(cm2);T为打开培养皿皿盖的时间(min)。
2.6 数据处理
所有数据均为5次重复的平均值±标准差。利用Origin 9.0软件进行统计分析和作图。统计方法采用One-Way ANOVA,进行Tukey多重比较(P<0.05)。
3 结果与分析
3.1 毛竹单株挥发物成分分析
对毛竹活体叶片进行TDS-GC-MS分析(图1与表1),扣除空气本底杂质后,从中共检测到35种化合物,主要有醛类、酯类、醇类和萜烯类。醛类物质有8种,约占总VOCs的26.2%,其中主要物质有壬醛(8.2%)、癸醛(5.6%)和辛醛(4.2%)等;酯类约占总VOCs的21.9%,包括薄荷醇水杨酸酯(10.0%)、水杨酸辛酯(6.5%)、6-癸内酯(4.9%)和乙酸丁酯(0.6%);醇类物质有9种,占总VOCs的18.4%,主要物质有正辛醇(5.6%)、叶醇(4.1%)和反式-3-己烯-1-醇(1.8%)等;萜烯类物质共8种,占总VOCs的16.6%,其中主要物质有长叶烯(5.8%)、罗勒烯(3.7%)和罗汉伯烯(3.0%)等。除上述主要物质外,还含有2种酸类物质,其中乙酸含量较高,约占总VOCs的5.5%。
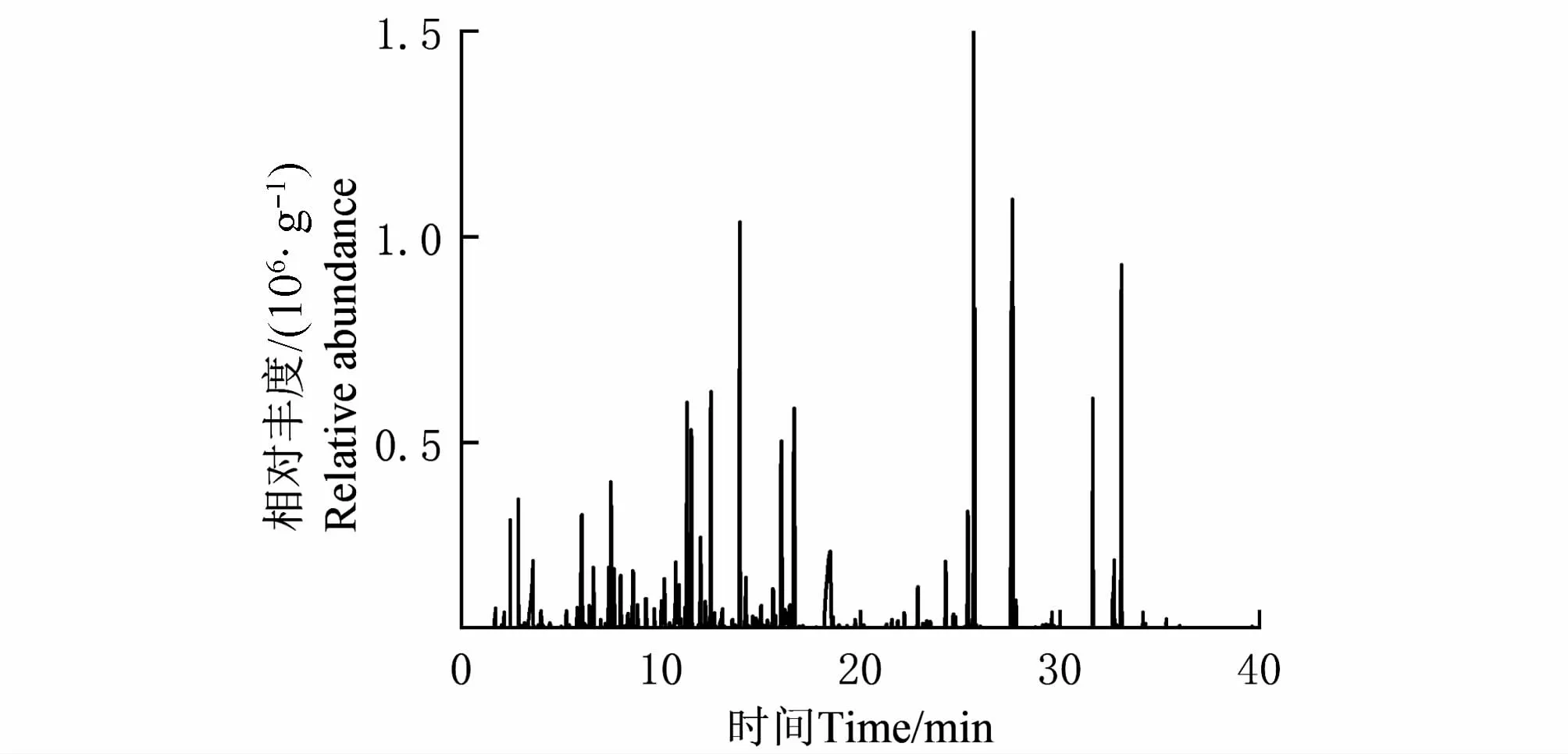
图1 毛竹单株VOCs总离子流图Fig.1 Total ion flow diagram of Ph.edulis VOCs
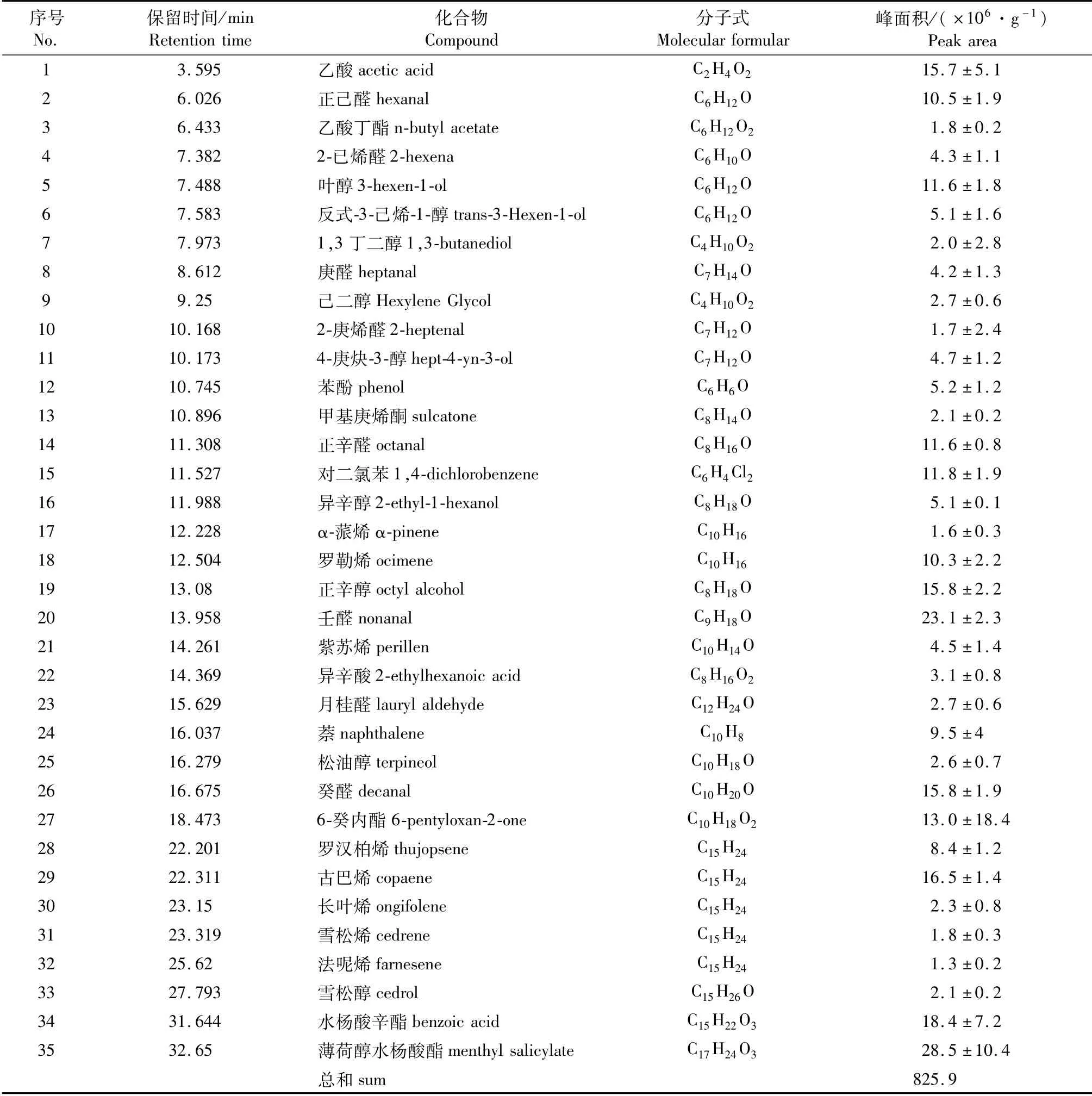
表1 毛竹单株VOCs成分分析Tab.1 Analysis of VOCs composition of individual Ph.edulis
3.2 毛竹林内空气挥发物季节变化分析
对不同季节毛竹林内植物VOCs与林缘相比(图2与表2)发现春、夏、秋季毛竹林内VOCs释放量与种类均高于林缘。不同季节竹林内VOCs种类和相对含量存在差异,主要表现为春、夏季种类多,相对含量高,秋季种类少,相对含量低。春季共鉴定出6类19种化合物,其中芳香化合物有7种,占VOCs总量的36.8%,主要物质为对二氯苯(12.3%)、甲苯(8%);烷烃类物质2种,占VOCs总量的17.7%,主要为有十五烷(16.1%);酸类有3种占VOCs总量的20.7%,主要有乙酸(11.7%)、异辛酸(5.7%)等;醛类有5种占VOCs总量的13.5%,主要有壬醛(4.2%)、癸醛(3.6%)、辛醛(1.9%)等;酯类物质有乙酸丁酯1种占VOCs总量的8.7%;醇类物质为2-乙基己醇,占比(3.7%);萜烯类物质为雪松烯,占比2.5%。夏季共鉴定出7类22种化合物,其中烷烃类物质1种,为十五烷(4.0%);芳香化合物有7种,占VOCs总量的29.1%,主要物质为甲苯(1.7%)、萘(4.5%)等;酯类物质有乙酸丁酯1种占VOCs总量的2.1%;醛类有7种占VOCs总量的24.2%,主要有壬醛(6.1%)、癸醛(6.2%)等;酸类有2种,主要为乙酸,占VOCs总量的16.2%;醇类物质为2-乙基己醇(4.6%)1种;萜烯类物质为α-蒎烯(1.1%)、柏木烯(2.8%)、雪松烯(3.7%),共占比7.6%。秋季共鉴定出4类8种化合物,其中芳香化合物有3种,主要为甲苯,占VOCs总量的18.7%;烷烃有1种,为十五烷(18.5%);醛类有3种,占VOCs总量的55.4%,为壬醛(26.7%)、癸醛(21.9%)、苯甲醛(6.8%);酸类物质有1种,为乙酸(11.8%)。
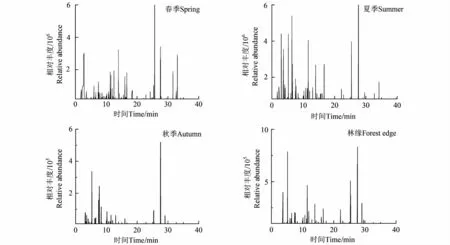
图2 不同季节毛竹林VOCs成分总离子流图Fig.2 Total ion diagram of VOCs of Ph.edulis forest in different seasons
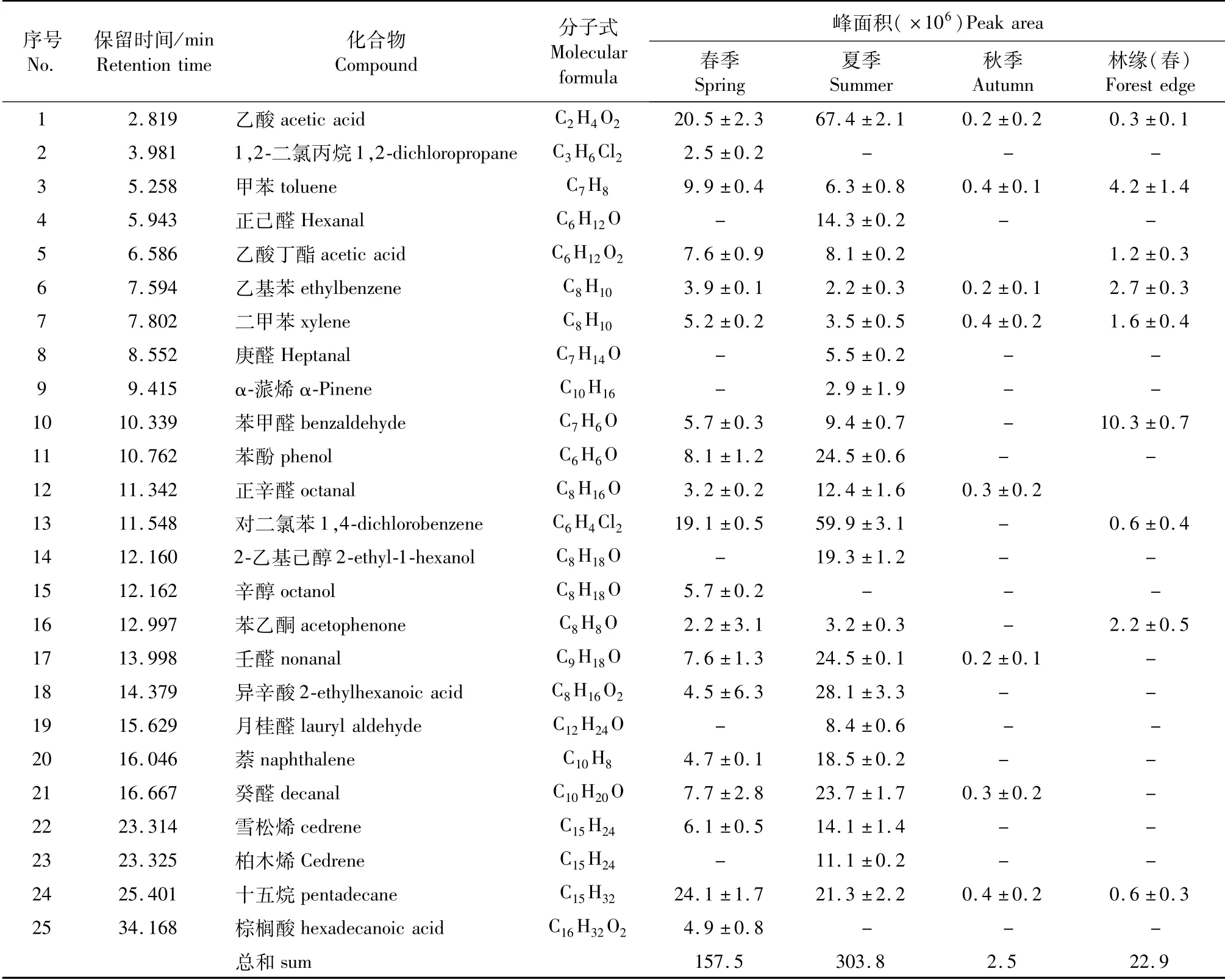
表2 不同季节毛竹林空气VOCs成分变化Tab.2 Air volatile components of Ph.edulis forest in different seasons
3.3 空气负离子的季节变化
分别对春、夏、秋季的林内与林缘处进行空气负离子统计,结果见图3:竹林内NAI有明显的季节变化且浓度远高于林缘。竹林夏季分别比春季和秋季增加了47.8%和72.3%(P<0.05);林缘夏季分别比春季和秋季增加了40.4%和69.9%(P<0.05);春、夏、秋季毛竹林比林缘分别增加了61.9%、84.9%和70.3%(P<0.05)。
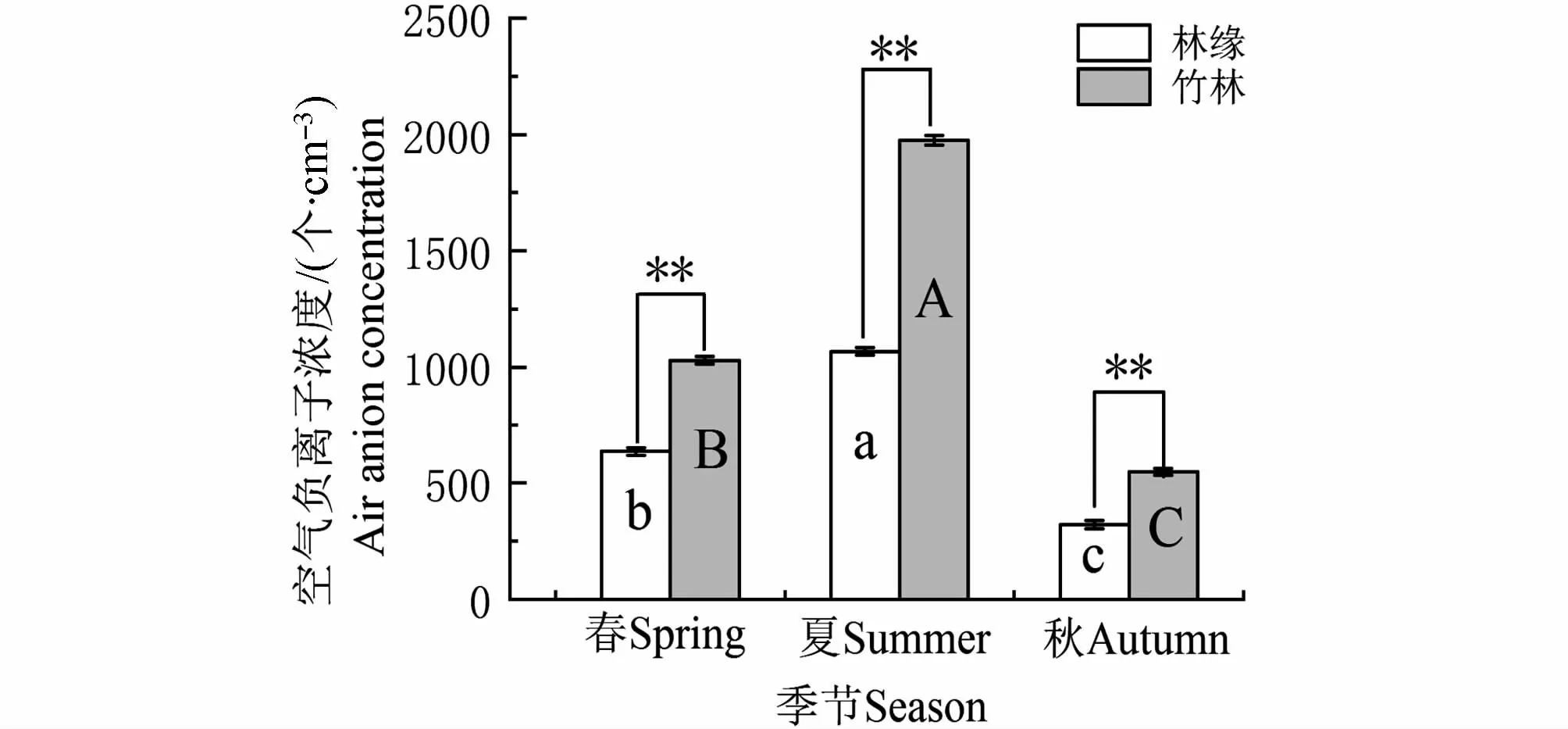
图3 毛竹林空气负离子季节变化Fig.3 Seasonal variation of air anion in Ph.edulis forest
3.4 毛竹林内空气微生物季节变化
如图4所示:春、夏、秋季的实地监测表明,林内微生物浓度在不同季节具有一定的动态变化。不同季节林内细菌浓度均低于林缘。夏季林内细菌浓度与春季相比无明显差异,与秋季相比减少了30.1%(P<0.05);秋季林缘细菌浓度比春、夏季分别增加了30.3%和15.4%(P<0.05);春、夏、秋季林缘细菌浓度比毛竹林分别增加了32.9%、49.0%和20.2%(P<0.05,图4A);夏季林内真菌浓度与春季相比差异不显著,与秋季相比减少了26.9% (P<0.05);秋季林缘真菌浓度比春、夏季增加了44.1%和16.4%(P<0.05);春、夏、秋季林缘真菌浓度比林内分别增加了37.7%、36.8%和16.4%(P<0.05,图4B);夏季林内放线菌浓度与春、秋季减少了22.2%、46.2%(P<0.05);秋季林缘放线菌浓度与春季相比无明显差异,与秋季相比减少了23.5%(P<0.05);春、夏、秋季林缘放线菌浓度比林内分别增加了44.4%、85.7%和30.8%(P<0.05,图4C)。
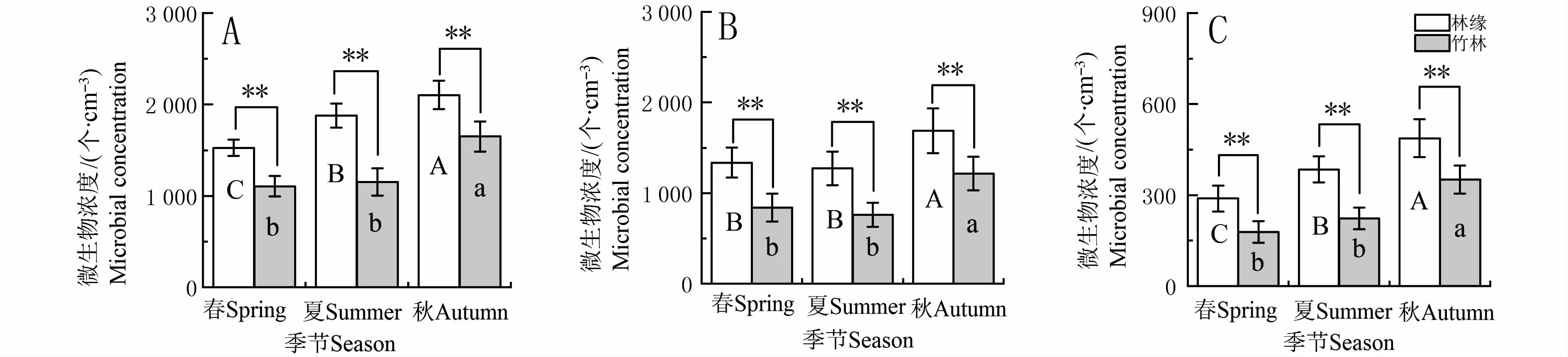
图4 毛竹林微生物季节变化Fig.4 Seasonal variation of microbe in Ph.edulis forest
3.5 单体对空气微生物的影响
选择毛竹单株释放量较高的罗勒烯、乙酸、癸醛、叶醇,将以上4种物质的单体添加进培养液中,观察微生物的生长状况,结果见图5。随含量增多,4种单体对微生物的抑制作用增强。0.1%的罗勒烯对细菌抑制作用显著,抑制率为19.9%(P<0.05);0.5%的罗勒烯,对真菌与放线菌有显著抑制作用,抑制率分别为22.9%、33.3%(P<0.05)。0.1%的乙酸对细菌抑制作用显著,抑制率为32.0%(P<0.05);0.5%的乙酸对真菌与放线菌抑制作用显著,抑制率为26.9%、36.4%(P<0.05)。0.1%的癸醛对真菌抑制作用显著,抑制率为33.6%(P<0.05);0.5%的癸醛对细菌与放线菌抑制作用显著,抑制率为42.4%、22.3%(P<0.05)。0.1%的叶醇对细菌抑制作用显著,抑制率为32.0%(P<0.05);0.5%的叶醇对真菌与放线菌抑制作用显著,抑制率为21.7%、30.3%(P<0.05)。

图5 单体对空气微生物的影响Fig.5 Effect of monomer concentrations on the microorganisms
4 讨论
植物释放VOCs的种类与含量不仅与植物的遗传特性有关,而且与植物所处的生长发育状态及外部环境密切相关[20]。禾本科(Gramineae)、含羞草科(Mimosaceae)、桑科(Moraceae)和杨柳科(Salicaceae)中的多数种属为异戊二烯的释放者,桦木科(Betulaceae)、松科(Pinaceae)和槭树科(Aceraceae)等多释放萜烯类[21]。郭慧媛等[22]研究发现2年生毛竹VOCs中含有大量的2-己烯醛、庚醛、壬醛、癸醛、辛醇等,这与本研究结果一致。光照与温度是植物释放VOCs最为密切的环境因子[23],花圣卓等[24]发现5种典型森林树种的萜烯类化合物释放量随光照的升高而增加,胡立香等[25]发现白皮松VOCs释放高峰出现在夏季。研究发现与林缘相比,毛竹林特有的化合物为醛类与萜烯类,且VOCs总释放量在夏季达到最大,这可能是因为夏季光照较强,气温达到一年中最高,植物进入生长旺盛期,体内化合物合成速率加快,导致叶片释放的VOCs含量在夏季达到最高[26]。除此之外,VOCs的合成与释放还受各自合成酶活性的影响[27],夏季酶活性的增强引起次生代谢物合成速率的增加、光合速率增强,为植物VOCs提供充足的碳源及还原力,同时,强烈的蒸腾作用也为VOCs的扩散创造了有利条件[28]。
VOCs在空气对流层的大气化学过程中起着十分重要的作用,它影响着大气的氧化平衡及气溶胶的形成,空气负离子就是气溶胶粒子的一种。NAI是衡量空气清洁度与生态环境的重要指标,除自然能源辐射形成外,植物光合作用的光电效应及叶片的尖端放电也能有效增加NAI浓度[12]。吴楚材等[29]发现瀑布、水域和植物密度对空气负离子浓度的贡献值最大,从高到低依次为瀑布、水域、草地、其他景观。本研究发现,NAI浓度季节变化与VOCs季节变化一致,均为夏季>春季>秋季且林内浓度高于林缘,这与周德平[30]等研究结果一致。其原因可能是夏季降水增多,太阳紫外线强烈,毛竹叶片的尖端效应使得NAI的浓度升高[31]。另有研究表明,酸与酯类与NAI浓度呈显著正相关[32],夏季毛竹VOCs中的酸类与酯类释放量达到一年内的最大峰值,对NAI的释放及生存起到一定的增加效应。
植物释放的VOCs具有重要的生态学功能,参与植物直接与间接防御反应,同时具有防止病菌及微生物的感染、减少或杀死空气微生物的作用[2]。VOCs活性主要取决于其疏水性,当其与菌丝细胞膜的脂质层相互作用后,导致菌丝形态和结构发生修饰及改变,还会引起细胞膜的通透性改变,继而引起细胞成分的泄露,起到抑制微生物的作用[33]。陆志科等[34]测定毛金竹(Phyllostachysnigra)、毛竹等9种竹子在不同季节活性物质,发现7月采摘的竹叶提取物比5月的抗霉菌、酵母菌的活性更高。本研究结果显示夏季毛竹林的抑菌效果更明显,且3个季节的竹林内抑菌率均高于林缘。已有研究显示,2-己烯醛、苯甲醛和癸醛等醛类有明显的抑制微生物的作用[19,35],毛竹叶片中含有大量黄酮类物质,被证实对微生物有显著的抑制作用[36],竹叶中的酸类及苯酚类化合物对细菌、真菌及酵母菌等的抑制效果也较强[37]。为了进一步探索毛竹VOCs中的具体抑菌物质,选取毛竹单株释放组分较高的罗勒烯、乙酸、癸醛及叶醇来进行单体抑菌试验,发现4种单体对微生物生长均有显著抑制作用,罗勒烯、乙酸与叶醇对细菌有显著的抑制作用,癸醛对真菌有显著的抑制作用。所以,上述4种化单体可能是毛竹VOCs中主要的抑菌物质,毛竹的抑菌作用可能是多种成分协同作用的结果。
综上所述,毛竹释放的VOCs以醛类、酯类、醇类和萜烯类为主,夏季竹林内的VOCs释放量及NAI浓度达到最高,微生物浓度明显降低,癸醛、乙酸、罗勒烯、叶醇可能是叶片释放的的主要抑菌物质。上述结果为进一步探讨毛竹林对于净化空气、人体保健的作用及毛竹作为森林康养建设树种提供理论依据。
