Au NPs修饰TiO2纳米片阵列的制备及光电化学性能研究*
2020-07-09孙焕运李士阔
孙焕运,李士阔
(安徽大学化学化工学院,安徽 合肥 230601)
近些年来,随着日益增长的化石能源消耗和环境污染的加剧,所以人们迫切寻求一种获取能源的新途径,光电转化是一种很有效的途径将太阳能转化为化学能被人类所利用。在光电化学反应体系中,无机半导体纳米材料在能量转化中扮演着重要的作用。例如,TiO2[1],CdS纳米复合材料[2-4],Bi2WO6[5],ZnO纳米复合材料[6],Fe2O3纳米复合物[7-8]等。在众多无机纳米材料中,由于TiO2具有优异的化学稳定性、价廉易得、环境友好等特点,所以人们认为TiO2纳米材料是最具有发展潜力且能够缓解社会环境能源问题的半导体材料之一。但是由于纯TiO2禁带宽度较大(3.2 eV),所以只能够吸收太阳光区的紫外光,其太阳能的利用率较低;而且TiO2的光生电子与空穴的复合率较高,上述缺点严重的限制了TiO2纳米材料在光电转化中的应用。针对上述的缺点目前人们采用不同方式去提高TiO2的光电转化性能。例如,非金属元素掺杂TiO2[9-10]、与窄带隙的半导体复合形成异质结[11-12]、染料敏化作用[13-14]、表面贵金属沉积[15-16]等方式提高光电转化以及储能效率。
表面贵金属沉积是用来提高TiO2纳米片光电转化及储能效率最主要的手段之一。贵金属修饰TiO2半导体材料的表面一般是通过改变二氧化钛纳米材料表面的电子分布来实现的,在TiO2纳米片表面沉积适量的贵金属后,由于贵金属的费米能级低于二氧化钛纳米材料的费米能级,因此二者载流子要重新分布直到两者的费米能级相同。电子在金属上的富集相应地减少了二氧化钛表面的电子密度,从而抑制了电子和空穴的复合,进一步提高光电转化和储能效率[17-19]。与此同时,表面沉积贵金属也能够将光响应区域从紫外区域扩展到可见光区,增加了复合材料的光吸收,提高太阳光的利用率[20-21]。
因此,我们在Ti片上通过水热法制备了Ti纳米片阵列后在马弗炉里煅烧得到TiO2纳米片阵列,随后进行表面贵金属沉积,得到最终产物Au-TiO2-Ti。在200 W/cm2,0.5 V vs. Ag/AgCl 条件下,光电流密度可达到0.38 mA/cm2,并且取得优异的稳定性,为光电化学能源转化奠定了良好的基础。
1 实验试剂及仪器
1.1 实验试剂
钛片、丙酮,上海化学试剂有限公司;无水乙醇,国药集团化学试剂有限公司;氢氧化钠,国药集团化学试剂有限公司;聚乙烯吡咯烷酮(PVP K30),国药集团化学试剂有限公司;盐酸,国药集团化学试剂有限公司;乙二醇,国药集团化学试剂有限公司;氯金酸,阿拉丁试剂有限公司。所有试剂纯度都是分析纯,使用时未经过二次提纯。
1.2 仪 器
DX-2700粉末X射线衍射仪,丹东浩元仪器有限公司;U-3900紫外可见分光光度计,日本日立公司;S-4800扫描电子显微镜(加速电压为5 kV),日本日立公司;CEL-HXF300氙灯光源,北京中教金源科技有限公司;X 射线光电子能谱(ESCALab MK Ⅱ),美国PE公司;KQ-800KDV超声清洗器,昆山市超声仪器有限公司;CHI660E电化学工作站,上海辰华仪器有限公司;PP21电化学工作站,德国 Zahner电化学公司;YFX3/13Q-YC马弗炉,上海意丰电炉有限公司。
1.3 光阳极Au-TiO2-Ti的制备方法
首先将1×3 cm2钛片依次用丙酮、无水乙醇超声清洗5 min,用去离子水清洗后干燥,置于100 mL聚四氟乙烯反应釜内胆中,向其中加入5 mL 1 M NaOH溶液和25 mL去离子水,将反应釜置于烘箱中220 ℃保温6 h。冷却后将钛片置于1 M 盐酸中浸泡10 min,用去离子水冲洗干净并干燥,金属光泽的钛片表面变为蓝灰色。然后进行热处理,将钛片放在坩埚中,置于马弗炉,设置升温速率2 ℃/min,升温至600 ℃,煅烧处理3 h,得到钛片(TiO2-Ti)。冷却至室温后取出,钛片表面变为天蓝色。再用28 mL去离子水和10 mL乙二醇混合溶液,加入0.2 g PVP,磁力搅拌使PVP完全溶解得到PVP溶液。将上一步得到的钛片(TiO2-Ti)放置于聚四氟乙烯反应釜中,PVP溶液倾倒入反应釜,然后用移液枪移取2 mL,3 mM的氯金酸溶液加入到反应釜中。将反应釜置于烘箱180 ℃保温3 h。冷却至室温,取出钛片用去离子水冲洗,并在去离子水中浸泡1 h。最后得到紫红色的钛片(Au-TiO2-Ti)。
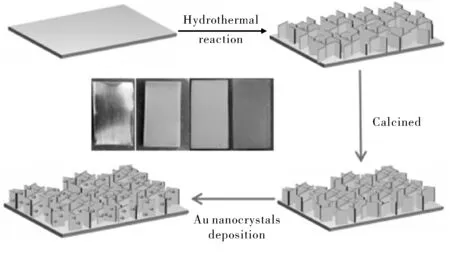
图1 Au-TiO2-Ti制备流程图
1.4 光电化学性能测试
以样品TiO2-Ti纳米片(或Au-TiO2-Ti纳米复合物)作为光阳极,饱和Ag/AgCl为参比电极,铂片电极为对电极,电解液为1 M KOH溶液构成三电极体系,用来检测样品的光电化学分解水性能。电化学工作站用来测试LSV曲线,扫描速率设定为10 mV/s,300 W氙灯和AM1.5过滤器模拟太阳光作为光源,光强密度为200 mW/cm2,记录光阳极浸没于电解液中受光照的面积以计算光电流密度。以提供光照或遮蔽光照的周期10 s,来模拟非连续太阳光照测定LSV曲线反应其光响应性。稳定性测试是在偏压0.5 V vs. Ag/AgCl,光照强度为200 mW/cm2的光照条件下测定I-t曲线。
2 结果与讨论
2.1 产物形貌分析
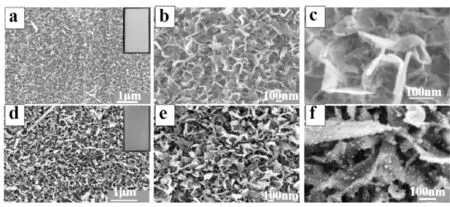
图2 样品TiO2-Ti (a~c)和Au-TiO2-Ti (d~f)的SEM图片
如图2a所示,Ti片经过煅烧后,在其表面均匀生长一层TiO2纳米片,见图2b,2c是其放大倍数的扫描电镜图。图2d为氯金酸溶液与TiO2-Ti反应之后的低倍扫描图,与图2a相比,可以发现其纳米片结构没有明显变化。图2f与图2c相比,TiO2-Ti纳米片阵列的表面沉积了大量的Au NPs。
2.2 产物物相分析
为了确定通过上述步骤所合成的纳米复合物是最初设想的Au-TiO2-Ti的结构组成,对最终产物进行了物相结构分析。图3a是所合成产物的XRD图谱,对比PDF卡片数据库确定有TiO2物相的特征吸收峰,根据TiO2XRD特征吸收峰,可以说明我们合成的复合物TiO2纳米片的物相是由锐钛矿型和金红石型两种混合晶型组成。但是在XRD衍射峰中并没有发现Au的XRD衍射峰,分析主要原因可能是Au NPs在合成的产物样品中含量太低所以没有检测到其衍射峰的存在。为了更好的证明Au元素的存在,对产物进行EDS元素分析如图3b所示,扫描结果可以确定产物中含有Au元素的存在,而且根据EDS元素含量分布显示Au元素原子占比仅为0.95%,与上述不能够在XRD中检测到Au物相衍射峰的存在结果相吻合。因此通过XRD和EDS对产物进行物相分析可以确定成功合成了Au-TiO2-Ti复合物。
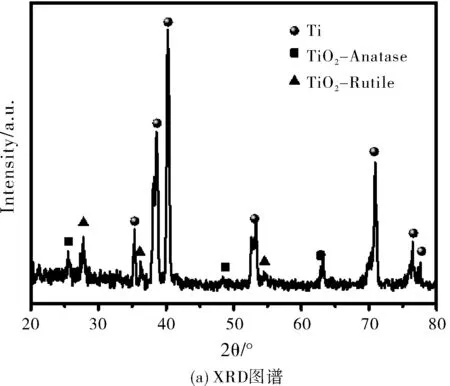
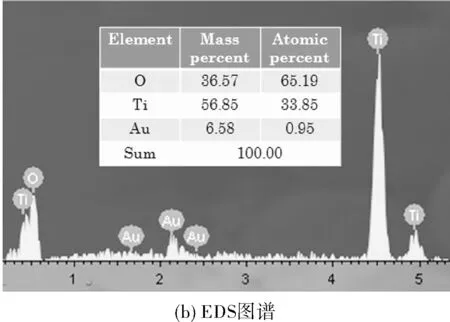
图3 样品Au-TiO2-Ti的结构组成分析
2.3 产物光吸收性能分析
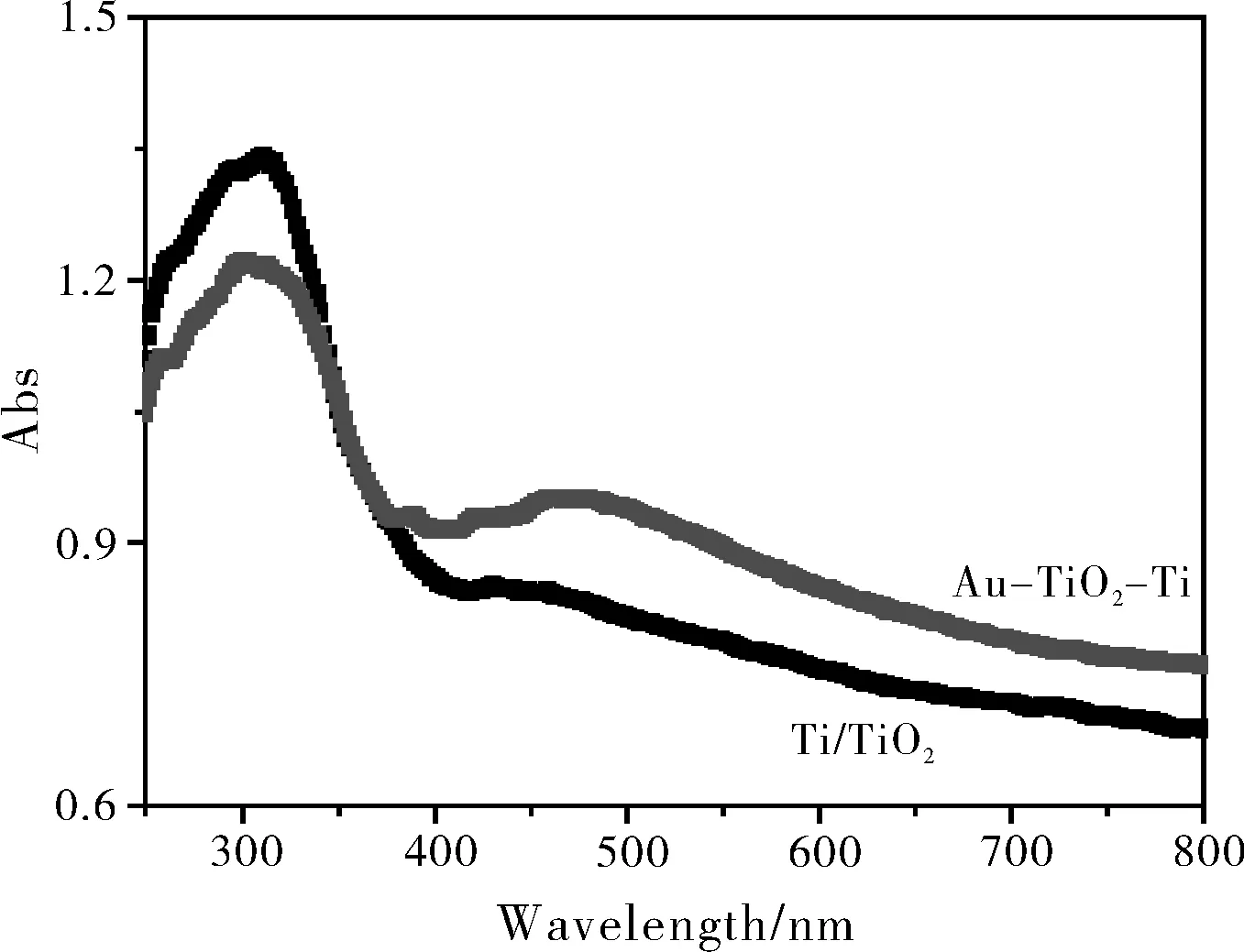
图4 TiO2-Ti和Au-TiO2-Ti的UV-Vis吸收图谱
对TiO2-Ti纳米片表面沉积Au NPs前后的样品进行紫外可见光吸收性能的分析,如图4所示,TiO2-Ti纳米片在未沉积Au NPs其吸收波长主要在紫外光区(380 nm以下),在可见光区具有很弱的光吸收,当在TiO2-Ti纳米片表面沉积适量Au NPs后形成Au-TiO2-Ti复合物样品在可见光区域光吸收明显增强,表明在TiO2-Ti纳米片表面修饰贵金属Au NPs后拓宽了TiO2-Ti纳米片可见光的光谱响应范围。对于Au-TiO2-Ti纳米复合物,紫外区域的光学吸收部分主要是由TiO2-Ti纳米片的吸收,其吸收峰面积相对降低,是因为Au NPs富集在TiO2-Ti纳米片样品上使TiO2-Ti的有效光吸收面积减小导致其吸收峰强度降低;Au-TiO2-Ti在480 nm处有明显的特征吸收峰,此峰主要是由于Au NPs的表面等离子共振所引起。固体紫外图可以说明在TiO2-Ti纳米片表面沉积Au NPs可以增加TiO2-Ti纳米片在可见光区的光吸收。
2.4 光电化学性质
图5a所示,随着光照强度的增加光电流密度不断增加,在300 W光照下,电压为2.0 V vs. Ag/AgCl时,光电流密度高达1.3 mA/cm2。在氙灯光强为200 mW/cm2的条件下进行LSV曲线测试,由图5b可以看出Au-TiO2-Ti 光电流密度明显高于TiO2-Ti光电流密度,两者暗电流几乎相同。 在光强为200 mW/cm2,偏压为0.5 V vs. Ag/AgCl 的条件下测试沉积AuNPs前后的TiO2-Ti纳米片的光电流密度,如图5c所示,持续光照8 h,Au-TiO2-Ti纳米复合物的光电流密度大约为0.38 mA/cm2,是TiO2-Ti纳米片光电流密度的两倍,而且光电流密度不随光照时间增加而减弱,表明合成的Au-TiO2-Ti复合物纳米材料具有优异的稳定性,能够长时间高效稳定地进行光电化学分解水。如图5d所示,持续光照8 h前后的Au-TiO2-Ti纳米复合物的 LSV曲线,基本吻合,表明了Au-TiO2-Ti纳米复合物具有优异的稳定性。
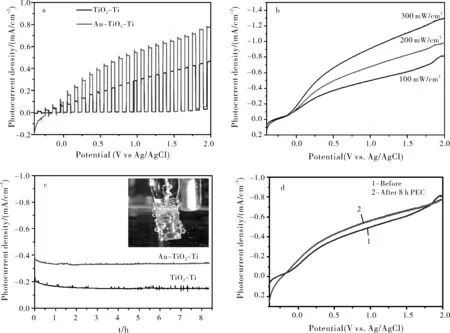
图5样品的光电化学性质表征
图 6更加直观地表明在TiO2-Ti纳米片阵列上负载Au NPs 前后光电催化分解水的性能的变化。如图 6a所示,Au-TiO2-Ti与TiO2-Ti纳米片相比较,其光电转化效率有明显的提高,证明Au NPs的负载确实能够增加光电化学分解水性能。样品光电转换效率可由光电流曲线通过下面的公式计算得到:
η=I(1.23-VRHE)/Jlight
式中:VRHE是相对于标准氢电极的偏压,V;I是在相应偏压下的光电流密度,mA/cm2;Jlight是入射光光强,mW/cm2。
如图6b所示,Au-TiO2-Ti纳米复合物的光电流达到0.027 mA·cm-2(λ>420 nm)与TiO2-Ti纳米片结构的光电流相比有明显的提高,表明AuNPs的负载确实能够增加材料在可见光区的光响应。为了更好的证明Au NPs负载量对光电催化性能的影响,我们制备了TiO2纳米片阵列上负载不同含量Au NPs的对比材料,根据图6c所示,氯金酸加入量为2 mL时样品的光电流密度最大。图6d明显可以看出复合Au-TiO2-Ti纳米片的电化学阻抗的圆弧半径要远远小于TiO2纳米片阵列的圆弧半径,说明所制备的复合Au-TiO2-Ti纳米片电化学阻抗远远小于没有复合的TiO2-Ti纳米片的电化学阻抗,证明复合后的纳米结构降低了电阻增加了电子传导,有助于光电化学中电子和空穴的分离,增加光电化学分解水的性能。
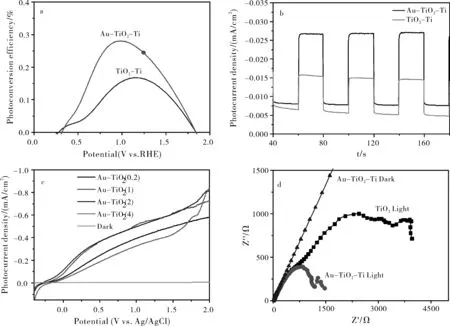
图6 负载Au NPs 前后TiO2-Ti纳米片阵列上光电催化分解水的性能的变化
3 结 论
我们通过在TiO2-Ti纳米片表面沉积贵金属Au NPs,增加了材料的光吸收。在200 mW/cm2光照强度,电压为0.5 V vs. Ag/AgCl下光电流密度达到 0.38 mA/cm2,光照8 h后光电流密度基本没有变化展现出优异的稳定性,除此之外Au和TiO2纳米片阵列形成Schotky势垒抑制电子空穴对复合,从而提高光电转换效率。
