丝裂原活化蛋白激酶4通过激活AKT促进宫颈癌细胞增殖
2020-07-09赖丽梨段华英邹争志
赖丽梨,段华英,邹争志
(1.广州市增城区人民医院妇产科, 广州 511300; 2.广州医科大学附属第二医院妇产科, 广州 510260;3.华南师范大学生物光子学研究院激光生命科学教育部重点实验室, 广州 510631; 4.华南师范大学生物光子学研究院, 广东省激光生命科学重点实验室, 广州 510631)
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一个能被不同的细胞外刺激激活的丝氨酸-苏氨酸蛋白激酶家族,细胞外的因素包括细胞生长因子、神经递质、激素、细胞应激及细胞黏附。MAPK信号通路是真核生物信号传递网络中的重要途径之一,在基因表达调控和细胞功能活动中发挥着关键作用。经典的MAPK家族可分为ERK、p38、JNK和ERK5 4个亚族。已知MAPK这4个家族成员在细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理/病理过程中发挥着重要的作用。MAPK家族的过度激活在多种肿瘤中被发现,MAPK的激活与肿瘤细胞的增殖、转移和迁移有重要关系[1]。MAPK4是MAPK家族的一个非典型的成员,关于MAPK4的生物学功能以及与疾病的关系,目前报导的很少。有研究发现,MAPK4能够通过调节MAPK5的功能去影响细胞的增殖[2]。最近的研究发现,MAPK4在前列腺癌中过表达,干扰MAPK4的表达显著地抑制了癌细胞的增殖和锚定依赖的增长。同时,在小鼠体内的研究也发现,抑制MAPK4活性能够显著地抑制移植瘤的生长[3]。通过研究MAPK4诱导肿瘤形成的分子机制,他们发现MAPK4通过激活mTOR信号通路去诱导肿瘤的发生发展。最近在骨髓瘤研究中,Feng等[4]发现MAPK4在肿瘤进展中起了重要作用,同时也发现,CircRNA circ_0000190通过调控miR-767-5p抑制了MAPK4的表达,从而抑制骨髓瘤的发展。
经典的MAPK家族在宫颈癌中的研究已有一些报导,然而MAPK4在宫颈癌中的作用,目前尚没有研究报导。在本研究中,我们发现MAPK4能够激活宫颈癌细胞HeLa和SiHa中的蛋白激酶B(protein kinase B,AKT,又称PKB)信号,进一步发现MAPK4的表达与宫颈癌细胞的增殖显著相关。
1 材料与方法
1.1 试剂
DMSO购买于Sigma公司,MAPK4抗体购买于Abcam公司,p-AKT-Ser473、AKT和Actin抗体购买于Cell Signalling Technology公司,siRNA合成于上海吉玛公司,LipofectamineTM3000、CCK8检测试剂盒、胰蛋白酶消化液购买于Thermo Scientific公司。MAPK4过表达质粒由本课题组构建。
1.2 细胞培养
人宫颈癌细胞系HeLa和SiHa(购于中科院上海细胞库),培养采用含10%胎牛血清(Gbico)的DMEM培养基,置于37 ℃、5%CO2、饱和湿度的细胞培养箱中常规培养,经检测培养箱无支原体污染[5]。
1.3 细胞增殖检测
取对数生长期细胞,用胰酶消化后稀释成每毫升5×104个细胞的悬液接种于96孔板中,每孔200 μL(即10 000个细胞)。在37 ℃、5%CO2培养箱中培养,分别培养至24、48、72及96 h,按照CCK8检测试剂盒说明书流程在上述时间点完成细胞增殖检测。简单的流程如下:试验中止前4 h加入CCK8液20 μL,再培养4 h,在酶联检测仪上检测450 nm 波长下每孔的吸光度OD(optical density)值,按下列公式求出细胞活力。细胞活力(cell viability)=(干扰或过表达MAPK4组平均OD值/对照组平均OD值)×100%[6]。
1.4 GSCA分析细胞系mapk4基因表达
通过在线软件GSCA(http://bioinfo.life.hust.edu.cn/web/GSCALite/)[7],分析mapk4基因在已经检测过的癌细胞系中mRNA的表达水平。根据mapk4基因的表达水平,选取了表达相对高的宫颈癌细胞HeLa和表达相对低的宫颈癌细胞SiHa。
1.5 细胞转染
mapk4的siRNA干扰片段序列如下:5′-GGGU GAGCUGUUCAAGUUCTT-3′。对照序列(negative control,NC):5′-UCCGUUUCGGUCCACAUUC-3′。转染时根据LipofectamineTM3000说明书,用适量无血清培养液将siRNA(终浓度100 nmol/L)或MAPK4过表达质粒(6孔板中每孔加入2 μg)与LipofectamineTM3000混匀,然后加入到细胞中,8 h后换为含10%胎牛血清培养液继续培养,在转染后48 h内完成免疫印迹试验,在转染后96 h内完成细胞增殖检测[8]。
1.6 免疫印迹
将处理过的细胞用胰酶消化收集,用预冷的PBS洗3遍,加入适量裂解液(50 mmol/L Tris-HCl pH 8.0、150 mmol/L NaCl、1%Triton X-100、1 mmol/L Na3VO4、100 mmol/L PMSF)在冰上裂解30 min,用移液枪反复吹打40次,避免产生气泡。12 000 r/min离心15 min,收集上清蛋白液。采用10%~12%SDS-聚丙烯酰胺凝胶电泳,然后转移到聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,转膜完成后,用5%奶粉液或5%的牛血清白蛋白(bovine serum albumin,BSA)在室温封闭1 h,之后分别在4 ℃孵育一抗12 h,在室温孵育二抗1 h。ECL(electrochemiluminescence)底物显色,A、B液以1∶1的体积比例混合,用滤纸将膜表面液体吸干,加ECL底物显色液,放入暗盒中并压片,5 s~5 min后显影、定影[9]。
1.7 统计学分析
统计学方法数据均采用SPSS16.0软件进行统计学分析,所有试验重复3次,均为独立试验,计量资料采用均数±标准差表示,数据的比较分析采取student’t检验分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 mapk4在癌细胞系中的差异表达
为了评估mapk4在肿瘤细胞系中的表达, 通过GSCA在线软件,在12个组织类型共65种肿瘤细胞系中,我们分析了mapk4的mRNA水平。
如图1a所示,mapk4在肺癌细胞SCLC-21H中表达最高,其次是宫颈癌细胞HeLa。本研究选取了mapk4高表达的HeLa细胞和mapk4表达相对低的宫颈癌细胞SiHa作为研究的细胞模型。首先,通过RT-PCR试验,我们在这两个宫颈癌细胞中验证了mapk4的表达,如图1b所示,发现相对于HeLa细胞,SiHa细胞中mapk4的mRNA表达显著降低。接下来,我们通过Western blot试验,在这两个细胞系中进一步验证MAPK4蛋白的表达水平。如图1c所示,与mapk4的mRNA表达结果一致,MAPK4的蛋白表达在HeLa细胞中显著高于SiHa细胞。
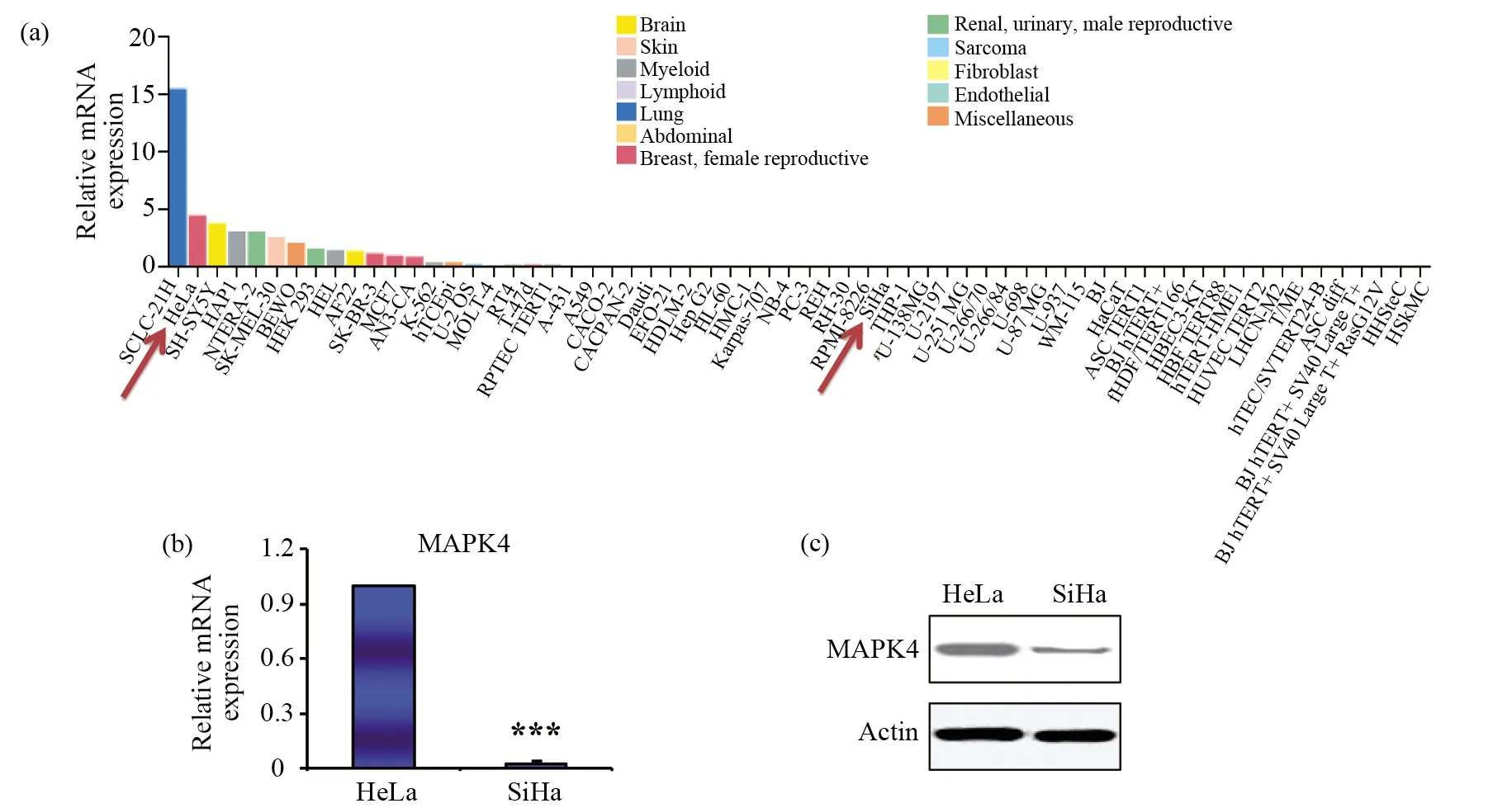
图1 mapk4在癌细胞系中的差异表达Fig.1 Expression of mapk4 mRNA in cancer cell lines(a)通过在线软件GSCA(http://bioinfo.life.hust.edu.cn/web/GSCALite/)[8]分析mapk4在已经检测过的癌细胞系中mRNA的表达水平;(b)通过RT-PCR检测HeLa和SiHa细胞中mapk4的mRNA水平。*** P<0.001,显示有统计学显著差异;(c)通过Western blot检测HeLa和SiHa细胞中MAPK4的蛋白水平。Actin作为内参蛋白(a)The mapk4 mRNA levels of cancer cell lines are obtained from GSCA database(http://bioinfo.life.hust.edu.cn/web/GSCALite/);(b) mapk4 mRNA levels were detected by RT-PCR in HeLa and SiHa cells. *** P<0.001 indicates significant difference;(c)MAPK4 protein levels were detected by Western blot in HeLa and SiHa cells. Actin serving as loading control
2.2 MAPK4表达影响宫颈癌细胞增殖能力
MAPK家族蛋白在促进细胞增殖过程中起了重要作用。为探索MAPK4是否与宫颈癌细胞的增殖能力相关,本研究选取了MAPK4表达相对高的HeLa细胞,通过转染mapk4的siRNA完成了MAPK4敲低试验,并通过CCK8(cell counting kit-8)试验检测了细胞的增殖能力。如图2a所示,在转染了mapk4的siRNA后,MAPK4的蛋白表达显著降低。细胞活力试验也表明,干扰MAPK4后,细胞的增殖能力显著降低,具体见图2b。同时,我们选取了MAPK4相对表达低的SiHa细胞,在细胞中转染MAPK4的过表达质粒,然后通过CCK8试验检测了细胞的增殖能力。如图2c所示,在转染了MAPK4的过表达质粒后,MAPK4的蛋白表达显著升高。细胞活力试验也表明,高表达MAPK4蛋白后,细胞的增殖能力显著增强(图2d)。以上结果表明,抑制MAPK4表达能够抑制细胞的增殖能力,而促进MAPK4蛋白表达能够增强宫颈癌细胞的增殖能力。这些都说明在宫颈癌中MAPK4可能和肿瘤细胞的增殖能力有关。

图2 MAPK4表达影响宫颈癌细胞增殖能力Fig.2 MAPK4 expression is associated with cell proliferation in cervical cancer cell lines(a)在HeLa细胞中转染mapk4的siRNA 48 h后,通过Western blot检测MAPK4的表达,Actin作为内参蛋白;(b)在HeLa细胞中转染mapk4的siRNA 48 h后,通过CCK8试验检测图中所示时间点的细胞增殖能力;(c) 在SiHa细胞中转染MAPK4过表达质粒48 h后,通过Western blot检测MAPK4的表达,Actin作为内参蛋白;(d)在SiHa细胞中转染MAPK4过表达质粒48 h后,通过CCK8试验检测图中所示时间点的细胞增殖能力。NC:阴性对照;Ctrl:对照。*** P<0.001,显示有统计学显著差异(a)HeLa cells were transfected MAPK4 siRNA, after 48 h, MAPK4 were detected by Western blot,Actin serving as loading control;(b) HeLa cells were transfected MAPK4 siRNA, after 48 h, cell viability was detected by CCK8 assay at the time points shown in the figure;(c)SiHa cells were transfected MAPK4-overexpressed plasmid. After 48 h, MAPK4 was detected by Western blot. Actin serving as loading control;(d)SiHa cells were transfected MAPK4-overexpressed plasmid, after 48 h, cell viability was detected by CCK8 assay at the time points shown in the figure. NC:negativecontrol;Ctrl:Control. *** P<0.001indicates significant difference
2.3 在宫颈癌细胞中MAPK4促进了AKT的活性
以上的试验研究结果表明,MAPK4促进了细胞的增殖能力,然而其下游的分子机制尚不清楚,因此,接下来我们探索了MAPK4下游与细胞增殖可能相关的蛋白。在肺癌细胞中的研究发现MAPK4激活了AKT信号,因此,在本研究中我们探讨了MAPK4在宫颈癌细胞中是否也能激活AKT。我们同样地选取了MAPK4表达相对高的HeLa细胞,通过转染mapk4的siRNA完成了MAPK4敲低试验。接下来,通过Western blot试验检测了AKT的活化形式磷酸化AKT(p-AKT-Ser473)的表达。如图3a所示,在转染了mapk4的siRNA后,MAPK4的蛋白表达显著降低,同时p-AKT-Ser473的表达水平也显著降低。同时,我们选取了MAPK4表达相对低的SiHa细胞,通过转染MAPK4的过表达质粒,检测了p-AKT-Ser473的表达水平。如图3b所示,在转染了MAPK4的过表达质粒后,MAPK4的蛋白表达显著升高,同时p-AKT-Ser473的表达水平也显著上升。以上结果表明,抑制MAPK4表达能够抑制AKT的活性,而促进MAPK4表达能够增强AKT的活性。这说明在宫颈癌中MAPK4可能通过激活AKT增强了肿瘤细胞的增殖能力。

图3 在宫颈癌细胞中MAPK4促进了AKT的活性Fig.3 MAPK4 activates AKT in cervical cancer cells(a)和 (b)在宫颈癌细胞HeLa和SiHa中,分别转染mapk4的siRNA和MAPK4过表达质粒,48 h后通过Western blot检测MAPK4和p-AKT-Ser473的表达。AKT作为p-AKT-Ser473的内参蛋白,Actin作为总的内参蛋白(a) and (b) HeLa and SiHa cells were transfected mapk4 siRNA and MAPK4-overexpressed plasmid respectively, after 48 h, MAPK4 and p-AKT were detected by Western blot. AKT serving as loading control for p-AKT, Actin serving as loading control for total protein
3 讨论
在全世界宫颈癌是女性第三常见的癌症[10]。随着筛选方法的不断改进以及发达国家的疫苗接种计划,发达国家与资源匮乏的发展中国家的妇女在宫颈癌发病率方面差异越来越显著[11]。目前,大于85%的宫颈癌死亡发生在中低收入人群的国家。已知宫颈癌的发生与人乳头瘤病毒(human papilloma virus,HPV)感染显著相关,然而在没有感染HPV的人群中也有一部分人会发展为宫颈癌[12],这可能和遗传以及病毒之外的环境因素有关。现已有研究表明,一些原癌基因的突变能够引起宫颈癌的发生,因而靶向抑制这些癌基因对宫颈癌的治疗有潜在的价值[13]。在本研究中,我们发现MAPK4促进了宫颈癌细胞的增殖,因而MAPK4可以作为宫颈癌治疗的潜在靶点。但本研究我们仅用到了2个宫颈癌细胞系验证MAPK4促进宫颈癌细胞增殖,缺乏动物试验的结果。因此,下一步需要构建动物模型,在体内验证MAPK4促进了宫颈癌的增殖,同时,也需要在临床组织标本中检测MAPK4的表达是否与病人的预后相关。
在大多数人类肿瘤中,AKT蛋白是最常见的、活化的癌基因产物。AKT活化的主要机制包括2个主要途径:一是通过肿瘤抑制基因pten突变,从而使PTEN失活,PTEN是AKT的一个抑制蛋白,因此PTEN突变的失活会导致AKT的过度激活;二是PI3K酶活性亚基的活化突变,pi3k是AKT蛋白的直接上游基因,PI3K能够直接磷酸化激活AKT,因此PI3K的突变激活能够促进AKT的过度激活[14,15]。最近越来越多的证据表明,除了上述两条途径外还有一些蛋白的表达和活性失调也影响了AKT的活性。比如ras基因突变导致Ras蛋白的过度活化也直接影响了AKT的活性,另外,akt基因自身的突变也是导致其过度活化的原因,如发生在AKT蛋白的pH功能区E17位的突变[16]。akt基因的扩增导致AKT蛋白的过度表达也是AKT过度活化的原因之一。在本研究中,我们发现MAPK4过表达能够激活AKT的活性,然而具体的分子机制仍然不清楚。MAPK4是否直接与AKT相互作用,从而磷酸化AKT?还是通过激活一个中间分子间接激活AKT?这其中的分子机制还有待进一步研究。最近在肺癌的研究报道中发现MAPK4激活了AKT的活性,然而关于MAPK如何激活AKT活性的具体机制并未阐明。AKT促进细胞的增殖主要涉及以下几种机制:1)抑制细胞周期抑制蛋白p27表达,p27蛋白能够与细胞周期相关蛋白激酶(cyclin-dependent kinases,CDK)结合,从而抑制CDK的活性,进而阻止细胞周期的进展[17];2)促进细胞糖代谢,为细胞分裂增殖提供营养[18];3)抑制GSK3β的活性,GSK3β能够促进细胞周期蛋白cyclinD1的降解,从而使细胞周期从G1向S期转化受到阻止,而AKT能够抑制GSK3β的活性,因此促进了cyclinD1的表达,从而加速细胞周期从G1向S期转化[19]。本研究中我们发现MAPK4激活了AKT,然而并没有检测AKT下游促进细胞增殖的信号。因此,在接下来的研究中,需要进一步检测AKT下游的信号是否受MAPK4的影响。
总之,本研究发现MAPK4促进宫颈癌细胞的增殖,这表明在宫颈癌中靶向抑制MAPK4能够抑制宫颈癌的进展,MAPK4可以作为宫颈癌治疗的潜在靶点。
