CLP脓毒血症模型肝组织损伤芯片中差异基因及潜在通路分析
2020-07-09王永祥张子建刘如石黄云鹏
王永祥,张子建,刘如石,熊 力,刘 锴,黄云鹏,阳 杨,陈 丹,文 宇*
(1.中南大学湘雅二医院普外科, 长沙 410011; 2.湖南师范大学医学院, 长沙 410006;3.珠海市人民医院急诊科, 珠海 519000)
脓毒血症是一种可以导致严重的多器官功能障碍综合征的致死性临床疾病。虽然现代医学在抗生素治疗、呼吸机管理、复苏策略和血糖维持等方面的快速发展大大提高了脓毒血症的预防、诊疗水平,但严重的脓毒血症仍是各临床科室面临的最棘手的问题之一[1]。脓毒血症早期被简单地定义为病原体引起的全身炎症反应综合征,但近年来脓毒血症被认为是宿主对包含感染、创伤、应激在内的各类反应失调引起的器官功能障碍[2]。有资料显示,多器官功能障碍在脓毒血症患者并发症中占40%~60%,普通抗感染治疗和支持治疗难以有效预防器官衰竭,因此治疗效果不佳[3]。脓毒血症可继发于多种疾病,在腹部外科中,外科手术、肝脓肿、胆管炎、重症胰腺炎等均可诱发炎症反应过度活化、免疫系统紊乱、凝血功能障碍,继而导致脓毒血症[4-6]。因此,针对腹部外科的脓毒血症防治尤为重要。也正是如此,脂多糖(1ipopolysacharide,LPS)或盲肠结扎穿刺术(cecal ligation and puncture,CLP)常被作为脓毒血症经典模型来研究。本文旨在对大鼠、小鼠CLP脓毒血症模型进行分析[7],从模式动物的角度发现脓毒血症造成肝脏组织损伤的潜在基因和调控网络,为脓毒血症肝损伤早期的精准诊段和基因靶向治疗提供理论依据。
1 材料与方法
本研究首先从NCBI-Gene Expression Omnibus数据库(NCBI-GEO)下载2个原始微阵列数据集GSE1781,GSE510(https://www.ncbi.nlm.nih.gov/geo),共列入6例(GSM2405、GSM2406、GSM2407、GSM30472、GSM30473、GSM30474)CLP脓毒血症模型和6例(GSM30469、GSM30470、GSM30471、GSM2402、GSM2403、GSM2404)假手术组数据[8,9]。接着使用R软件(version 3.6.2)对高通量功能基因组表达的原始数据(小鼠Clontech Atlas Mouse cDNA Expression Array;大鼠Affymetrix Rat Expression 230A Array)进行标准化处理,通过limma包筛选了差异基因(different expression genes,DEGs),将统计学上显著的DEGs定义为P<0.05和[log2FC]>0.56作为截止标准,其中FC(fold change)为差异倍数。随后基于基因本体论和通路富集,通过DAVID (https://david.ncifcrf.gov/)和KEGG pathway(http://www.genome.jp/kegg)数据库分析筛选DEGs。为确定脓毒血症肝损伤模型中功能、通路的潜在网络关系,进一步使用蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络,通过模块分析整合了重要候选基因和通路。首先,使用在线数据库String(http://string-db.org)获取DEGs编码的蛋白质-蛋白质相互作用的网络信息。其次,基于上述信息的关联程度,使用Cytoscape软件构建蛋白质相互作用的关系网络,并通过MCODE(molecular complex detection)模块分析脓毒血症中编码蛋白质的候选DEGs的相互作用关系,使用网络分析器插件来计算节点度,筛选具有重要生理调节功能的核心蛋白质和关键候选基因,为脓毒血症早期诊断以及个体化的预防和治疗提供更准确、实用的生物标记。
2 结果与分析
2.1 大鼠脓毒血症肝组织损伤芯片差异基因分析
利用大鼠构建CLP脓毒血症模型和假手术模型,留取对应肝组织进行差异基因芯片检测。通过筛选获得350个1.5倍及以上的上调表达基因(Log2FC≥0.56,P<0.05),其中170个基因上调2倍及以上(Log2FC≥1,P<0.05),17个基因(Lcn2,Ntf3,Pla2g2a,LOC100911545///A2m,Spink3,Lss,Spink3,Atpif1,Arpp21,Lss,Itgb3bp,Nfyb,Zfhx2,Acat2,Neb,Sqle,Slc1a2)上调4倍及以上(Log2FC≥2,P<0.05)。其中差异表达最显著的是人中性粒细胞明胶酶(lipocalin 2,Lcn2),其上调表达约达27倍(Log2FC=4.76,P<0.01),为肝组织功能损伤的标志物之一[10,11]。在大鼠脓毒血症肝组织下调表达1.5倍以上的基因有1 337个(Log2FC ≤-0.56,P<0.05),其中822个基因下调2倍及以上(Log2FC≤-1,P<0.05),231个基因下调4倍及以上(Log2FC≤-2,P<0.05),6个基因(Tnnt1,Sv2a,Grip1,Pitx2,Rbbp9,Kitlg)下调16倍以上(Log2FC≤-4,P<0.05)。
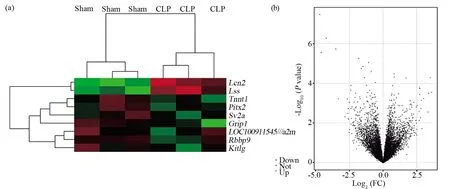
图1 大鼠CLP诱导的脓毒血症肝组织差异表达基因聚类图和火山图Fig.1 Gene map of differentially expressed genes in liver tissue of sepsis induced by CLP in rats(a)聚类图;(b)火山图。|Log2FC|≥1,-Log10 P>4(a)The clustering diagram;(b)The volcano diagram. |Log2FC|≥1,-Log10 P>4
2.2 小鼠脓毒血症肝组织损伤芯片差异基因分析
利用小鼠构建CLP脓毒血症和假手术模型,留取对应肝组织进行差异基因芯片检测。通过筛选获得3 532个1.5倍及以上的上调表达基因(Log2FC≥0.56,P<0.05),其中2 030个基因上调2倍及以上(Log2FC≥1,P<0.05),669个基因上调4倍及以上(Log2FC≥2,P<0.05),112个基因上调16倍以上(Log2FC≥4,P<0.05),29个基因上调64倍以上(Log2FC≥6,P<0.05),10个基因(A2m、Serpine1、Cd14、Slc10a6、Tifa、Il1rn、Cxcl1、Saa3、Cidec、Inhbb)上调128倍以上(Log2FC≥7,P<0.05),如由肝星状细胞TLR4依赖性分泌的中性粒细胞趋化因子CXCL1介导肝脏对肠微生物群的反应[12]。在小鼠脓毒血症肝组织下调表达1.5倍以上的基因有4 020个(Log2FC≤-0.56,P<0.05),其中2 374个基因下调2倍及以上(Log2FC≤-1,P<0.05),638个基因下调4倍及以上(Log2FC≤-2,P<0.05),58个基因下调16倍以上(Log2FC≤-4,P<0.05),8个基因 (Gck、Keg1、Nr0b2、Angptl8、Car3、Etnppl、Cyp7a1、Hsd3b3)下调64倍以上(Log2FC≤-6,P<0.05)。
2.3 大、小鼠脓毒血症肝组织共同差异表达基因及其互作网络
在大鼠和小鼠脓毒血症肝组织中,对上述芯片结果的差异基因取交集,得到共同上调表达1.5倍以上(Log2FC≥0.56,P<0.05)的基因29个 (Timp1、Gpr146、Pgs1、Lcn2、Cux1、Ell2、Fabp5、Cflar、Rrp15、Nfyb、Mid1、Fam134b、Abhd13、Celf2、Flna、Orm1、Mtss1、Slc41a1、Gnat1、Jund、Synrg、S100a9、Gskip、Tra2b、Lbp、Cp、Pcm1、Srsf10、Gosr1)。84个基因(Nrep、Prkag2、Hsf4、Nudt8、Pxdn、Rbms2、Rasgrp2、Cryl1、Vezt、Man2b1、Gclm、Vapb、Map2k5、Whsc1、Zfand4、Mrps6、Pcbp4、Camta1、Gucy1b3、S1pr5、Acot4、Htatip2、Hlf、Asrgl1、Usp21、Eci1、Bdnf、Mettl7b、Tspan2、Kctd2、Kidins220、Aldh1a1、Tbc1d2b、Thap11、Aifm3、Lancl1、Eno3、Frmd4b、Osbpl2、Ghdc、Bmp6、Mn1、Lrpap1、Abcg8、Clock、Nr0b2、Cnpy4、Hadh、Aaed1、Tbx3、Mapk3、Cyb561a3、Tmem98、Lzts3、Slc8b1、Stat6、Atxn7l1、Tnxb、Zdhhc18、Foxo4、Plxnd1、Pla2g15、Bcl2l12、Kifap3、Fam162a、Pter、Ptk2b、Myh10、Zfp444、Mxi1、Cuedc2、Mmaa、Ccpg1os、Gclc、Atp2c1、Abcb4、1-Mar、Ankrd24、Edc3、Stox2、Coq9、Pik3r2、Rfxank、Vmac)下调表达1.5倍以上(Log2FC ≤-0.56,P<0.05)。为进一步分析差异蛋白质的功能,将这113个基因在String数据库中进行了PPI网络分析,并通过cytoscape软件对上述PPI网络进行进一步成分分析及可视化。
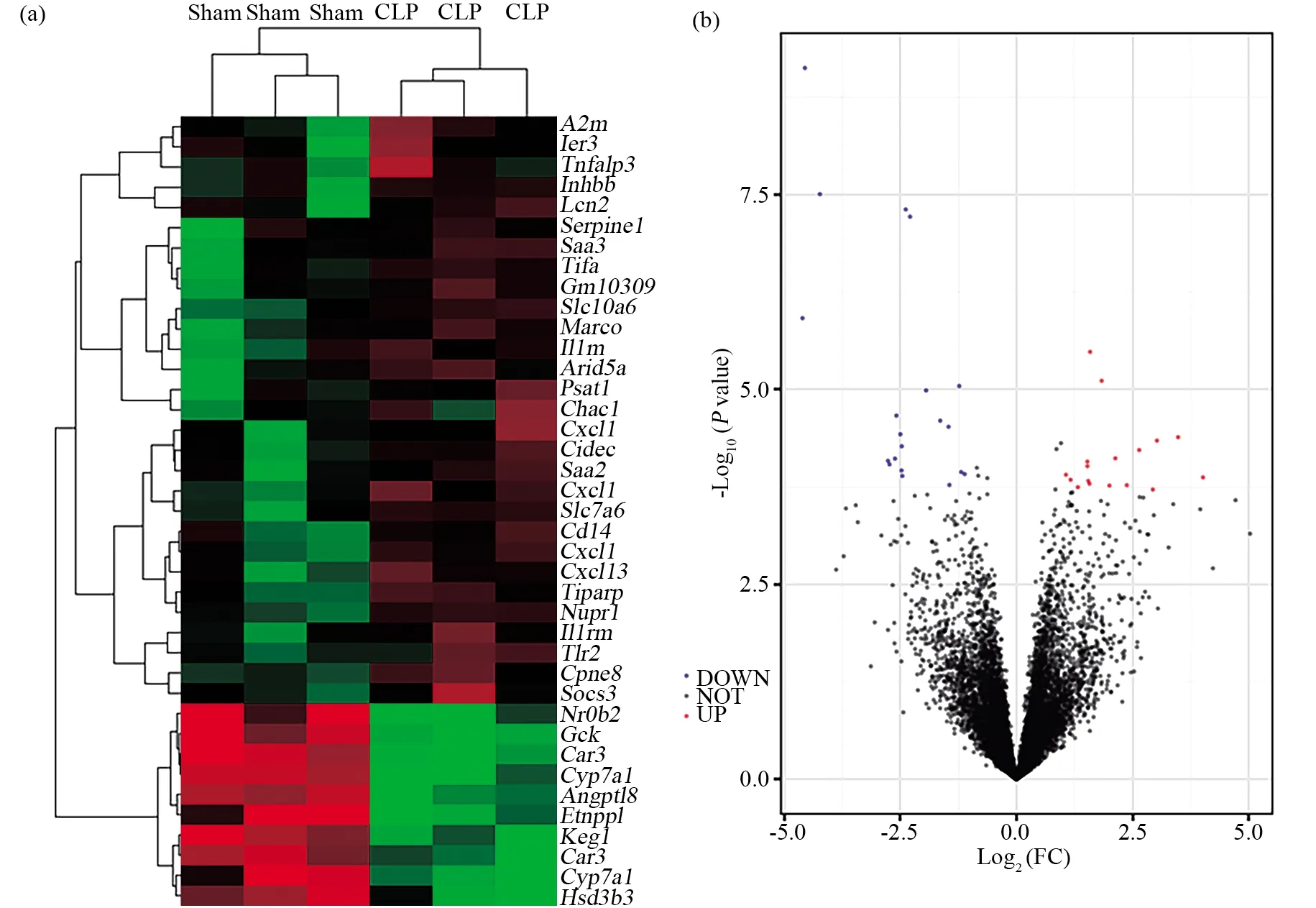
图2 小鼠CLP诱导的脓毒血症肝组织损伤差异表达基因聚类图和火山图Fig.2 Differentially expressed genes of sepsis-induced liver injury in mice with CLP (a)聚类图;(b)火山图。|Log2FC|≥1,-Log10 P>6(a)The clustering diagram;(b)The volcano diagram. |Log2FC|≥1,-Log10 P>6
表1 大鼠与小鼠CLP脓毒血症模型肝组织芯片TOP5差异基因
Tab.1 TOP5 DEGs in liver tissue of rat and mouse CLP sepsis models
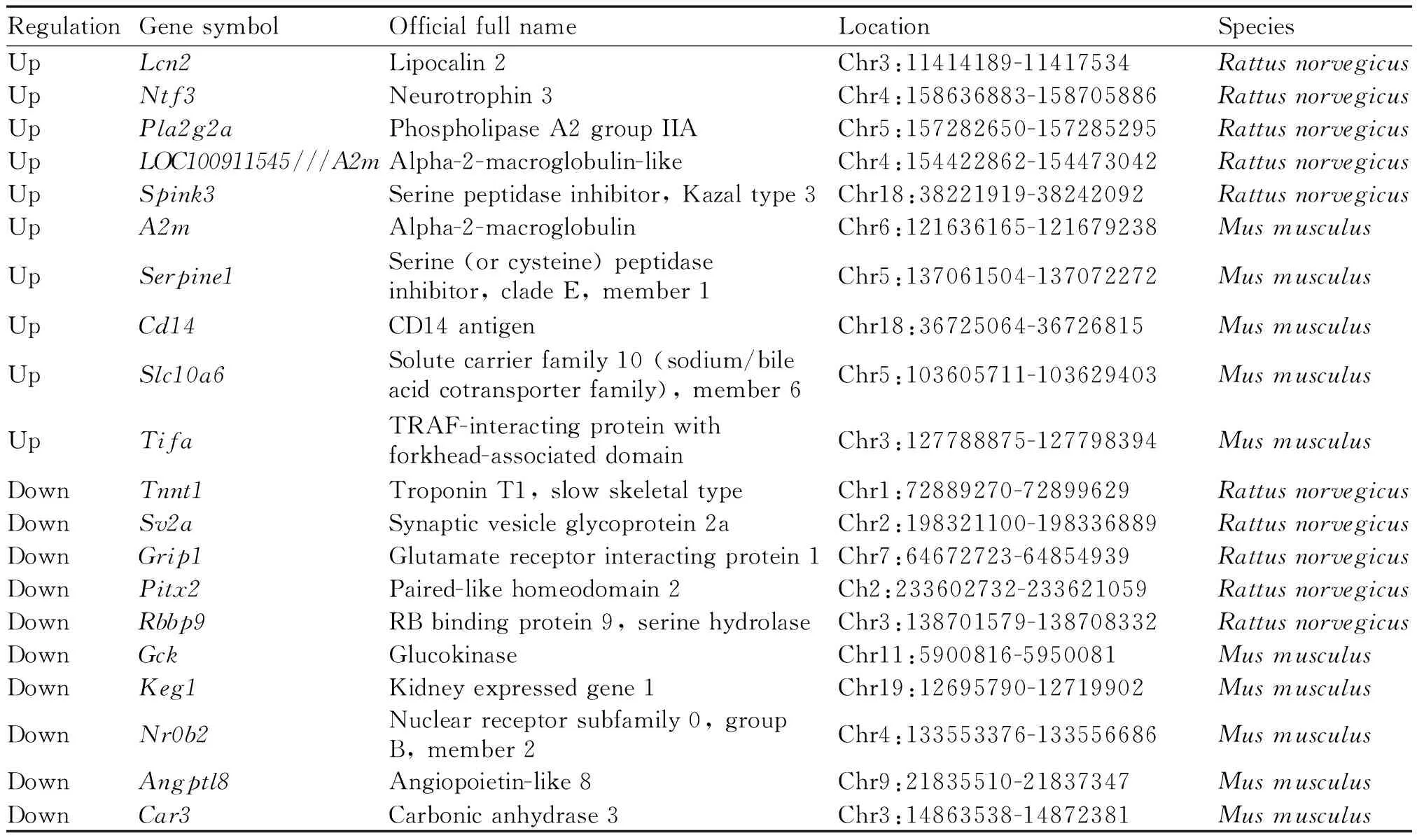
RegulationGene symbolOfficial full nameLocationSpeciesUpLcn2Lipocalin 2Chr3:11414189-11417534Rattus norvegicusUpNtf3Neurotrophin 3Chr4:158636883-158705886Rattus norvegicusUpPla2g2aPhospholipase A2 group IIAChr5:157282650-157285295Rattus norvegicusUpLOC100911545///A2mAlpha-2-macroglobulin-likeChr4:154422862-154473042Rattus norvegicusUpSpink3Serine peptidase inhibitor, Kazal type 3Chr18:38221919-38242092Rattus norvegicusUpA2mAlpha-2-macroglobulinChr6:121636165-121679238Mus musculusUpSerpine1Serine (or cysteine) peptidase inhibitor, clade E, member 1Chr5:137061504-137072272Mus musculusUpCd14CD14 antigenChr18:36725064-36726815Mus musculusUpSlc10a6Solute carrier family 10 (sodium/bile acid cotransporter family), member 6Chr5:103605711-103629403Mus musculusUpTifaTRAF-interacting protein with forkhead-associated domainChr3:127788875-127798394Mus musculusDownTnnt1Troponin T1, slow skeletal typeChr1:72889270-72899629Rattus norvegicusDownSv2aSynaptic vesicle glycoprotein 2aChr2:198321100-198336889Rattus norvegicusDownGrip1Glutamate receptor interacting protein 1Chr7:64672723-64854939Rattus norvegicusDownPitx2Paired-like homeodomain 2Ch2:233602732-233621059Rattus norvegicusDownRbbp9RB binding protein 9, serine hydrolaseChr3:138701579-138708332Rattus norvegicusDownGckGlucokinaseChr11:5900816-5950081Mus musculusDownKeg1Kidney expressed gene 1Chr19:12695790-12719902Mus musculusDownNr0b2Nuclear receptor subfamily 0, group B, member 2Chr4:133553376-133556686Mus musculusDownAngptl8Angiopoietin-like 8Chr9:21835510-21837347Mus musculusDownCar3Carbonic anhydrase 3Chr3:14863538-14872381Mus musculus

图3 CLP诱导的脓毒血症肝组织损伤差异表达蛋白相互作用图Fig.3 Interaction diagram of differentially expressed proteins in sepsis-induced liver tissue injury induced by CLP(a)所有差异基因的蛋白互作网络;(b)核心互作网络。红色圆圈表示上调,蓝色圆圈表示下调(a)The interaction network of all differential genes;(b)The core interaction gene.Red circles indicate up-regulation and blue circles indicate down-regulation
2.4 共同差异基因功能和通路分析
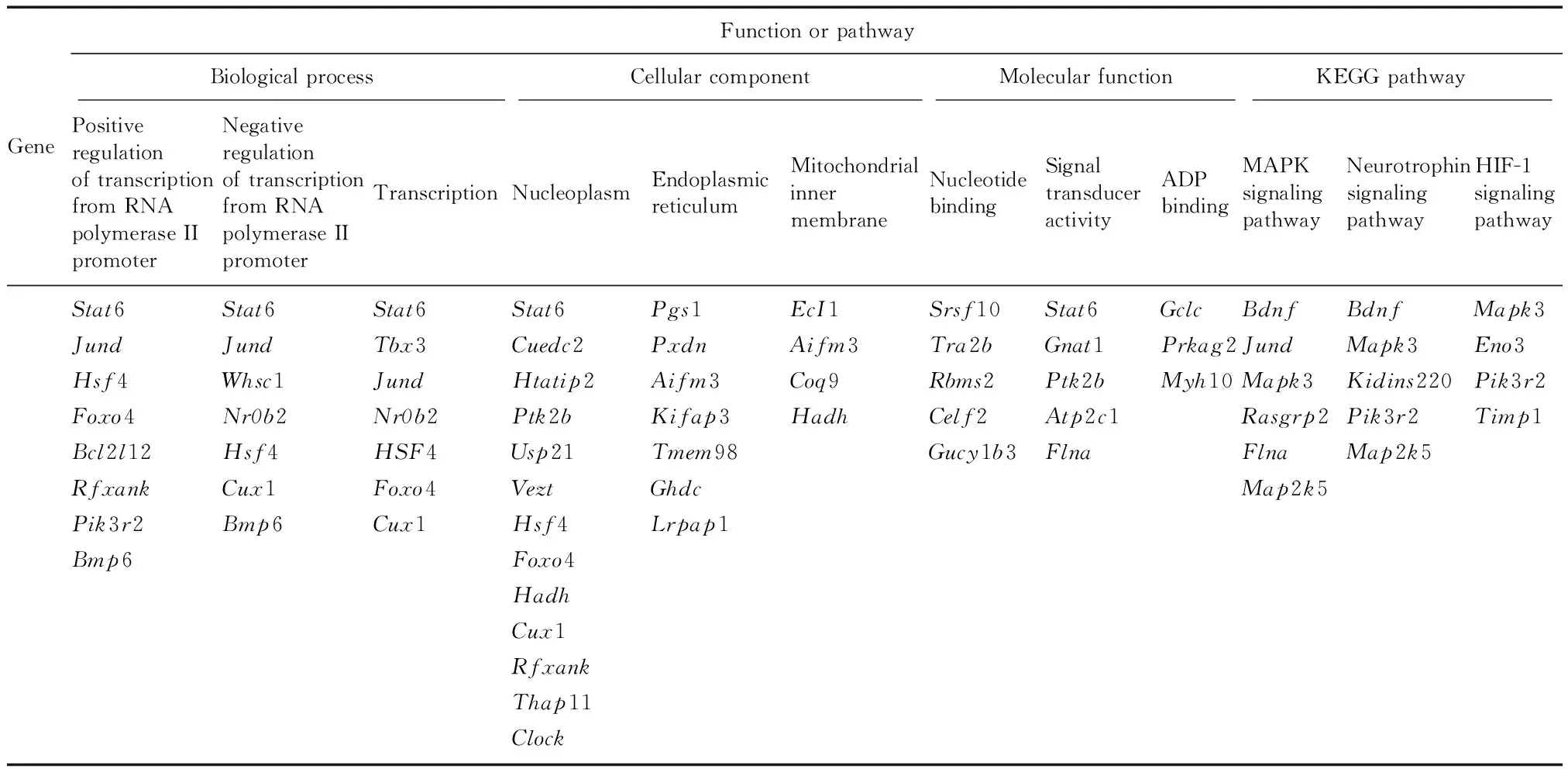
通过对上述共同差异基因从生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cellular component,CC)和KEGG通路4个角度的基因功能分析,发现20种生物过程、7类分子功能及5类细胞组分与脓毒血症肝组织有潜在调控关系。其中,TOP3生物过程包含的基因数分别为8、7、7(表2),且均与细胞转录功能相关;TOP3分子功能包含的基因数分别为5、5、3(表2),分别与细胞信号转导激活、核酸或ADP结合相关;TOP3细胞组分包含的基因数分别为13、7、4(表2),分别与细胞核、内质网及高尔基体相关,这3类基因功能共同提示细胞转录的激活、修饰及能量供给在脓毒血症肝组织中具有重要作用。
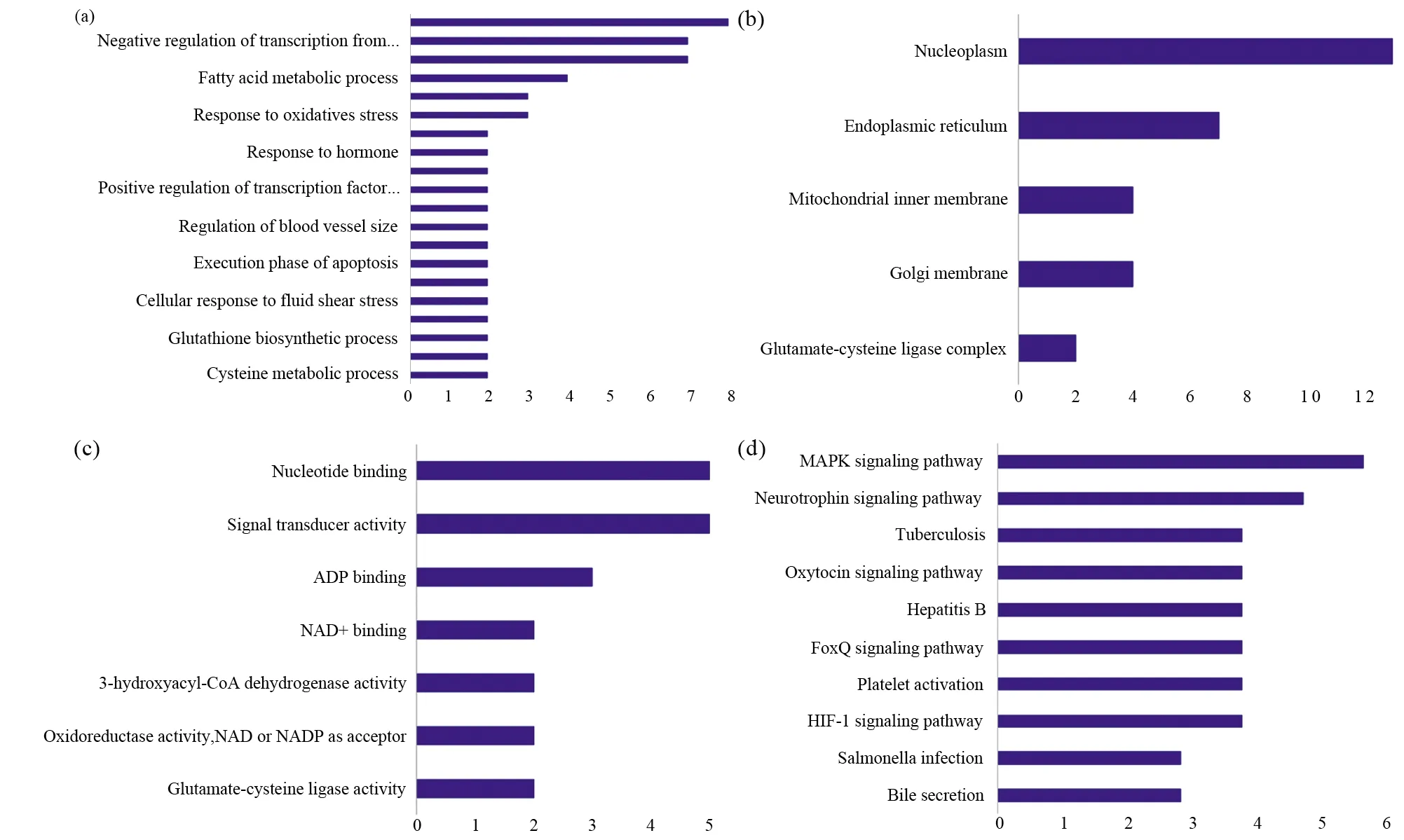
图4 GO分析及KEGG通路分析Fig.4 GO analysis and KEGG pathway analysis(a)生物过程(GO-BP);(b)分子功能(GO-MF);(c)细胞组分(GO-CC);(d)KEGG通路(a)Biological process(GO-BP);(b)Molecular function (GO-MF);(c)Cell component (GO-CC);(d)KEGG pathway
表2 脓毒血症模型的肝组织基因芯片经GO和KEGG分析后TOP3功能和通路
Tab.2 TOP3 functions or pathway of liver tissue gene microarrays in sepsis model after GO and KEGG analysis
GeneFunction or pathwayBiological processCellular componentMolecular functionKEGG pathway Positive regulation of transcription from RNA polymerase II promoterNegative regulation of transcription from RNA polymerase II promoterTranscriptionNucleoplasmEndoplasmic reticulumMitochondrial inner membraneNucleotidebindingSignal transducer activityADP bindingMAPK signalingpathwayNeurotrophin signaling pathwayHIF-1 signaling pathwayStat6JundHsf4Foxo4Bcl2l12RfxankPik3r2Bmp6Stat6JundWhsc1Nr0b2Hsf4Cux1Bmp6Stat6Tbx3JundNr0b2HSF4Foxo4Cux1Stat6Cuedc2Htatip2Ptk2bUsp21VeztHsf4Foxo4HadhCux1RfxankThap11ClockPgs1PxdnAifm3Kifap3Tmem98GhdcLrpap1EcI1Aifm3Coq9HadhSrsf10Tra2bRbms2Celf2Gucy1b3Stat6Gnat1Ptk2bAtp2c1FlnaGclcPrkag2Myh10BdnfJundMapk3Rasgrp2FlnaMap2k5BdnfMapk3Kidins220Pik3r2Map2k5Mapk3Eno3Pik3r2Timp1
对上述共同差异基因从通路富集角度分析,发现共有10条通路与脓毒血症肝组织关系密切,其中最主要的通路为丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,这与PPI互作网络分析结果的中心节点MAPK3一致,另外HIF-1、FoxO、乙型肝炎、血小板激活及胆汁分泌等通路调控也与脓毒血症相关。
3 讨论
在过去的几十年中,许多基础和临床研究一直试图揭示脓毒血症形成和发展的新型、潜在机制,但是在世界范围内,腹部外科领域的脓毒血症的死亡率仍然居高不下,因为大多数研究一直集中在抗生素抗感染、免疫调节剂调控免疫细胞和炎症因子上,但在多器官功能衰竭的器官本身是如何代谢、衰竭的机制上,认识还不够清楚。为了进一步补充脓毒血症诊疗上的潜在新机制,本研究整合了来自不同研究团队的大鼠、小鼠芯片数据集,利用生物信息学方法对这些数据集进行了深入分析。在第一步中,虽然大鼠(图1)与小鼠(图2)非常相近,但并非完全同源,无法简单的合并芯片中注释的基因表达量结果,因此分别确定了两组研究的DEGs,其中大鼠CLP脓毒血症模型中有1 687个差异1.5倍以上、992个差异2倍以上的DEGs(170个上调2倍和822个下调2倍以上);小鼠盲肠穿刺脓毒血症模型中有7 552个差异1.5倍以上、4 404个差异2倍以上的DEGs(2 030个上调2倍和2 374个下调2倍以上)。在第二步中,将上述DEGs注释取同源基因后获取交集,并使用多种方法通过GO将DEGs分为3类(分子功能、生物过程和细胞成分组),并分别聚类,得出潜在的差异基因最有可能影响的功能和通路。在第三步中,研究了DEGs蛋白质-蛋白质相互作用网络复合体(图3),并从PPI网络中滤出了最重要的模块,鉴定出该模块中,包含7个中心节点,这些基因与MAPK通路调控的各类细胞增殖[13]、代谢[14]、自噬[15]等过程密切相关。
通过综合的生物信息学分析,已经确定了7个中心节点,并由这7个节点的蛋白潜在互作关系网络组成了一个模块(图3b),包括Lcn2、ORM1、CP、TIMP1、MAPK3、NROB2、JUND。其中,Lcn2和MAPK3位于变化最大的基因顶部,并且它们翻译的蛋白生物学功能参与调节细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理或病理过程。MAPK 通路作为从细胞表面传导到细胞核内部的重要传递者,已有诸多文献表明在脓毒血症中发挥着重要作用。脓毒血症期间MAPK通路基因表达上调并持续存在,TLR4-TLR9-p38 MAPK-STAT3信号通路的激活有助于CLP诱导的脓毒血症中miR-23b的产生[16]。miRNA介导的MAPK也被证实广泛参与脓毒血症调控中,miRNA-143与浆细胞瘤转化迁移基因1 (plasmacytoma variant translocation 1,PVT1)结合可上调MAPK-NF-κB途径,从而调节脓毒血症心脏功能并促进炎性因子的分泌[17];脓毒血症患者的血清中miR-135a明显上调,miR-135a的上调可加重败血症诱导的炎症和心肌功能障碍,SB203580或JSH-23(MAPK通路抑制剂)可逆转此现象,证实p38 MAPK-NF-κB途径介导了脓毒血症的炎症调控[18]。长链非编码RNA也可发挥类似作用,Chen等[19]在脓毒血症对心功能影响的研究中发现,转移相关肺腺癌转录本1(metastasis associated lung adenocarcinoma transcript 1,MALAT1)通过激活p38 MAPK-NF-κB信号途径诱导了CLP模型的心功能障碍和心肌炎症,这是通过与miR-125b和p38 MAPK-NF-κB相互作用实现的。用叶黄素、类胡萝卜素、虾青素预处理小鼠原始巨噬细胞可以在体外抑制MAPK-NF-κB信号通路,并减弱LPS增加的炎症因子。在LPS引起的脓毒血症急性肺损伤的动物模型中,虾青素的使用显著提高了存活率并降低了肺损伤程度,并被证明在体内抑制了LPS诱导的炎症因子增加、MAPK磷酸化和NF-κB活化[20]。
与本研究一致,一些研究也报道了脓毒血症中Lcn2的重要作用。Lcn2蛋白属于先天性免疫蛋白,其在体内铁平衡、感染和炎症中发挥作用[21]。有研究认为Lcn2亦属于中性粒相关基因,这与本文中通路分析相符[22]。在神经系统中,Lcn2是LPS外围给药后中枢系统升高最多的蛋白质,通过Lcn2基因双敲小鼠,研究者确定了Lcn2对LPS诱导炎症模型具有抗炎保护作用,而这种保护途径依赖于细胞因子和趋化因子信号转导,核苷酸结合寡聚化域样受体信号转导以及Janus激酶信号转导子和转录激活子等途径[23]。对于消化系统,Lcn2被证明在无菌小鼠血清和粪便中的含量显著降低,而通过口服管饲野生型小鼠的盲肠内含物可增加无菌小鼠血清Lcn2水平。反之,低表达Lcn2的小鼠表现出肠道细菌性营养不良,细菌负担增加,革兰氏阴性细菌的比例增加。这说明Lcn2本身可被微生物诱导,可能是维持微生物稳态的先决条件[24]。氧化应激也被认为是破坏肠源性脓毒血症肠道屏障的主要因素之一, Lcn2被证明在体外对H2O2毒性具有保护作用[25]。此外,体内存在或使用Lcn2会引起炎症性低铁血症和体内抗氧化酶[如超氧化物歧化酶(SOD)和血红素氧合酶1(HO-1)]的上调,以限制败血症期间铁引起的氧化应激[26]。换句话说,Lcn2可以防止氧化应激并帮助减轻肠屏障损伤。Lcn2与MAPK3在本研究中是关键模块中最重要的两个基因,因此二者间可能有潜在联系。在结直肠癌中,敲低Lcn2mRNA表达可通过p38 MAPK-CHOP依赖性途径上调增强细胞对TRAIL的敏感性,增加抗肿瘤活性[27]。在肥胖和2型糖尿病中,Lcn2表达增加,这依赖于脂肪细胞中γ-干扰素(interferon γ,IFNγ)和肿瘤坏死因子α(tumor necrosis factor α,TNFα)的转录依赖性诱导。Zhao等[28]证实,MAPK(ERK 1/2)激活是IFNγ和TNFα诱导Lcn2蛋白表达所必需的,IFNγ和TNFα分别诱导克隆信号转导与转录活化子1(signal transducer and activator of transcription 1,STAT1)和NF-κB促进Lcn2转录。从上述文献来看,MAPK3可能作为上游分子,启动并调控Lcn2蛋白的表达及功能。
脓毒血症的的肝损伤特征涉及多种信号通路的基因和表观遗传调控,并导致肝组织中出现显著的转录和翻译差异。虽然本文的微阵列芯片结果只纳入了基因转录水平差异,但此表达谱中仍可挖掘出脓毒血症肝损伤的潜在特征。本研究只纳入了基因表达量水平的研究分析,但根据前述,临床症状表型的差异还应该考虑更多的分子调控因素,包括基因突变、DNA或RNA甲基化水平、非编码RNA水平和微卫星变异等,这些因素都可能会导致或参与脓毒血症的发生,并与预后密切相关。此外,简单的盲肠穿孔模型造模大多为革兰阴性菌类别的脓毒血症,LPS是其主要致病毒素,因此一定程度上仅能代表此类别下疾病诊疗的研究结论。而来自革兰阳性菌的脂磷壁酸(1ipoteichoic acid,LTA)和来自真菌的磷脂酰甘露聚糖(phospholipomannan,PLM)则会通过不同的方式激活并被免疫细胞识别[29]。免疫状态也与脓毒血症相关,Meakins等[30]首先发现部分脓毒血症和外伤患者对通常的回忆抗原如麻疹和流行性腮腺炎病毒的迟发型超敏反应(delayed type hypersensitivity response,DHT)缺失,迟发型超敏反应缺失与死亡相关。但是,尚未完全了解脓毒血症的每个亚型中的分子变化。
总之,本文通过使用多个芯片的数据进行生物信息学分析,确定了脓毒血症中发生改变的部分基因,筛选了7个最关键的中枢基因,这些基因中最重要的MAPK3和Lcn2主要与MAPK通路、中性粒细胞激活通路和缺氧诱导因子通路等相关。这些发现有利于对脓毒血症肝衰竭的病因和潜在分子机制的理解,上述基因和通路可以作为治疗靶标用于后续研究。
