复方健耳剂对抗老年性耳蜗神经细胞凋亡超微结构观察及上调NeuN 和BDNF 定位表达作用
2020-07-08宣伟军黄力毅宣毅唐俊波韦瑀龙
宣伟军,黄力毅,宣毅,唐俊波,韦瑀龙
(1. 广西中医药大学第一临床医学院耳鼻咽喉科,南宁 530023; 2. Harvard Medical School,Harvard University,Boston,MA 02114,USA; 3. School of Engineering,Tufts University,Medford,MA 02155,USA; 4. 广西中医药大学瑞康医学院制药厂,南宁 530011)
老年性聋(Presbycusi)又称年龄相关性听力损失(Age—related hearing loss,AHL),随着世界人口的老年化,其发病率逐年递增[1],其病因病机复杂,防治极其困难,是当前耳科学研究的重要热门课题之一[2-4]。 前期研究表明,中药复方健耳剂在普通光镜下观察发现具有明显对抗C57BL/6J 小鼠老年性耳蜗毛细胞、耳蜗螺旋神经节神经元(spiral ganglion neurons,SGN)凋亡,以及保护听功能的药效作用[5-7],但以往缺如小鼠老年性耳蜗神经细胞形态学电镜超微观察以及中药细胞靶向作用机制研究,因此,我们继续选择C57BL/6J 小鼠作为AHL模型,利用透射电镜重点观察老年性耳蜗外毛细胞(outer hair cell,OHC)、SGN 细胞核超微结构改变,利用形态学多重免疫荧光技术,配合激光共聚焦显微镜重点观察SGN 中神经元特异性核抗原蛋白(neuron-specific nuclear antigen,NeuN)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)定位表达,以及中药干预影响作用,以进一步揭示其对抗细胞凋亡以及靶向作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级1 月龄刚断奶健康C57BL/6J 小鼠22只,雌雄各半,体重16 ~18 g,由北京维通利华实验动物技术公司提供【SCXK(京)2012-0001】,清洁级别一级,饲养于本单位SPF 动物实验室【SYXK(桂)2019-0001】,所有操作均符合广西中医药大学实验动物伦理学要求(审批号:IACUC 20161015)。
1.1.2 药物
复方健耳剂主要由葛根、丹参、黄芪、骨碎补等组成,由广西中医药大学瑞康医学院制药厂制备。经过水煮、浓缩、烘干、反复粉碎和过筛等流程,制成每克药粉相当于6.63 g 生药材。 按照《中药药理研究方法学》[8]小鼠与成人用量换算法,计算出该药的小鼠用量定为1.83 g/(kg·d)。
1.1.3 试剂和仪器
VECTASHIELD HardSet Mouting Medium withDAPI(Vector,H-1500),NeuN 一抗(Millipore,MAB377),BDNF 一 抗(Thermofisher,OSB00017 W),二抗Goat anti-Rabbit IgG (H+L),Alexa Fluor Plus 488 (Invitrogen,PIA32731)、二抗Goat anti-Mouse IgG (H+L) Secondary Antibody,Alexa Fluor Plus 555 ( Invitrogen,PIA32727 ),Vector LaboratoriesSupplier Diversity Partner H3300(Fishersci,NC9401067),碳酸钠缓冲液(Electron Microscopy Sciences,11652),样品组织自动处理器LYNX II Automated Tissue Processor ( Electron Microscopy Sciences,L12600),甲苯胺蓝染色剂(Electron Microscopy Sciences,14950),tEpon-812 环氧树脂(Tousimis,3131),NMA-ultrapure(Tousimis,3143),DDSA ( Dodecenyl Succinic Anhadrite )(Tousimis,3123),DMP-30 (Dimethylaminomethyl)Phenol(Tousimis,3103)。 透射电镜型(Philip CM10 TEM,荷兰),激光共聚焦显微镜(Olympus IX 81+Olympus Fluoview FV1000,日本)。
1.2 方法
1.2.1 动物分组及给药方法
将22 只动物随机分为7 月龄老年性耳蜗退变对照组(7 月龄对照组)、7 月龄中药干预组(7 月龄中药组)各11 只。 7 月龄对照组只喂饲常规饲料和自来水,中药组食用相同的常规饲料同时,饮用中药溶液以代替日常饮水,具体是中药粉加适量比例水配兑(一般为0.05 g 药粉加5 mL 水),盛于动物自吸喂养瓶内供小鼠自动饮用,在没有其它水源供应的实验条件下,实验动物因生理需要而必须每天摄取足够的饮水,因而也就保证了实验小鼠每天都能摄取到规定的药物剂量,到4 月龄后改用人工灌服中药溶液至期满。 月龄期满终止实验,取耳蜗切片,进行OHC、SGN 细胞核超微结构观察,以及SGN中NeuN、BDNF 定位表达研究。
1.2.2 观察指标及检测方法
实验动物期满后,所有动物用20%乌拉坦全麻,剪开右心房,左心室灌注生理盐水排出体内血液,接着灌注10%福尔马林磷酸盐缓冲液,断头取耳蜗,在蜗尖钻孔并摘除镫骨同时打开园窗,将10%福尔马林磷酸盐缓冲液从蜗尖孔灌入耳蜗,然后浸入上述固定液固定24 h 以上,石蜡包埋备用。其中每组5 只动物耳蜗利用透射电镜,观察OHC 以及对应部位的SGN 超微结构变化。 每组另外6 只动物耳蜗利用形态学多重免疫荧光技术,配合激光共聚焦显微镜,观察SGN 中NeuN、BDNF 定位表达。
1.2.3 透射电镜观察OHC、SGN 细胞核超微结构
将制备的耳蜗石蜡包埋标本切片,H&E 染色,在显微镜下定位耳蜗底回柯替氏器OHC 和同一部位的SGN,明确区域,从石蜡块上取出相同区域组织,60℃熔化石蜡,梯度乙醇水化,0.1 mol/L 碳酸钠缓冲液漂洗,4℃下组合固定液(由2.5%戊二醛、2%多聚甲醛、0.1 mol/L 碳酸钠缓冲液配制)固定24 h,0.1 mol/L PBS 洗,1%锇酸后固定2 h,0.1 mol/L PBS 漂洗,在样品组织自动处理器中经双蒸水、1%鞣酸、双蒸水、梯度乙醇、环氧丙烷、梯度EPON 处理和包埋(EPON 由tEpon-812、DDSA、NMA-ultrapure、DMP-30 配制而成),将EPON 块切割0.5 μm 的半薄切片,甲苯胺蓝染色,显微镜下检查染色载玻片,进一步确认薄切片的所要观察的区域,将EPON 块进一步修整成<2 毫米宽范围,超薄切片机金刚石刀将EPON 块切成80 nm 薄片,将薄片加载到透射电镜金属网格上,醋酸铀和柠檬酸铅染色网格,透射电镜观察,其中重点选择观察7 月龄对照组耳蜗底回存留尚未解体的OHC 以及对应部位的SGN 超微结构变化,同时与7 月龄中药组相同部位的OHC 和SGN 进行对照。
1.2.4 激光共聚焦显微镜观察SGN 中NeuN 与BDNF 定位表达
实验方法采用笔者探索和应用的形态学多重免疫荧光方法[9-12],将制备的耳蜗石蜡包埋标本切片,Xylene 脱蜡,梯度乙醇水化,PBS 液漂洗,转入10mM、 pH6.0 Citrate 缓冲液,选择微波炉进行抗原热修复,温度199F,PBS 漂洗后,加入2% goat serum,1% BSA,0.1% cold fish gelatin,0.05%sodium azide 封闭孵育,置换5% BSA 配制的NeuN、BDNF 目标抗体液,每个抗体室温下相继孵育1 h,置4℃冰箱过夜。 分别以0.1% Triton PBS、PBS 漂洗,以各自对应匹配并耦合488、555 不同荧光素吸收谱的羊抗一抗IgG,室温孵育50 min。 同样分别以0.1%Triton PBS、 PBS 漂 洗。 最 后 以 VECTASHIELD HardSet Mouting Medium with DAPI 进行DAPI 细胞核染色,中性树脂封片,激光共聚焦显微镜下,以相应匹配的荧光素吸收谱不同激光发射,并配以不同颜色标记不同目标基因或蛋白以及DAPI,观测样品。 每组耳蜗切片样本截取同部位各12 张照片,其中重点选择观察耳蜗底回SGN,最后应用Image-J分别测算NeuN、BDNF、DAPI 灰度值,按NeuN/DAPI,BDNF/NeuN 灰度值比进行统计并比较。
1.3 统计学分析
应用SPSS16.0 软件进行统计分析。 计量资料以平均值±标准差(±s) 表示,两两比较用LSD-t检验法。P<0.05 为差异有统计学意义。
2 结果
透射电镜下,重点选择观察的7 月龄对照组耳蜗底回存留尚未解体的OHC 所见,胞体萎缩,胞核固缩不整,深染,核染色质浓集致密,聚集成团,并向核膜内侧边集,纹理结构模糊不清,电子密度高,有的核膜不完整,胞质内质网减少,呈现凋亡态势(图1A),同样,对应于OHC 部位的7 月龄对照组耳蜗底回SGN 变化与OHC 相同,但凋亡状况更为严重,大小形态不一,数量明显减少,不少神经元变性固缩、核不规则,核染色质聚集成团、边集,电子密度高,甚至胞核溶解,形成空泡,或解体缺如(图1C)。 而7 月龄中药组耳蜗底回OHC 胞体饱满,胞核圆形完整,核膜完整光滑,双层结构清晰,核内染色质均匀,纹理结构清晰可见,电子密度低,胞质内质网丰富,呈现较为健康(图1B),其耳蜗底回SGN 结构变化与OHC 相同,凋亡状况较轻,数量较多,仅个别胞核溶解,形成空泡,但整体较为健康(图1D)。
激光共聚焦显微镜下,耳蜗切片柯替氏器和螺旋神经节(spiral ganglion,SG)清晰显示不同色彩靶标形态表达(图2),红色显示NeuN,其作为神经元的特殊标志蛋白,代表着SGN 识别身份,表示存在的SGN;绿色显示BDNF,代表着BDNF 的识别身份;蓝色显示DAPI,作为细胞核DNA 特异性标记物,代表着各种细胞核。 通过形态重叠表达,可以精准明确靶向细胞和分布位置,即NeuN+DAPI 重叠表达定位为SGN;NeuN+BDNF+DAPI 重叠表达定位为SGN 所呈现的BDNF 表达,并可根据颜色多寡和有无比较,即可了解和判断表达量和分布的差异,或提示神经元凋亡现状,例如1 个细胞中的NeuN 单位面积表达量明显减少,说明该神经元已经出现凋亡状况,若无NeuN 表达,说明非SGN。 通过两组相同部位图像直观比较,耳蜗底回螺旋神经节7 月龄对照组NeuN+DAPI 分布明显减少,说明SGN 神经元凋亡明显增多(图2A),而7 月龄中药组NeuN+DAPI 分布较多且密集,说明SGN 神经元保存较高(图2B),与透射电镜一致,两组差异具有显著性(P<0.05)(表1)。 耳蜗底回螺旋神经节所见,与7 月龄对照组比较,7 月龄中药组NeuN+BDNF+DAPI 表达量及密度明显增多(图2C,D),两组差异具有显著性(P<0.05)(表1)。
3 讨论
人类AHL 临床耳蜗细胞形态学以及细胞内在分子机制研究难于开展甚至无法了解,其防治性研究也就极其困难,因此,动物模型成为目前AHL 研究可行性的重要方式和途径,目前研究AHL 所选动物一般选择不同种株近交系小鼠,如C57BL/6J、CBA/CaJ 等小鼠,缘于该类小鼠的生命周期较短和或AHL 相关基因缺陷小鼠模型的成功建立,研究发现,不同种株近交系小鼠耳蜗外毛细胞的退变随着年龄的增长存在着截然不同的病变发生时间和病理学改变进程,其中C57BL/6J 小鼠在出生后更早出现蜗毛细胞的退变[13-15],通过对3 个月、6 个月、9个月、12 个月、15 个月和18 个月龄时测量8 kHz、16 kHz 和32 kHz 纯音刺激的 ABR 阈值比较,C57BL/6J小鼠32 kHz ABR 阈值在6 月龄时明显增高,至12 个月龄时,16 kHz 阈值显著增高[16]。C57BL/6J 小鼠出现AHL 较早,与基因遗传学密切相关,通过对小鼠四种基因型ABR 听力检测研究发现,Sod1(+/+)Cdh23(+/+)小鼠在15 个月龄前仍保持正常听力,其中Sod1(-/-)Cdh23(ahl/ahl)小鼠表现出听力损失最早而且发病最严重,其次是 Sod1(+/+)Cdh23(ahl/ahl),Sod1(-/-)Cdh23(+/+),由此认为,Cdh23(ahl/ahl)基因缺陷型是导致C57BL/6J 小鼠早期出现AHL 病变的主要原因[17-18]。 因此,C57BL/6J小鼠是研究AHL 理想动物模型之一。
但一直以来我们的研究只局限于普通光镜下的研究,分子机制研究也仅局限于整个耳蜗PCR 等研究,其电镜下耳蜗HC 和SGN 超微形态学及中药细胞靶向分子作用仍不清楚,以往也缺乏有关文献报道和参考,这缘于小鼠耳蜗解剖过于细微,观察范围极小,如要定位为耳蜗某点用于电镜观察,则技术要求更高,难度更大。 这次我们使用原已备有的耳蜗石蜡包埋标本转用于透射电镜的研究尚属首次,国内外也均未见报道,以往透射电镜生物样品制备采用的是环氧树脂包埋切片,通过摸索证明,石蜡包埋切片同样可以转用于透射电镜样生物样品制备,只是有的地方和步骤不同。 本次研究观察所见,7 月龄C57BL/6J 小鼠耳蜗底回OHC 和SGN 出现细胞凋亡特征,如胞体萎缩、核固缩,核染色质聚集成团、边集,电子密度高,尤其是SGN 凋亡特征比OHC 更为严重,不少甚至溶解消失,形成空泡,或分崩离析,残缺不全,或解体缺如等,由此还提示,SGN 凋亡要早于HC,这与先前我们通过耳蜗铺片、普通光镜下所见结论一致,即7 月龄则耳蜗同时出现基底部内、外毛细胞、螺旋神经节神经元凋亡或变性,并显示同期螺旋神经节神经元凋亡比毛细胞相对更重,提示AHL 神经元退变早于毛细胞,由此推断在AHL 中的毛细胞有赖于神经元提供营养支持[19]。 而7 月龄中药组无论HC,还是SGN,出现的凋亡现象则轻得多,从超微细胞形态学观察中,进一步证实了中药复方健耳剂具有对抗耳蜗OHC 和SGN 凋亡的显著作用。
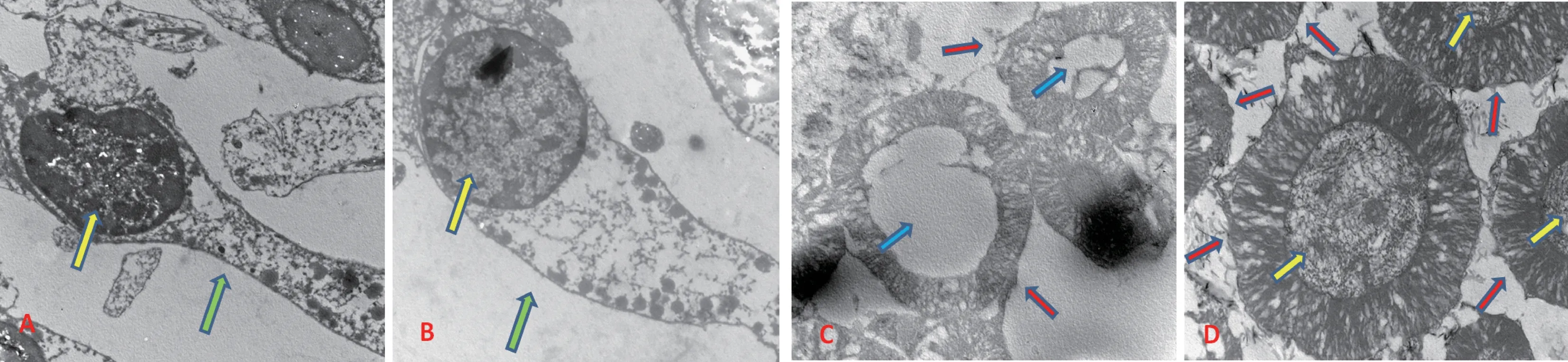
图1 透射电镜下两组耳蜗底回外毛细胞、螺旋神经节神经元比较Note. A and B were the OHC at cochlear base of the 7-month-old control group and the 7-month-old TCM group,respectively. Yellow arrows indicate the nuclei of OHC and green arrows indicate the bodies of OHC. C and D were the SGN at cochlear base of the 7-month-old control group and the 7-month-old TCM group,respectively. Yellow arrows indicate the nuclei of neuron,red arrows indicate the cell bodies of neuron,and blue arrows show the vacuole formed by the dissolution and disappearance of nuclei.(A,B:× 2750. C,D:× 4900)Figure 1 Comparison of OHC or SGN in the cochlear base of two groups under transmission electron microscopy
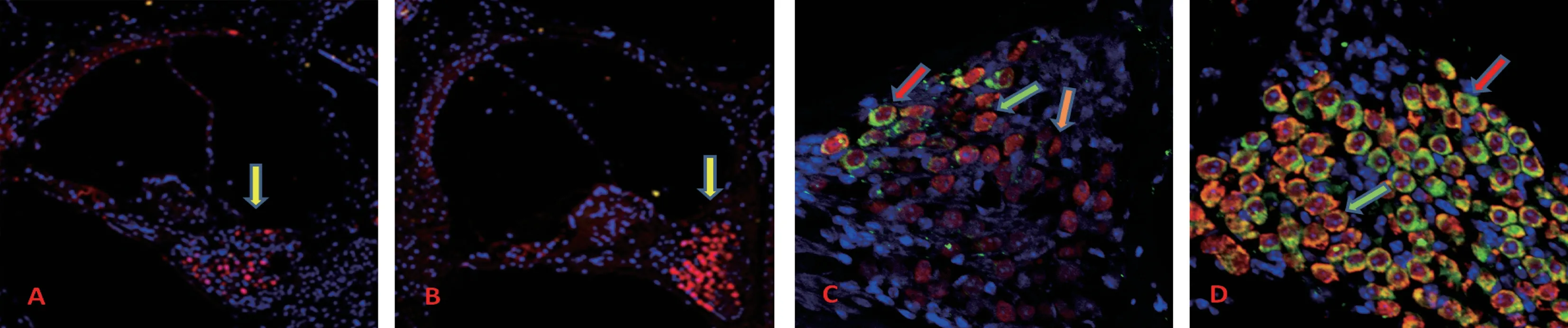
图2 激光共聚焦显微镜下两组耳蜗底回螺旋神经节比较Note. A and B were the SG at cochlear base in the 7-month-old control group and the 7-month-old TCM group(× 20),respectively. Yellow arrows indicate the SG location,and red indicate the NeuN expression,representing neurons present; blue indicates DAPI,representing nuclei of various cells. C and D the SG at cochlear base in the 7-month-old control group and the 7-month-old TCM group(× 40),respectively. Green arrows are the NeuN + DAPI expression,red arrows are the NeuN + BDNF + DAPI expression,and orange arrows are residual NeuN expression,indicating the apoptotic SGN residues. Red is NeuN,green is BDNF,and blue is DAPI.Figure 2 Comparison of SG in the cochlear base of two groups under confocal laser microscope
表1 两组动物耳蜗底部附近螺旋神经节NeuN、BDNF 表达量比较(灰度值,±s)Table 1 Comparison of NeuN or BDNF expression in SG near the cochlear base between two groups (gray value,±s)

表1 两组动物耳蜗底部附近螺旋神经节NeuN、BDNF 表达量比较(灰度值,±s)Table 1 Comparison of NeuN or BDNF expression in SG near the cochlear base between two groups (gray value,±s)
注:与7 月龄对照组比较,△P<0.05。Note. Compared with the 7-month-old control group,△P<0.05.
组别Groups只n NeuN/DAPI BDNF/NeuN 7 月龄对照组7-month-old control group 6 0.57 ± 0.12 0.35 ± 0.09 7 月龄中药组7-month-old TCM group 6 1.19 ± 0.19△ 0.77 ± 0.10△
NeuN 是脊椎动物中一种神经元特异性的DNA结合核蛋白,是神经元的极好特殊标记物。 在小鼠的整个神经系统中,包括在小脑、大脑皮层、海马、丘脑和脊髓,以及周围神经系统的背根神经节、交感链神经节和肠神经节中均有表达[20-21]。 本次研究在耳蜗螺旋神经节中首次观测到NeuN 表达,说明NeuN 表达定位于神经元,是神经元特有标志蛋白,在SGN 的表达,代表了SGN 的分布,具有识别和定位SGN 靶目标作用和意义。 本次实验通过形态学多重免疫荧光技术研究结果显示,耳蜗底部螺旋神经节7 月龄对照组对NeuN 表达明显低于7 月龄中药组,因此提示SGN 伴随着年龄增长和老化呈现凋亡的发展趋势,复方健耳剂具有保护老年性SGN 的药效作用,这些研究与前期利用甲苯胺蓝染色、普通显微镜下观察结果和结论一致[6]。 本次研究还表明,7 月龄中药组对BDNF 表达明显高于7月龄对照组,表明中药对定位于SGN 的BDNF 含量保持较高水平,由此提示,复方健耳剂能够有效对抗老年性耳蜗OHC、SGN 凋亡,保护听功能,其关键作用机制之一与其促进SGN 中的BDNF 表达密切相关。
BDNF 是神经营养因子家族中的重要成员,主要分布于中枢神经系统中,部分初级感觉神经元也可合成BDNF,其最具神经元营养活性,对神经元的生长、发育、分化和神经形成,以及成熟神经元的突触可塑性起着关键作用,中枢神经系统退行性疾病如阿尔茨海默病、帕金森病等,与BDNF 营养支持的减少有关。 由于BDNF 及其高亲和力受体遍布整个中枢神经系统,且BDNF 是一种有效的神经保护剂,因此认为,该营养因子是治疗某些中枢神经系统疾病的良好候选因子[22-24]。 然而,BDNF 受何种分子调控,通过何种途径,实现对神经细胞存活、迁移、生长、发育和分化,轴突和树突的生长、突触发生、传递和突触重塑等作用目前仍未明了,多数学者认为,BDNF 与高亲和力蛋白激酶受体酪氨酸蛋白激酶B(Trk B)特异性结合,激活酪氨酸激酶,磷酸化的酪氨酸与信号系统的其它分子结合,进一步使其它分子磷酸化,导致激酶瀑布效应从而激活整个信号传递系统,即主要通过Ras/MAPK 信号转导途径,或PI3-K/Akt 信号转导通路,发挥其生物学作用[25-26]。 后来有研究表明,外源性BDNF 能够通过抑制乙醇神经毒性诱导的细胞活性氧(reactive oxygen species,ROS)产生,阻止Bax 蛋白向线粒体膜的转运或线粒体膜电位中断,从而防止新生小鼠发育过程中的神经元凋亡[27],或BDNF 作为一种蛋白激酶A (protein kinase A,PKA)激活剂,通过PKA/cAMP 通路的磷酸化和脱磷酸化作用,调节细胞有氧代谢,阻止乙醇激活的下丘脑神经元氧化应激和凋亡过程[28]。 由此提示BDNF 还可通过激活体内细胞抗氧化系统,或抑制ROS 产生,阻止caspase 家族介导的细胞程序性死亡即凋亡。 过去普遍认为活性氧ROS 产生和累积损害被认为是AHL 发生过程的重要因素之一,即老年人耳蜗毛细血管退变,微循环障碍,血液灌注不足,线粒体能量代谢功能下降,ROS 不断累积,可损害线粒体,诱导线粒体基因(mtDNA)缺失或突变,引起细胞凋亡[29-31]。 因此认为,中药复方健耳剂通过促进BDNF 的产生,激活Ras/MAPK,或PI3-K/Akt,或PKA/cAMP 信号转导途径,发挥系列生物学效应,其中包括抑制ROS 产生,阻止caspase 家族介导的细胞程序性死亡,是其具有保护老年性耳蜗螺旋神经节神经元凋亡作用重要机制之一。
致谢:本次实验中透射电镜样品处理技术方案及仪器操作承蒙美国哈佛大学医学院马萨诸塞州总医院病理中心主任Jenny Zhao 博士指导,在此表示衷心感谢!
