miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p对心肌梗塞后血管再生的作用
2020-07-08袁晓龙潘金春蒋瑶龚宝勇高洪彬白国锋谭伟江梁十李加琪张豪王希龙
袁晓龙,潘金春,蒋瑶,龚宝勇,高洪彬,白国锋,谭伟江,梁十,李加琪,张豪*,王希龙*
(1. 广东省实验动物重点实验室/广东省实验动物监测所,广州 510663; 2. 广东省农业动物基因组学与分子育种重点实验室/华南农业大学,广州 510642)
心肌梗塞是指心肌因长时间缺血、缺氧导致的局部心肌细胞死亡、甚至心力衰竭,是一种高死亡率的心脏类疾病[1]。 从1987 年到2014 年,我国因心肌梗塞的死亡人数增加了5.6 倍[2],现在我国有大约250 万心肌梗塞的患者[3],2011 年我国因心肌梗塞而死亡的人数约占全年总死亡人数的7.6%[3],给社会和家庭带来沉重的负担,但心肌梗塞发生的详细分子机制尚不清楚,亟需开展相关的基础研究。 研究表明,心肌梗塞后,心肌组织可能因缺氧引发血管内皮细胞凋亡、毛细血管密度不足,进而导致左心室功能障碍和心力衰竭[4]。 心肌梗塞后,梗塞区内是否有血管迅速再生、建立侧支循环改善梗塞区血液供应是防止病人心力衰竭的关键[5]。 大量研究表明,miRNAs 广泛参与血管生成的各个方面,是血管生成的重要调节器[6-7],miRNAs 表达絮乱将导致心肌病变和心脏衰竭[8-9]。与正常人相比,心肌梗塞后病人血清里miR-1[10]、miR-208[11]、miR-21[12]、 miR-499[7]和miR-26A-1[13]的表达量显著升高。 Zhu 等[14]研究发现miR-486-5p 能通过激活PI3K-Akt 信号通路抑制心肌细胞的凋亡,增强小鼠心室功能。 与正常小鼠相比,miR-185-5p 在心肌梗塞小鼠心脏中的表达量显著降低,并且miR-185-5p 能抑制血管内皮细胞的增殖、迁移和成管功能[15]。 这些证据表明,miRNAs 可能影响心肌梗塞后的血管再生、心脏功能的恢复。
血管生成素-2(ANGPT-2)基因作为ANG 家族的成员,是一种重要的促血管生长和形成因子,主要在血管内皮细胞中表达,使血管处于不稳定、可塑状态,并易感受其它促血管生成因子的刺激,是启动血管再次重构的主要因子[16]。 现有的研究认为,在心肌梗塞后,AGNPT-2 的表达量显著升高[17],启动血管再生、改善心脏功能、减缓心力衰竭[18]。所以我们猜测,miRNAs 可能通过调控AGNPT-2 的转录表达,进而影响心机梗塞后的血管再生。
本研究以五指山小型猪心肌梗塞模型为研究对象,通过筛选心肌梗塞组(实验组,Group 1)和假手术组(对照组,Group 2) 组织中差异表达的miRNAs;利用生物信息学手段,预测靶标于ANGPT-2 3′UTR 潜在miRNAs,选择Group 1 与Group 2 中差异表达并且靶标于ANGPT-2 的潜在miRNA 为研究对象,以人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)为模型,探索这些miRNAs 对血管内皮细胞增殖、迁移以及血管腔形成的影响。 本研究能为进一步解析miRNAs 与心肌梗塞后血管再生的关系提供了一定参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
用于构建心肌梗塞模型的4 头健康的普通级、雄性、8 月龄五指山小型猪,体重为20 ~25 kg,由广州市饲料研究所提供【SCXK (粤) 2015-0036】,在广东省实验动物监测所【SYXK(粤)2016-0122】完成模型构建,实验动物伦理审批号为IACUC2016011。
1.1.2 主要仪器和试剂
PCR 扩增仪(BIORAD,美国);实时荧光定量PCR 仪(BIORAD,美国);倒置显微镜(Leica,德国);miRNAs 的mimic 和inhibitor(广州锐博生物科技有限公司,中国);ECM 基础培养基(ScienCell,美国);胎牛血清(Hyclone,美国);内皮细胞生长添加因子(ScienCell,美国); PBS(Hyclone,美国)。
1.2 方法
1.2.1 五指山小型猪心肌梗塞动物模型的建立
因受非洲猪瘟的影响,构建小型猪心肌梗塞模型受到限制,本研究共有4 头五指山小型猪用于研究。 根据前人的研究[19-20],建立心肌梗塞模型主要步骤为:(1)模型组:2 头健康成年五指山小型猪麻醉后固定于手术台上,取右卧位,从第四肋打开胸腔,结扎冠状动脉后缝合,术后四周进行采样;(2)对照组:2 头健康成年五指山小型猪麻醉后固定于手术台上,取右卧位,从第四肋打开胸腔,不结扎冠状动脉、直接缝合,术后四周进行采样。 经心肌梗塞处理的2 头猪分别命名为WZS1、WZS2,对照组的2 头猪命名为WZS3、WZS4。 分别采集模型组心肌梗塞区域以及对照组的对应区域,将梗塞组的组织样命名为Group 1,对照组的组织样命名为Group 2。
1.2.2 miRNA 的测序
小RNA 测序文库的制备采用TruSeq SmallRNA Sample Prep Kits(Illumina,San Diego,USA)试剂盒。样本提取总RNA 后,根据miRNA 的属性,即5′端为磷酸基团,3'为羟基基团。 利用T4 RNA 连接酶2 将一个腺苷化单链DNA3′接头和5′接头相继连接到small RNA 上;通过与3′端互补的RT 引物进行反转录反应;对反转录产生的cDNA 序列进行PCR 扩增,对140 ~160 bp 长度范围的PCR 产物进行胶回收,从而完成整个文库的制备。 对构建好的文库使用Illumina Hiseq 2000/2500 进行测序,测序读长为单端50 bp,将测序所得的序列,通过去接头、去污染等过程得到干净序列(clean reads),对其进行序列长度分布的统计。 将干净的序列分类注释,可获得样品中包含的各组分及其表达量信息。 将所有的sRNA 片段注释后,用剩下的未注释片段来进行新miRNA 的预测;已知miRNA 的碱基编辑预测,统计siRNA 的种类和数量,并对sRNA 做长度分布统计分析。
1.2.3 差异表达miRNAs 的筛选
去除表达量小于1 的miRNAs。 使用公式Fold change=log2(对照组/模型组)计算两组表达量差异倍数,利用Fisher test 比较两组间差异检验。 以log2(对照组/模型组)≥2 或log2(对照组/模型组)≤-2的miRNAs,并且P值小于等于0.05 为差异显著的miRNAs。
1.2.4 qRT-PCR
细胞RNA 的提取参照Takara 公司TRizol 操作说明书,基因及miRNA 反转录分别采用Thermo 公司的Thermo Scientific RevertAid First Strand cDNA Synthesis Kit 和TOYOBO 公司ReverTra Ace qPCR RT Kit 试剂盒,通过普通PCR 反应体系中加入了SYBR 荧光染料,特异性地掺入DNA 双链,发射荧光信号,以此来保证荧光信号与PCR 产物同步增加,miRNA 内参为U6 最后利用结果比较Ct 值法(2-△△ct)检测样品miRNAs 或基因的含量。
1.2.5 生物信息学预测miRNAs 靶基因
提取ANGPT-2 3′ UTR 的DNA 序 列,使 用TargetScan、MiRanda、RNAhybrid 这3 个软件预测靶标于ANGPT-2 的潜在miRNAs,三个软件同时预测到的miRNAs 为miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p。
1.2.6 HUVECs 细胞的接种和转染
HUVECs 原代细胞购买于ScienCell 公司,细胞复苏、传代后接种于细胞板中,当细胞汇合度达50%左右时,对细胞进行转染,转染方法按Invitrogen公司的Lipofectamine®3000 试剂盒进行;具体是将由锐博公司合成的miR-144 mimic/inhibitor、miR-21-3p mimic/inhibitor、miR-142-5p mimic/inhibitor、miR-27b-3p mimic/inhibitor 以 及 对 照 组 mimic NC、inhibitor NC,通过与Lipofectamine®3000 试剂结合转染至细胞中,本实验每组设置3 个重复。 根据转染试剂推荐,miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p mimic 和mimic NC 转染浓度为50 nM,转染时间为20 h;miR-144、miR-21-3p、miR-142-5p及miR-27b-3p inhibitor 和inhibitor NC 的转染浓度为分别为150 nmol/L、150 nmol/L、100 nmol/L 和100 nmol/L,转染时间为20 h。
1.2.7 HUVECs 细胞增殖检测
检测细胞增殖参照Cell-LightTMEdU Apollo 567 In vitro Kit 检测试剂盒,首先使用细胞培养基按比例稀释EdU 溶液,制备50 μnmol/L EdU 工作液;细胞融合度为50%~80%时,加入工作液孵育2 h,随后弃工作液,用4%多聚甲醛固定细胞,甘氨酸孵育中和,随后对细胞增殖进行检测,先避光加1× Apollo®染色反应液,弃液,加入DAPI 或hrotest 反应液染色,最后利用荧光显微镜镜检,每组至少三个重复。
1.2.8 Transwell 实验
细胞转染后24 h,用胰酶消化细胞后重悬,调整细胞浓度至2×105个/mL,transwell(8 μm)上室加入200 μL 细胞悬液,下室加入600 μL 条件培养基(含有10%FBS),培养16 h 后,取出transwell 小室,弃液,用棉签擦净小室上层细胞,PBS 漂洗后用4%多聚甲醛固定20 min;0.1%结晶紫染色;10 倍镜下观察并拍照,选取上中下3 个视野计数,取均数作为穿透膜细胞数,每组设3 个重复。
1.2.9 HUVECs 体外的血管成腔
Matrigel 基质胶置于4℃冰箱过夜解冻,冰冷无血清的ECM 培养基稀释,冰上操作,将稀释好的培养基加入到预冷的培养板中,待凝固后,接种转染24 h 后的细胞,培养8 h 后,利用倒置显微镜下观察并拍照,每组设3 个重复。
1.3 统计学分析
实验均设置三个独立的重复实验,结果表示为平均值±标准误(),采用R 软件进行Student'st-test 检验比较组间差异,P<0.05 表示差异具有显著性,P<0.01 表示差异具有极显著性。
2 结果
2.1 五指山小型猪心肌梗塞组与正常组miRNAs文库差异性分析
图1A 显示了心肌梗塞模型组(Group 1)与假手术组(Group 2)两个miRNA 文库检出的miRNAs 情况。 两组共检出的miRNAs 为645 个,其中Group 1与Group 2 共同检出511 个miRNAs,Group 1 特异检出109 个miRNAs,Group 2 特异检出25 个miRNAs(图1A)。 两组相比较,差异表达的miRNAs 有109个(P<0.05)(图1B),其中差异极显著的miRNAs有25 个(P<0.01)(图1B)。
2.2 miR-144、 miR-21-3p、 miR-142-5p 及miR-27b-3p 小片段转染HUVECs 效率的检测
提取人的ANGPT-2 3′UTR DNA 序列,使用TargetScan、MiRanda、RNAhybrid 这3 个软件预测靶标于ANGPT-2 的潜在miRNAs,三个软件同时预测到,并且在2.1 中差异表达的miRNAs 为miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p(图2)。
我们进一步合成这4 个miRNAs 的mimics 和inhibitor,以HUVECs 为细胞模型,探索它们在心肌梗塞后对血管再生的作用。 经qRT-PCR 检测,与mimic 对照组相比,转染miR-144(图3A)、miR-21-3p(图3B)、miR-142-5p(图3C)及miR-27b-3p(图3D)的mimic 后,它们在HUVECs 中的相对表达量分别上调2775、801、107 和239 倍(P<0. 01);与inhibitor 对照组相比,在HUVECs中转染miR-144(图3E)、miR-21-3p(图3F)、miR-142-5p ( 图 3G) 及 miR-27b-3p ( 图 3H)inhibitor 后,它们的表达量分别下调了10、4、33和50 倍数(P<0. 01)。
2.3 miR-144、 miR-21-3p、 miR-142-5p 及miR-27b-3p 对HUVECs 细胞增殖的影响
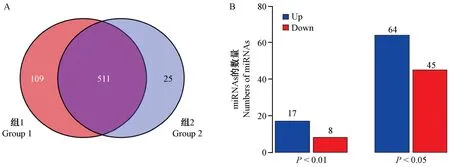
图1 Group 1 与Group 2 中miRNAs 表达差异的情况Note. A,Detection of Group 1 and Group 2 miRNAs. B,Differential expression of Group 1 and Group 2 miRNAs.Figure 1 Differential expression of miRNAs between Group 1 and Group 2
分别转染这4 个miRNAs 的mimic 和inhibitor到HUVECs,采用Edu 法分别检测miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p 对HUVECs 细胞增殖的影响(图4)。 结果显示,与mimic NC 组相比,miR-144 mimic 促进HUVECs 的细胞增殖(图4A,P<0.01),而miR-21-3p mimic(图4A,P<0.01)、miR-142-5p mimic(图4A,P<0.01)和miR-27b-3p mimic(图4A,P<0.01)显著抑制HUVECs 细胞增殖;与inhibitor NC 组相比,miR-144 inhibitor 对HUVECs 的细胞增殖无显著影响(图4B,P>0.05),miR-21-3p inhibitor(图4B,P<0.05)、miR-142-5p inhibitor(图4B,P<0.05)和miR-27b-3p inhibitor(图4B,P<0.05)能显著促进HUVECs 的细胞增殖。
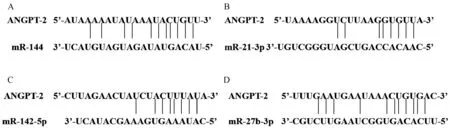
图2 ANGPT-2 预测潜在miRNAs 的结合位点示意图Figure 2 Schematic diagram of binding sites predicted by ANGPT-2 for potential miRNAs
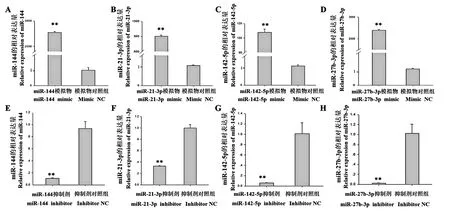
图3 miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p mimic 和inhibitor 转染效果Note.**P<0.01. Scale bars=100 μm. (The same in the following Figures)Figure 3 Transfection effect of miR-144,miR-21-3p,miR-142-5p,miR-27b-3p mimic and inhibitor
2.4 miR-144、 miR-21-3p、 miR-142-5p 及miR-27b-3p 对HUVECs 细胞迁移的影响
为进一步探索miR-144、miR-21-3p、miR-142-5p及miR-27b-3p 对HUVECs 细胞迁移的影响,我们利用Transwell 小室检测细胞迁移情况。 结果显示:与mimic NC 相比,miR-144 mimic、miR-21-3p mimic、miR-142-5p mimic 和miR-27b-3p mimic 能分别抑制HUVECs 的迁移(图5A,P<0.01);与inhibitor NC相比,miR-144 inhibitor、miR-21-3p inhibitor、miR-142-5p inhibitor 和miR-27b-3p inhibitor 能分别促进HUVECs 的迁移(图5B,P<0.01)。
2.5 miR-144、 miR-21-3p、 miR-142-5p 及miR-27b-3p 对HUVECs 血管形成的影响
我们进一步探索了miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p 对HUVECs 细胞血管形成的影响。 结果显示:与mimic NC 相比,miR-144 mimic(P<0.01)、miR-142-5p mimic(P<0.01)和miR-27b-3p mimic(P<0.01)能分别显著抑制HUVECs的血管形成(图6A),miR-21-3p mimic 对血管形成无显著影响(P>0.05)(图6A);与inhibitor NC 相比,miR-144 inhibitor(P<0.01)、miR-21-3p inhibitor(P<0.01)、miR-142-5p inhibitor(P< 0.01) 和miR-27b-3p inhibitor(P<0.01)能分别显著促进HUVECs 的血管形成(图6B)。
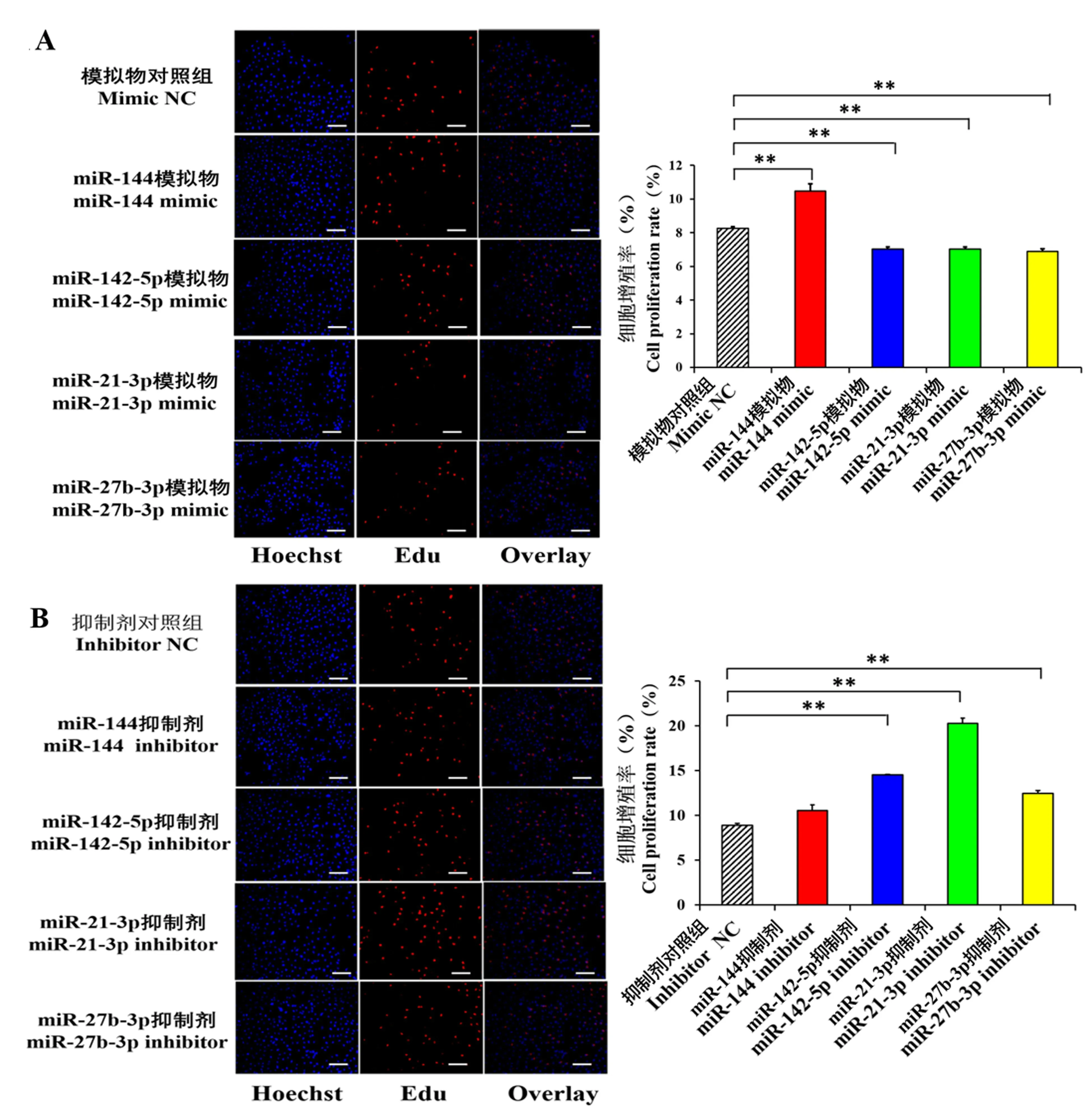
图4 miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p mimic(A)和inhibitor(B)对HUVECs 细胞增殖的影响Figure 4 Effects of miR-144,miR-21-3p,miR-142-5p and miR-27b-3p mimic(A)and inhibitor(B)on the proliferation of HUVECs
2.6 miR-144、 miR-21-3p、 miR-142-5p 及miR-27b-3p 对ANGPT-2 转录表达的影响
为了探究miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p 对潜在靶基因ANGPT-2 转录表达的影响,在HUVECs 中转染miR-144、miR-21-3p、miR-142-5p 和miR-27b-3p mimic 及inhibitor 24 h 后,我们检测了ANGPT-2 mRNA 表达量。 结果显示:与mimic NC 组相比,转染miR-144 mimic(图7A,P<0.01)、miR-21-3p mimic(图7B,P<0.01)、miR-142-5p mimic(图7C,P< 0.01),和miR-27b-3p mimic(图7D,P<0.01)均能显著下调ANGPT-2 mRNA 的水平;与inhibitor NC 组相比,转染miR-144 inhibitor(图7E,P<0.01)和miR-21-3p inhibitor(图7F,P<0.01)能显著下调ANGPT-2 mRNA 的水平,但是miR-142-5p inhibitor(图7G,P<0.01)和miR-27b-3p inhibitor(图7H,P< 0.01) 能显著上调ANGPT-2 mRNA 的水平。
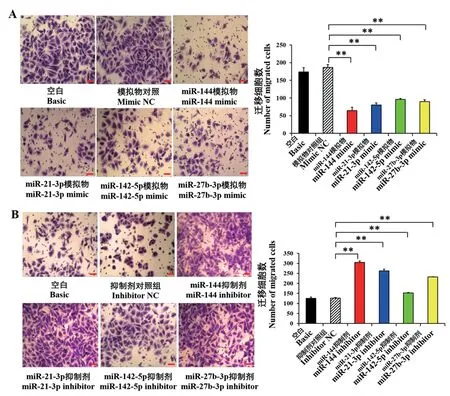
图5 miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p mimic(A)和inhibitor(B)对HUVECs 迁移的影响Figure 5 Effects of miR-144,miR-21-3p,miR-142-5p and miR-27b-3p mimic(A)and inhibitor(B)on the migration of HUVECs migration
3 讨论
与大鼠、小鼠等模型动物相比,猪冠状动脉血液供应分布几乎与人相同,心脏和血管尺寸更接近人;五指山小型猪由于体型小、便于操作是研究心肌梗塞的合适模型[21-22]。 目前,人们利用五指山小型猪成功的构建了多种疾病模型,对于构建不同疾病模型,方法上也有所不同,但技术已经相当成熟。顾晓龙等[23]利用介入封堵法构建了五指山小型猪的急性心肌梗塞合并急性心力衰竭模型,苏强等[24]应用微导管介入技术建立小型猪急性冠状动脉微栓塞模型。 这些证据表明,五指山小型猪疾病模型已广泛应用于人类疾病的病理研究。 研究表明,miR-21[25]、miR-1[26]、miR-186-5p[27]、miR-208[28]、miR-499[28]等由于在心肌梗塞早期高表达量,并推荐这些miRNAs 可以作为心肌梗塞疾病的标记物。这些研究表明,miRNAs 可能在心肌梗塞后血管再生中起着重要作用。
提取ANGPT-2 3′ UTR 的DNA 序 列,使 用TargetScan、MiRanda、RNAhybrid3 个预测软件,预测miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p 可能靶标于ANGPT-2(图2)。 心肌梗塞的小鼠与对照组的小鼠相比,敲除miR-144 能显著抑制细胞外基质的重塑,增加心肌梗塞区域,阻碍心脏的重塑和心脏功能的恢复[29]。 miR-21 在心脏结构重构、冠心病等方面都发挥着重要的生物学作用,是心肌梗塞疾病发生前期的标志物[30]。 miR-142-5p 被认为是心力衰竭标志miRNAs 之一,miR-142-5p 可以通过靶标TP53INP1 基因调控心肌细胞的损伤修复[31]。 在心肌细胞中,miR-27b 的高表达能引发心肌肥大和心脏功能障碍[32]。 这些证据表明,miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p 在心脏类疾病中扮演着重要角色。 在本研究中,分别转染了miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p的mimics 和inhibitor 后,检测了ANGPT-2 的相对表达量变化(图7)。 我们发现,miR-144 和miR-21-3p的mimic 及inhibitor 均显著上调ANGPT-2 mRNA 的表达水平(图7A,B,E,F),可能是miR-144 和miR-21-3p 不直接靶标并调控ANGPT-2 的表达,而miR-144 和miR-21-3p 的真实靶基因可能间接影响ANGPT-2 的转录表达;另外,miR-142-5p 和miR-27b-3p mimics 能显著下调ANGPT-2 的表达量(图7C,D),而miR-142-5p 和miR-27b-3p inhibitor 能显著上调ANGPT-2 的表达量(图7G,H)。 这些结果表明,miR-142-5p 和miR-27b-3p 可能通过靶标于ANGPT-2 3′UTR 并且抑制ANGPT-2 的转录表达。

图6 miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p mimic(A)和inhibitor(B)对HUVECs 血管形成的影响Figure 6 Effects of miR-144,miR-21-3p,miR-142-5p and miR-27b-3p mimic(A)and inhibitor(B)on the formation of blood vessels in HUVECs
心肌梗塞后,修复心脏功能的关键是毛细血管网能否重建即血管再生。 在本研究中,利用EDU(图4)、transwell(图5)以及体外成腔(图6)实验方法,检测超表达或抑制miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p 后,HUVECs 细胞的增殖、迁移及血管形成情况。 从Edu 结果来看,转染miR-144 mimic/inhibitor 后,细胞增殖的趋势是一致的(图4A,B),推测miR-144 并不能直接影响HUVECs的增殖,但transwell 以及体外成腔实验结果表明,miR-144 能抑制细胞的迁移及成管(图5 和图6)。miR-21-3p 能抑制HUVECs 细胞增殖和迁移(图4);miR-21-3p mimic 对HUVECs 成管无显著影响(图6A),但miR-21-3p inhibitor 能显著促进HUVECs 成管(图6B),猜测miR-21-3p 不能直接影响HUVECs的成管,可能是miR-21-3p 调控的靶基因对血管形成有间接作用。 miR-142-5p 和miR-27b-3p 能抑制HUVECs 细胞增殖、迁移及成管(图4-6)。 这些结果表明,心肌梗塞后,miR-142-5p 和miR-27b-3p 可能通过靶标于ANGPT-2 的3′UTR 并且抑制ANGPT-2 的转录表达,抑制血管内皮细胞的增殖、迁移及血管形成,进而抑制血管再生、阻碍心脏功能的恢复。这些结果为深入探索miRNAs 调控心肌梗塞后的血管再生提供一定的参考。
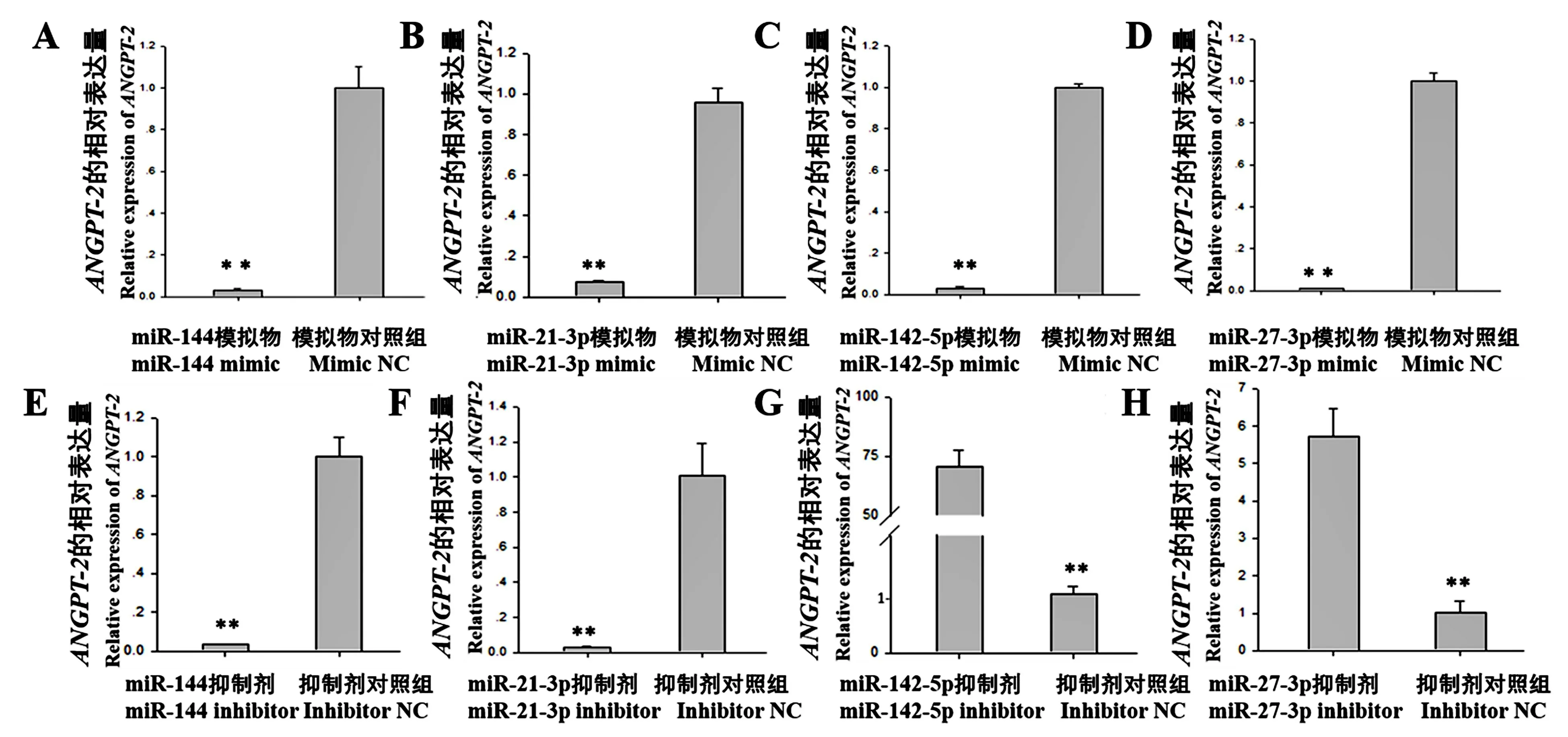
图7 miR-144、miR-21-3p、miR-142-5p 及miR-27b-3p mimic 和inhibitor 对ANGPT-2 转录表达的影响Figure 7 Effects of miR-144,miR-21-3p,miR-142-5p and miR-27b-3p mimic and inhibitor on the mRNA expression ofANGPT-2
