新型高脂血症易感(WSHc)大鼠非酒精性脂肪肝病模型的建立与病理特点研究
2020-07-08马全鑫张利棕戎亦骊何蒙娜郁晨蔡月琴陈民利
马全鑫,张利棕,戎亦骊,何蒙娜,郁晨,蔡月琴,陈民利*
(1. 浙江中医药大学,动物实验研究中心/比较医学研究所,杭州 310053)2. 浙江大学医学院附属第一医院,超声医学科,杭州310003)
全球代谢综合征患病率不断上升同时,非酒精性脂肪肝病( non-alcoholic fatty liver disease,NAFLD)成为全球最常见的慢性肝病之一[1]。 导致NAFLD 的主要危险因素包括肥胖、2 型糖尿病及血脂异常与代谢综合征,其发病机制复杂且目前尚不明确[2]。 动物模型是研究疾病发病机制、研发治疗药物以及研究防治策略的重要环节。 目前已有多种NAFLD 动物模型,主要分为膳食动物模型、遗传动物模型和药物诱导模型[3]。 迄今为止,大多数这些模型的共同之处在于有肝脂质积聚,但没有明显的炎症和纤维化[4]。
大小鼠是最常用的实验动物,遗传信息明确且易于获得。 但大小鼠模型血清血脂水平、脂蛋白构成、脂质代谢过程与人类存在较大差异,耐受高脂,极难形成肝纤维化[5]。 Wistar-SD 高脂血症易感(Wistar-SD Hyperlipidemia,WSHc)大鼠是本动物实验研究中心发现并培育研究的一种特色实验动物品系。 该品系来源于一只自发性突变的Wistar 大鼠,这只大鼠经高脂饲料诱导后,血清TC 浓度高达20.26 mmol/L。 将其与SD 大鼠杂交后进行保种传代,经过不断选育,培育至第四代时雌性WSHc 大鼠经高脂饲喂2 周时,血清TC 值大于5.0 mmol/L 的发生率约为80%,并在第8 周时达到血脂峰值,始终处于高于临床诊断标准的高血脂状态,且易形成心功能受损和早期动脉粥样硬化等心血管并发症[6]。该大鼠具有特殊的脂代谢模式,对高脂血症及相关并发症易感,是具有潜力的脂代谢相关疾病的动物模型。
基于此,本研究取培育的第五代WSHc 大鼠,筛选高脂血症易感的雌性大鼠,通过高脂饲料诱导建立WSHc 大鼠NAFLD 疾病模型,观察该模型肝脂质沉积、炎症反应、纤维化程度,明确该模型发病的一般规律和病理特点,分析其应用与科学价值。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级20 只7 ~8 周龄雌性Wistar 大鼠,来源于上海斯莱克实验有限公司【SCXK(沪)2017-0005】;20 只雌性7 ~8 周龄WSHc 大鼠,本课题组繁殖,饲养于浙江中医药大学动物实验研究中心屏障实验室【SYXK(浙) 2018-0012】,环境温度:(22± 2)℃,相对湿度:50% ~60%,光照:12 h/12 h 明暗交替,噪声<50 dB;在IVC 笼内饲养,自由饮食。在实验过程中按“3R”原则给予人道的关怀。 浙江中医药大学实验动物伦理审查委员会通过,决议编号:IACUC-20181126-02。
1.1.2 主要试剂和仪器
总胆固醇(total cholesterol,TC)、三酰甘油( triylglycerides,TG )、 谷 丙 转 氨 酶 ( alanine aminotransferase,ALT)、 谷 草 转 氨 酶( aspartate aminotransferase,AST)检测试剂,均购自上海申能德赛诊断技术有限公司;苏木色精,购自上海伯奥生物科技有限公司;曙红Y,购自国药集团化学试剂有限公司;天狼星红染色试剂盒,购自Servicebio 公司;油红O 染料,购自SIGMA 公司;CD68 抗体,购自美国Santa Cruz 公司;Mounting Medium With DAPI,购自北京中杉金桥生物技术有限公司。 普通基础饲料购自南京爱立默科技有限公司,辐照全营养颗粒饲料。 高脂饲料配方:胆固醇1%、猪油10%、蛋黄粉10%、3 号胆盐0.5%、基础饲料78.5%。
Aixplorer 超声成像仪(法国,声科公司),7020全自动生化分析仪(日本,日立公司);HM335E 半自动石蜡切片机(德国,Microm 公司);Nana Zoomer 2.0RS 数字切片扫描设备(日本,滨松公司);自动染色机(德国,Leica 公司);VS120-S6-W 数字病理切片(荧光)扫描分析仪(日本,Olympus 公司)。
1.2 实验方法
1.2.1 动物模型的建立
取20 只7 ~8 周龄的SPF 级雌性Wistar 大鼠,随机分为2 组,分别饲喂普通饲料(standard chows,SC)和高脂饲料(high-fat diet,HFD),每组10 只,即Wistar + SC 组和Wistar + HFD 组。 取本中心培育的第五代7 ~8 周龄的雌性WSHc 大鼠,筛选10 只高脂诱导2 周后TC 水平在5.0 ~9.0 mmol/L 之间的大鼠(发病率约为80%),为WSHc + HFD 组,另取10 只雌性WSHc 大鼠饲喂普通饲料,即WSHc +SC 组,持续饲喂高脂饲料时间为12 周。
1.2.2 血液生化检测
动物禁食12 h,颌下静脉取血,3000 r/min 离心10 min,分离血清,全自动生化仪检测TC、TG、ALT、AST 含量。
1.2.3 超声瞬时弹性成像检测
使用Aixplorer 超声成像仪进行实时剪切波检测,Fr 12 Hz 探头,每只动物反复测量肝最大叶5次,每次均包括该区的硬度及速度的最大值、最小值和平均值,将5 次所得数据统计平均值作为最终实验数据。
1.2.4 肝大体与病理组织学观察
实验结束后,对大鼠实施安乐死,称取体重与肝重。 取大鼠肝最大叶,一式三份,一部分经中性甲醛固定后,常规脱水、石蜡包埋后切片,行HE 染色,在光镜下观察病变情况;一部分用冰冻切片包埋剂包埋,冰冻切片后,油红O 染色,观察脂质沉积程度,使用Masson 染色观察肝纤维化程度;另一部分冻存,用于肝脂质含量测定。
1.2.5 肝脂质含量检测
取同部位肝组织200 mg 左右,并记录重量,加2 mL 氯仿/甲醇(2 ∶1)混合液,使用生物样本均质机匀浆。 4500 r/min 离心10 min。 将上清相转移到新的离心管中,并加0.2 倍体积的生理盐水,摇晃10 min。 2000 r/min 离心5 min,分层。 将下层含油脂的液相小心的转移到新的试管中,蒸发至液体挥干(过夜)。 用2 mL 含10% TritonX-100 的异丙醇溶液溶解油脂。 用试剂盒测定溶液中TC、TG 的浓度,并根据称取的组织重量计算肝TC、TG 含量。
1.2.6 非酒精性脂肪肝活动性(Non-alcoholic fatty liver activity score,NAS)评分
参照美国NASH 临床研究协作网推荐的半定量诊断方式,对肝的脂肪变性、小叶炎症和肝细胞气球样变3 项组织学特征进行评分,进而评估脂肪肝受损的严重程度[7]。 并依据纤维化的范围和形态,分为4 级(0 ~3):0 分(无纤维化);1 分(小叶内局灶性或广泛的窦周/细胞周纤维化);2 分(纤维化扩展到门管区,局灶性或广泛的门管区星芒状纤维化);3 分(纤维化扩展到门管区周围,局灶性或广泛的桥接纤维化)。 4 项得分相加即为NAS 评分总分。
1.2.7 巨噬细胞免疫荧光染色
取石蜡切片,脱蜡至水,经修复后,加入3%H2O2溶液。 将稀释后的CD68 抗体覆盖组织,切片平放于湿盒内,37℃孵育2 h 后,洗涤,加入荧光二抗,37℃孵育1 h 后DAPI 染色封片,其中激活的巨噬细胞呈红色荧光,蓝色荧光为细胞核。
1.3 统计学分析
所有数据用平均值±标准差(±s)表示,采用SPSS 22.0 软件进行Studentt检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 WSHc 大鼠一般体征与血液生化的变化情况
如图1 所示,高脂诱导12 周后,各组大鼠体重与采食量无显著差异(P>0.05),与对应品系的正常对照组大鼠比较,WSHc + HFD 组与Wistar +HFD 组大鼠血清TC 与ALT 水平均显著升高(P<0.05,P<0.01),且WSHc + HFD 组TC 与ALT 显著高于Wistar + HFD 组(P<0.05,P<0.01)。 各组之间TG 与AST 差异不具有显著性(P>0.05)。
2.2 WSHc 大鼠肝弹性成像的变化
由图2 可见,与对应品系的正常对照组大鼠比较,WSHc + HFD 组肝弹性模量值与剪切波穿透速度显著增加(P<0.05),而Wistar + HFD 组变化无显著统计学差异(P>0.05),说明饲喂高脂饲料的WSHc 大鼠肝硬度增加。

图1 各组大鼠一般体征与血液生化的变化Note. A,Changes of TC content of rats in each group. B,Changes of TG content of rats in each group. C,Changes of ALT content of rats in each group. D,Changes of AST content of rats in each group.. E,Body weight of rats in each group. F,Food intake of rats in each group.Compared with the ordinary feed group,*P<0.05,**P<0.01. Compared with the two groups fed with high-fat diet,#P<0.05,##P<0.01.(The same in the following Figures)Figure 1 Changes in the general signs and biochemicals of the blood of rats in each group

图2 各组大鼠肝弹性成像与定量分析Note. A,Changes of weight in ZDF rats. B,Changes in liver elasticity modulus values of rats in each group. C,Changes in the rate of shear wave penetration of rats in each group.Figure 2 Liver elasticity imaging and quantitative analysis of rats in each group
2.3 WSHc 大鼠肝大体观察与脂质含量的变化
由图3 可见,饲喂普通饲料的Wistar 与WSHc大鼠肝均未见异常,Wistar + HFD 组大鼠肝呈淡黄色,有红色点状散在,稍显油腻;WSHc + HFD 组大鼠肝呈灰黄色,表面油腻。 经定量检测后发现,Wistar + HFD 组与WSHc + HFD 组肝中TC、TG 含量与肝系数均显著增加(P<0.01),且WSHc +HFD 组脂质含量略高于Wistar +HFD 组,但差异不具有显著性(P>0.05)。 (见图3)
2.4 WSHc 大鼠肝病理学变化
2.4.1 WSHc 大鼠肝常规病理染色及评分
饲喂普通饲料的Wistar 与WSHc 大鼠肝组织结构清晰,小叶中央静脉结构完好,肝索排列整齐、肝窦清晰可见,肝细胞形态正常,胞浆红染,汇管区清晰可见。 WSHc + HFD 组与Wistar + HFD 组肝小叶结构边界不清,肝细胞排列紊乱,索状结构消失,大量肝细胞浊肿,出现小泡性脂肪变性,且WSHc +HFD 组出现较多炎症细胞浸润,见图4A。
与对应品系的正常对照组大鼠比较,WSHc +HFD 组与Wistar + HFD 组大鼠肝组织脂肪变性、炎症程度、气球样变和纤维化评分均显著升高(P<0.01),且WSHc + HFD 组炎症程度和纤维化程度显著高于Wistar + HFD 组(P<0.05),脂肪变性和气球样变差异不具有显著性(P>0.05),见图4B。
2.4.2 WSHc 大鼠肝油红O 染色与Masson 染色
油红O 染料可与脂质结合,呈红色。 由图5A可见,饲喂普通饲料的Wistar 与WSHc 大鼠肝均未见阳性染色,Wistar+ HFD 组肝阳性染色呈小颗粒散在分布,WSHc + HFD 组肝阳性染色汇聚成较大颗粒。
Masson 染色中,胶原沉积呈蓝色。 由图5B 可见,饲喂普通饲料的Wistar、WSHc 大鼠及Wistar +HFD 组大鼠肝均未见异常胶原沉积,WSHc + HFD组肝小叶内可见局灶性的窦周胶原沉积存在。
2.4.3 WSHc 大鼠巨噬细胞染色结果
如图6 所示,CD68 标记激活的巨噬细胞。 免疫荧光结果可见,饲喂普通饲料的Wistar 与WSHc 大鼠肝CD68 阳性表达较少,Wistar + HFD 组与WSHc+ HFD 组阳性阳性表达显著增多,且WSHc + HFD组阳性表达显著多于Wistar + HFD 组。
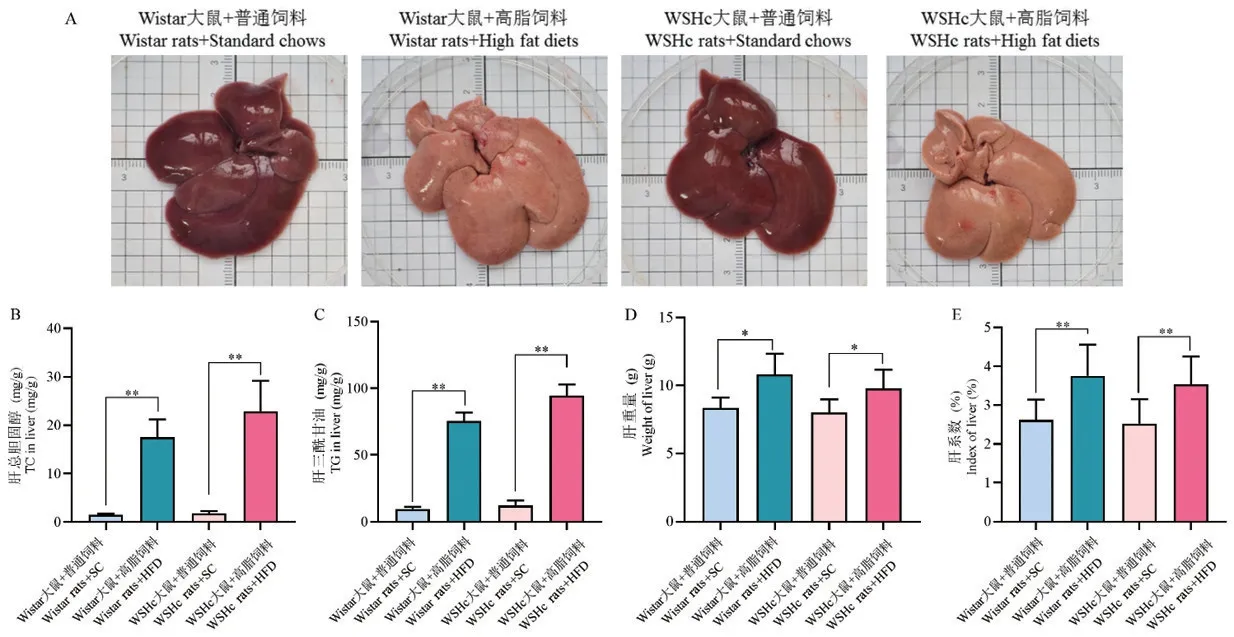
图3 各组大鼠肝大体与脂质含量变化Note. A,Livers in each group of rats were generally observed. B,Changes in TC content of rats in each group. C,Changes in TG content of rats in each group. D,Changes in liver weight of rats in each group. E,Changes in liver index of rats in each group.Figure 3 Changes in the gross and lipid content of liver in each group of rats
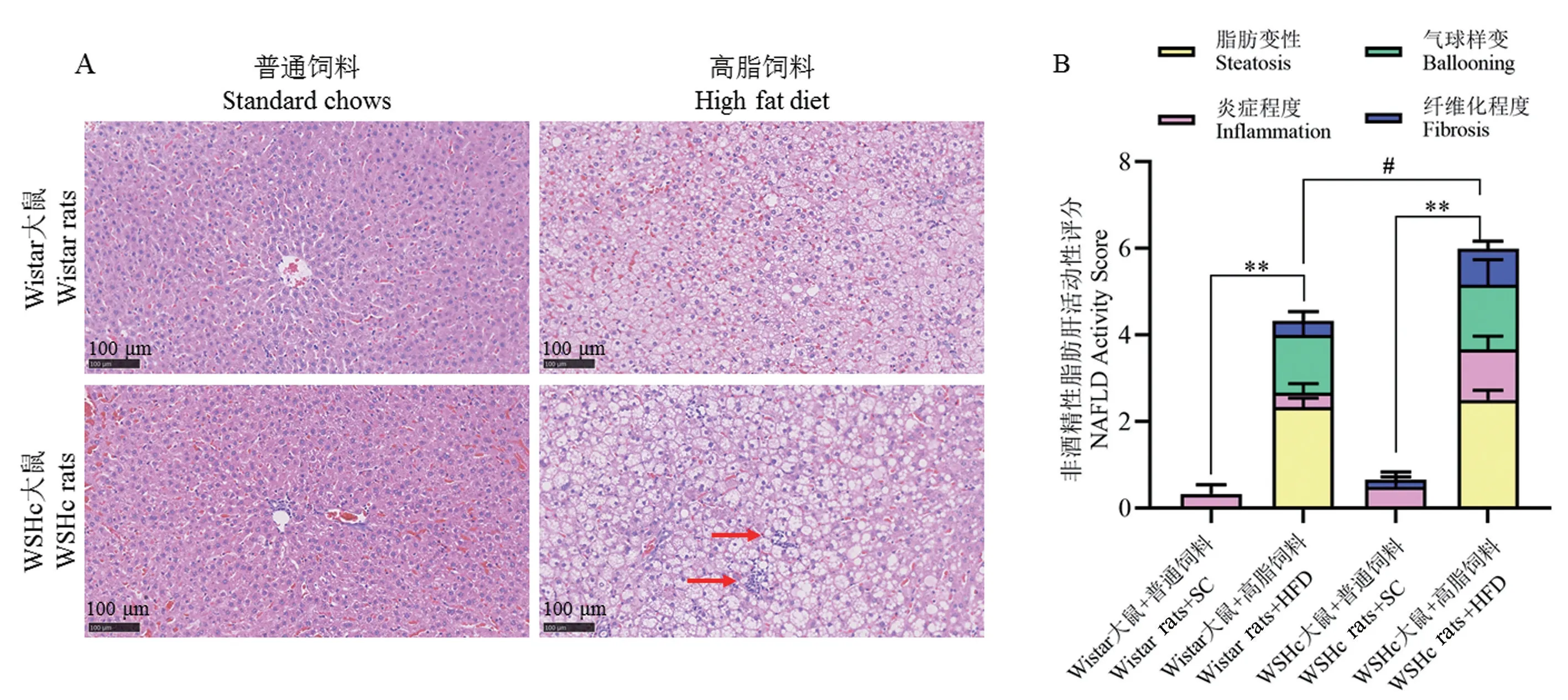
图4 各组大鼠肝HE 染色结果与NAS 评分Note. A,HE staining of liver in each group of rats,the red arrow refers to inflammatory cells immersion.B,NAS score of rats in each group.Figure 4 HE staining results and NAS score of liver in each group of rats
3 讨论
NAFLD 是全球最常见的慢性肝病,普通成人NAFLD 患病率介于6.3% ~45%[8]。 NAFLD 的病理生理过程目前尚不能完全阐述,理想的动物模型在研究NAFLD 的发病机制中发挥重要作用。 然而,目前常用的大小鼠动物模型均无法较好的模拟人类NAFLD 的发生发展和病理特征[9]。 Wistar-SD 高脂血症易感(WSHc)大鼠是本动物实验研究中心目前自主培育并研究的一个大鼠新品系,来源于本课题组偶然发现的一只Wistar 大鼠,该大鼠经4 周高脂饲料诱导后血清TC 浓度高达20.26 mmol/L,而此时同一批次的其余Wistar 大鼠TC 平均值仅为(2.20 ± 0.34) mmol/L。 将该大鼠与SD 大鼠交配后进行保种传代,目前已形成一定数量的封闭群。该群第四代大鼠经过高脂诱导后,约75%的雌性大鼠TC 水平在5.0 ~14.9 mmol/L 之间,虽然低于始发现的大鼠,却依然具有高胆固醇血症的特性,并能长期保持稳定[6]。 而雄性大鼠TC 水平与常规大鼠无显著差异。 提示WSHc 大鼠存在性别差异,遗传模式可能为伴性遗传。 本课题组对WSHc 大鼠肝基因表达分析时发现,WSHc 大鼠肝Srebp1 基因表达异常升高。 文献报道,Srebp1 在肝脂质代谢中起关键作用,持续高表达会加速NAFLD 的发生[10]。由此可见,WSHc 大鼠作为高脂血症易感大鼠,具有独特的脂代谢模式,在NAFLD 模型的建立和应用方面具有一定的优势和的潜力。 本研究通过高脂饲料诱导建立WSHc 大鼠NAFLD 疾病模型,检测血液生化并观察病理特征,分析高脂诱导WSHc 大鼠NAFLD 模型的特点和价值。
血脂紊乱是NAFLD 的重要危险因素[11]。NAFLD 患者肝内游离脂肪酸氧化增加,肝糖原利用受到抑制,表现为脂质成分在肝细胞中沉积,进一步发生血脂紊乱[12]。 本实验研究发现,Wistar 大鼠经高脂诱导后,TC 水平有一定程度的上升,但与临床上的高脂血症标准相距甚远。 而WSHc 大鼠经高脂诱导后,TC 平均水平能达到8.0 mmol/mL 以上,表明高脂环境下,WSHc 大鼠血脂水平较常规大鼠更接近临床,推测其原因可能是WSHc 大鼠经高脂诱导发生了肝细胞损伤。 ALT 与AST 在肝细胞中承担转运氨基酸的作用,两者均是肝细胞损伤的标记物。 临床研究发现,NAFLD 患者与严重的肝纤维化患者血清ALT 水平均显著高于正常人群,且ALT/AST 比值异常[13]。 本研究发现,WSHc 大鼠经高脂诱导后,ALT 水平显著上升,而在Wistar 大鼠中未见这一现象,提示高脂环境下,WSHc 大鼠更易发生肝细胞损伤。
NAFLD 涉及一系列广泛的肝组织病理变化,如脂质异常沉积、炎症细胞浸润和纤维化,根据肝不同病理变化进行疾病分期诊断依然是目前临床诊断的金标准。 肝脂质沉积是NAFLD 最具特征性的病变,病症不同阶段,脂质沉积的部位和数量不同。临床研究表明[14],在单纯肝脂质沉积阶段,肝细胞脂肪沉积呈小泡状;而脂肪性肝炎阶段则表现为肝细胞大泡性或以大泡性为主的混合型脂肪变。 本实验通过肝脂质成分定量检测发现,WSHc 大鼠与Wistar 大鼠经高脂诱导后,均有大量脂质沉积于肝组织,但通过观察肝内脂滴形态可见,高脂饲喂的Wistar 大鼠肝组织中,脂滴细密均匀,而高脂饲喂的WSHc 大鼠肝中则多见大泡性脂滴,提示WSHc 大鼠肝除了单纯的脂肪变性之外,还发生了脂肪肝炎病变。
目前,超声弹性成像技术已被用于多种肝疾病的诊断[15],如病毒型肝炎性肝纤维化、肝硬化等,具有良好的灵敏度及特异度。 而剪切波弹性成像(shear wave elastography,SWE)是临床上一种新兴的超声弹性成像技术,可通过剪切波的穿透速度测算设定区域的肝弹性模量值。 多项研究表明,随着NAFLD 的发生发展,肝细胞发生脂肪变性、坏死,继而出现胶原沉积形成肝纤维化,肝纤维化形成后,肝组织硬度逐渐增加,继而可反映在剪切波穿透速度和肝弹性值模量值上[16]。 本实验研究发现,饲喂高脂饲料的Wistar 大鼠弹性模型值无显著增加,而饲喂高脂饲料的WSHc 大鼠弹性模型值显著增加,进一步Masson 染色可见,高脂饲喂的WSHc 大鼠肝纤维化程度显著提高,提示WSHc 大鼠相比于Wistar 大鼠,更易受高脂饲料诱导形成肝胶原异常沉积。
NAFLD 的发展过程中,伴随着炎症细胞的浸润和肝巨噬细胞的激活和极化[17]。 当肝发生损伤时,巨噬细胞大量增殖,并与其他定居细胞等共同招募循环中的单核细胞迁移至炎性灶并分化成更多的巨噬细胞[18]。 巨噬细胞的增多在严重的炎症反应中发挥重要的作用,会进一步加重肝毒性,巨噬细胞的数量可反应肝损伤与炎症程度[19]。 本实验研究发现,高脂诱导的WSHc 大鼠肝中存在较多的白细胞浸润,尤其是在较大脂滴的富集,常常可见明显的炎症灶;通过免疫荧光染色可见,高脂饲喂的WSHc 大鼠肝中活化的巨噬细胞显著增多,而高脂诱导的Wistar 大鼠则增多不明显,进一步证实了高脂环境下WSHc 大鼠较常规大鼠易产生炎症反应和肝组织损伤。
综上所述,WSHc 大鼠经高脂诱导后,血清总胆固醇显著升高并与临床高脂血症患者接近;肝脂质异常沉积并形成大泡性脂滴;脂滴周围有炎症细胞浸润形成炎症灶,巨噬细胞增多;可见散在的纤维化病变。 然而,这些病理变化在高脂诱导的Wistar大鼠肝组织中并未发现。 由此可见,相较于常规大鼠,高脂诱导WSHc 大鼠可建立一种更接近临床的NAFLD 动物模型,其特色在于与临床水平接近的血液生化指标、严重的炎症反应和肝纤维化。 其发病机制尚不明确,需进一步研究探讨。
