人体肝脏靶向性新型AAV 血清型载体的研发
2020-07-08宁秦洁闫梦迪胡泽岚杜增民
宁秦洁, 陈 颖, 闫梦迪, 胡泽岚, 吴 侠, 杜增民, 郑 静, 肖 啸
(华东理工大学药学院,神经分子药理学实验室,上海 200237)
基因治疗(Gene Therapy)是通过基因水平改变来治疗疾病的方法,即通过基因载体(通常为改造过的病毒)导入一段有独立功能的基因进入体细胞,代替或纠正已经发生突变的基因进行独立表达,发挥其原本应该有的功能。经过近三十年的发展,基因治疗己经由最初用于单基因遗传病的治疗扩大到恶性肿瘤、感染性疾病、心血管疾病、自身免疫性疾病、代谢性疾病等多种重大疾病的治疗。
腺相关病毒(Adeno-associated Virus, AAV)是目前基因治疗领域中最常用的病毒载体之一,是细小病毒家族的成员,具有约4.7 kb 的单链DNA 基因组[1-2]。AAV 基因治疗的安全性、有效性和持续性表达已经在绝大多数基因治疗的临床试验中得到了证实[3-11]。然而30%~40%的人群存在AAV中和抗体(Neutralizing Antibody, Nab),这些预先存在的AAV中和抗体,即使在适度的滴度下,也能够在给予AAV 后阻止其成功转导。因此会导致功能基因表达量的降低,甚至产生免疫毒性,这类患者都不适用目前的治疗方案[10]。所有临床研究中的一致观察结果是针对AAV 转导的肝细胞的免疫应答的风险取决于载体剂量[12-14]。这一观察结果突出了一个基本的治疗原则,即需要使用最低剂量,从而产生临床效益,同时尽量减少不良事件的风险。
由于天然wt AAV(Wild type AAV)感染,在大部分人群中发现Nab,而新型AAV 血清型载体在人体内的中和抗体量较少,因此研发新型的AAV 血清型载体在一定程度上可以克服中和抗体对基因治疗的影响。设计用于靶向递送基因的AAV 衣壳的筛选(其通常依赖于序列分析和合理的肽插入)已经取得了一些成功,但是由于AAV 载体介导的免疫反应的发生以及载体包装的报告基因的活性较低等因素的影响,这些新型AAV 载体可能不是最理想的基因治疗载体[15-17]。
目前针对AAV 衣壳的设计优化的主要方法为合理设计、计算机生物信息学、自然发现和定向进化方法。合理设计即利用衣壳生物学和宿主细胞靶标的预先存在的知识来设计组织特异性或细胞特异性细胞外标记物或免疫逃避的衣壳。虽然可以改善衣壳向性,但它也可能对衣壳的其他特征产生负面影响,例如其稳定性;计算机设计是一种新的衣壳发现方法,利用计算方法来预测自然界中未见的新衣壳设计,能够从现代衣壳重建祖先AAVs 是计算机设计的一种形式;自然发现即从自然界中发现新型AAV衣壳,但由于40%~80%的AAV 都有其相应的抗体,因此人源衣壳可能不是理想的基因治疗载体;包含DNA shuffling、error prone-PCR 在内的定向进化技术能够产生具有特定生物学特性和有利特征的AAV遗传变体(例如,组织特异性靶向、免疫逃避和转基因表达),再加上DNA shuffling 技术是对cap 基因改造能力最为有效的一种技术,它的主要优点是能够将所有的AAV 血清型载体组合在一起产生许多独特的衣壳组合,其可以具有不同且有利的载体特性,这避免单纯研究一种血清型而发生偏差,且不会在搜索序列空间方面受到限制[18]。
本研究通过DNA shuffling 技术对8 种AAV(AAV1~AAV4,AAV6~AAV9)cap 基因序列进行DNA改组,利用wt Ad5 对Hep G2 细胞进行超感染,在Hep G2 细胞内复制AAV 颗粒,通过Hep G2 细胞筛选新型AAV 血清型载体,将不同AAV 血清型载体分别包装目的基因GFP,观察不同AAV血清型载体介导的绿色荧光的表达,同时对所筛选的新型血清型载体同其他血清型一起分别在小鼠中进行中和抗体的检测。本文首次通过人肝癌Hep G2 细胞筛选新型AAV 血清型载体改变衣壳向性的同时增强基因的传递,逃避AAV 中和抗体。
1 实验部分
1.1 原料和试剂
AAV1~AAV4,AAV6~AAV9 共8 种血清型腺相关病毒、含有ITR 序列和氨苄抗性的pAAV-mcs、大肠杆菌TOP10、pAAV-GFP、pAd-Helper、wt Ad5 均为本实验室所有;HEK293 细胞、Hep G2 细胞均购自ATCC 公司,Taq 聚 合酶、T4 连 接酶、DNase I 酶、Benzonase 酶均购自Takara 公司;胶回收试剂盒、Plasmid Max Kit(25)均 购 自Omega 公 司;Dneasy Blood&Tissue Kit(250)购自QIAGEN 公司;聚乙二醇(PEG 8000)、碘克沙醇、蛋白酶K 均购自Sigma-Aldrich 公司;Zeta-Probe GT 印迹膜购自Bio Rad 公司;各种限制性核酸酶、Silver SNAP 染色试剂盒II 购自Thermo Fisher Scientific 公司;胎牛血清(Fetal Bovine Serum,FBS)、磷酸缓冲盐溶液(Phsphatte Buffered Saline,PBS)、DMEM 培 养 基(Dulbecco's Modified Eagle Medium)、双抗(Penicillin-Streptomycin,Liquid)及胰蛋白酶(0.25 g/mL)均购自BI 公司。
1.2 实验仪器
高速离心机(CR21N 型),购于日本日立公司;蛋白纯化仪(NGC QUEST10 型)、蛋白纯化收集器(Bio Frad 型),均购于美国Bio Rad(伯乐)公司;脱色摇床(翘板)(SK-R1807-E 型),购于大龙兴创实验仪器(北京)有限公司;超净工作台(SW-CJ-2FD 型),购于苏净安泰空气技术有限公司;全温落地摇床(ZWY-211C型),购于上海智城分析仪器制造有限公司;生化培养箱(SHP-250 型),购于上海精宏实验设备有限公司;PCR 仪(Veriti DX 型),购于美国应用生物系统(ABI)公司;紫外透照台(TL-TM FL-26 型),购于上海默威生物科技有限公司;台式离心机(FRESCO21型),购于美国Thermo Fisher Scientific 公司;高压灭菌锅(80E 型),购于山东新华医疗器械股份有限公司;实时荧光定量PCR 仪(qTOWER3G touch 型),购于德国耶拿分析仪器公司。
1.3 实验原理和方法
1.3.1 DNA shuffling DNA shuffling 是一种通过随机片段化和聚合酶链反应(Polymerase Chain Reaction,PCR)重组对所选突变体基因库进行体外同源重组的方法。用DNase I 处理来自基因或指向同源基因的序列变体以产生随机DNA 片段。用同源DNA作为模板和引物进行PCR 扩增,将这些片段重新组装成与原始大小相同的基因,但具有可变功能[19]。
1.3.2 细胞培养、转染、病毒生产和纯化 将HEK293细胞维持在含有体积分数10%FBS 的DMEM 培养基中。使用聚乙烯亚胺(Polyethyleneimine, PEI)通过三质粒转染HEK293 细胞产生重组AAV[20-21]。在转染后72 h 从培养基中收获病毒颗粒。将细胞沉淀重悬于 含 有2 mmol/mL MgCl2、10 mmol/mL Tris(pH=8)中,冻融3 次,并用100 U/mL Benzonase 酶在37 ℃处理至少1 h。通过用含有500 mmol/mL 氯化钠、体积分数为8% PEG 8000 试剂浓缩病毒培养基,并将离心后的沉淀重悬于Tris-MgCl2中,将其与裂解液合并[22]。然后将合并的裂解液的盐离子浓度调节至500 mmol/mL ,在37 ℃下孵育30 min,并在2 000 g下离心得到澄清的裂解液。然后将澄清的裂解液分别用碘克沙醇密度梯度(15%,25%,40%和60%)离心,将病毒浓缩并储存在磷酸盐缓冲盐水(0.001 g/L Pluronic F-68 + 0.2 mol/L NaCl)中[23]。
1.3.3 斑点印迹(Dot Blot) 首先将2 μL 样品与300 U的DNase I 在25 mL 限制酶缓冲液中于37 ℃温育1 h,然 后 补 充1 mL、0.5 mol/L 乙 二 胺 四 乙 酸,调 节pH 为8.0,在100 ℃温育10 min。随后,加入1 mL蛋白酶K 混合物(4 mL、体积分数为10%十二烷基硫酸钠,4 mL或5 U 蛋白酶K,6 mL H2O)并将样品在50 ℃温育1 h。然后将蛋白酶K 反应物用H2O 稀释至100 mL,并用H2O 将5 mL 稀释的样品进一步稀释至300 mL,然后按照试剂盒说明的方法用30 ku截留分子量的Ultra-0.5 mL 离心装置处理。将回收的样品和线性化的标准品的系列稀释液在0.4 mol/L NaOH 中进行1∶20 稀释,然后转移至Zeta-Probe GT印迹膜。交联后,用来自Hybrisol I 中的载体质粒的EcoRI-PstI 片段探测膜,并根据标准方法洗涤。在暴露于存储荧光屏之后,使用图像分析软件对图像进行定量。在本研究中,斑点杂交技术用于AAV 基因治疗载体滴度测定,因为斑点印迹技术是测定 AAV基因组滴定的强有力的方法[24]。
1.3.4 银染(Silver staining) 采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)法: 在5%~12%凝胶上分离指示体积的样品,用Silver SNAP 染色试剂盒II 进行银染色,以检测病毒包装过程中空壳与实心的比例。1.3.5 AAV 中和抗体检测技术 中和抗体检测参考基于细胞体外转导抑制的测定方法[25-27]。Nabs 效价被定义为血清的最高稀释度。将表达荧光素酶的AAV 载体直接注射到6~8周龄的C57BL/6 小鼠的肝脏中。两周后镜下观察转基因的表达[25],利用酶联免疫 吸 附 测 定 技 术(Enzyme Linked Immune Sorbent Assay, ELISA)测定抗AAV 抗体的总量[28]。将对照和测试样品按照1:20 稀释,然后一式两份添加至每毫升中含有1.08×1012个 capsid AAV 的平板上[29]。
2 结果与讨论
2.1 新型AAV 血清型载体的研发
2.1.1 突变体基因库的产生 通过DNA shuffling 技术构建了AAV 血清型载体的突变体基因库如图1 所示。本研究选择8 种(AAV1~AAV4,AAV6~AAV9)用于cap 基因的DNA 改组,因为已显示AAV5 血清型载体与其他AAV 血清型载体相比具有最大的序列变异,并可能降低体外重组的效率。从质粒文库中挑选随机克隆用于检查重组AAV cap 基因的序列变异和生存力。每个病毒颗粒的 cap 基因型和表型都是一对一的对应关系,有利于连续筛选AAV 突变体基因库。
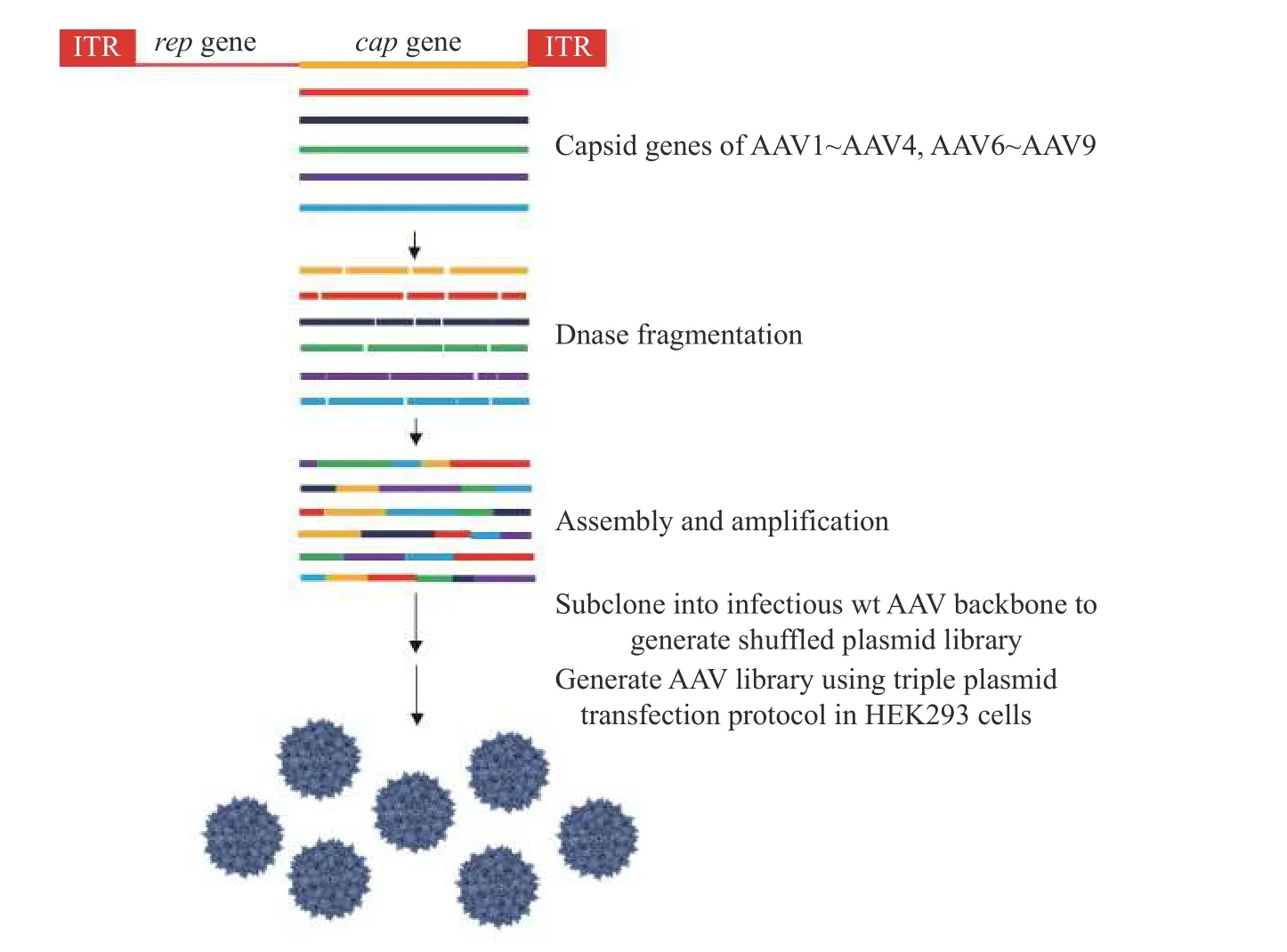
图1 通过DNA shuffling 技术构建AAV 突变体基因库Fig. 1 Construction of AAV mutant gene library by DNA shuffling
为构建随机嵌合AAV 突变体基因库,使用AAV血清型载体1、2、3、4、6、7、8 和9 作为PCR 模板。通过引物1(5'-CCC-AAGCTTCGATCAACTACGC AGACAGGTACCAA-3')和引物2(5'-ATAAGAATGCGGCCGC-AGAGACCAAAGTTCAACTGAAACGA-3')扩增衣壳基因。扩增后,使用DNase I 处理获得cap 基因混合物,处理后样品将得到许多DNA 小片段,并以相等比例混合用于DNA 改组[30]。将4 μg DNA 模板用0.04 U 的DNase I 酶在15 ℃下短暂处理。通过琼脂糖凝胶电泳纯化大小为300~1 000 bp的DNA 片段,变性,再退火并通过DNA 聚合酶修复以重新组装随机衣壳基因。通过使用DNA 聚合酶和引物1或引物2 进行扩增。PCR 程序是95 ℃,10 min;30 个循环的95 ℃,30 s;55 ℃,30 s;72 ℃,1 min;72 ℃,3 min。然后用Hind III 和Not I 消化PCR 产物,并连接到含有AAV2 Rep 基因和反向末端重复序列的并且经过Hind III 和Not I 消化的质粒骨架中。通过将上述连接的DNA 转化到DH10B 大肠杆菌细胞中获得随机感染质粒文库(pIRC)。挑选随机克隆用于限制酶分析和293 细胞中的复制和包装。最后将构建的新型病毒包装质粒同pAd-Helper 质粒共同转染HEK293细胞生产改组的感染性AAV 文库。
2.1.2 从突变体基因库筛选靶向肝脏的突变体 图2 示出了筛选获得的AAVXL12 capsid 突变体。如图2(a),我们用腺病毒wt Ad5 对Hep G2 细胞进行超感染,允许扩增内化的AAV 文库克隆。回收扩增的AAV 并进行两轮选择以富集AAV 文库,同时与Hep G2 细胞结合、内化,在Hep G2 细胞内复制AAV 颗粒。从病毒中提取基因组DNA,并以此为模板,将最终回收到的 AAV capsid 的 DNA 区域通过 PCR 进行扩增。扩增得到的cap 基因再次插入到携带有AAV2 rep 基因和ITR 序列的质粒中,获得的质粒进行测序鉴定。如图2(b),将用于wt Ad5 辅助细胞(pAd-Helper),AAV Rep 和cap(pAAV-rep/cap,即新型血清型载体)和表达基因的AAV 载体(pAAV-GFP)三质粒共同转染HEK293 细胞。在转染后的第3 d,收获重组AAV 并进行纯化以获得纯化的病毒。通过几轮筛选后,最终富集获得一种衣壳蛋白cap 突变体AAVXL12。将携带GFP 基因的不同AAV 血清型载体同所筛选到的新型血清型载体AAVXL12 分别以同一滴度感染Hep G2 细胞,在感染之后的48 h,通过荧光成像检测不同血清型载体介导GFP 基因表达。图2(c)示出了7 种不同AAV 血清型载体的荧光强度。从图2(c)能够明显看出AAVXL12的荧光强度最强,其次是AAV8、AAV9,而AAV1、AAV2、AAV6和AAV7 的荧光强度显示最弱,基本无荧光。
2.2 AAVXL12 cap 序列的组成
AAVXL12 衣壳的序列组成如图3 所示,用Align X 将AAVXL12 的测序结果与AAV1~AAV4、AAV6~AAV9 cap 序列进行对比,发现AAVXL12 cap 基因序列由AAV1、AAV2、AAV6、AAV7、AAV8 5 种AAV 的cap 基因序列组成,全长2 103 bp。
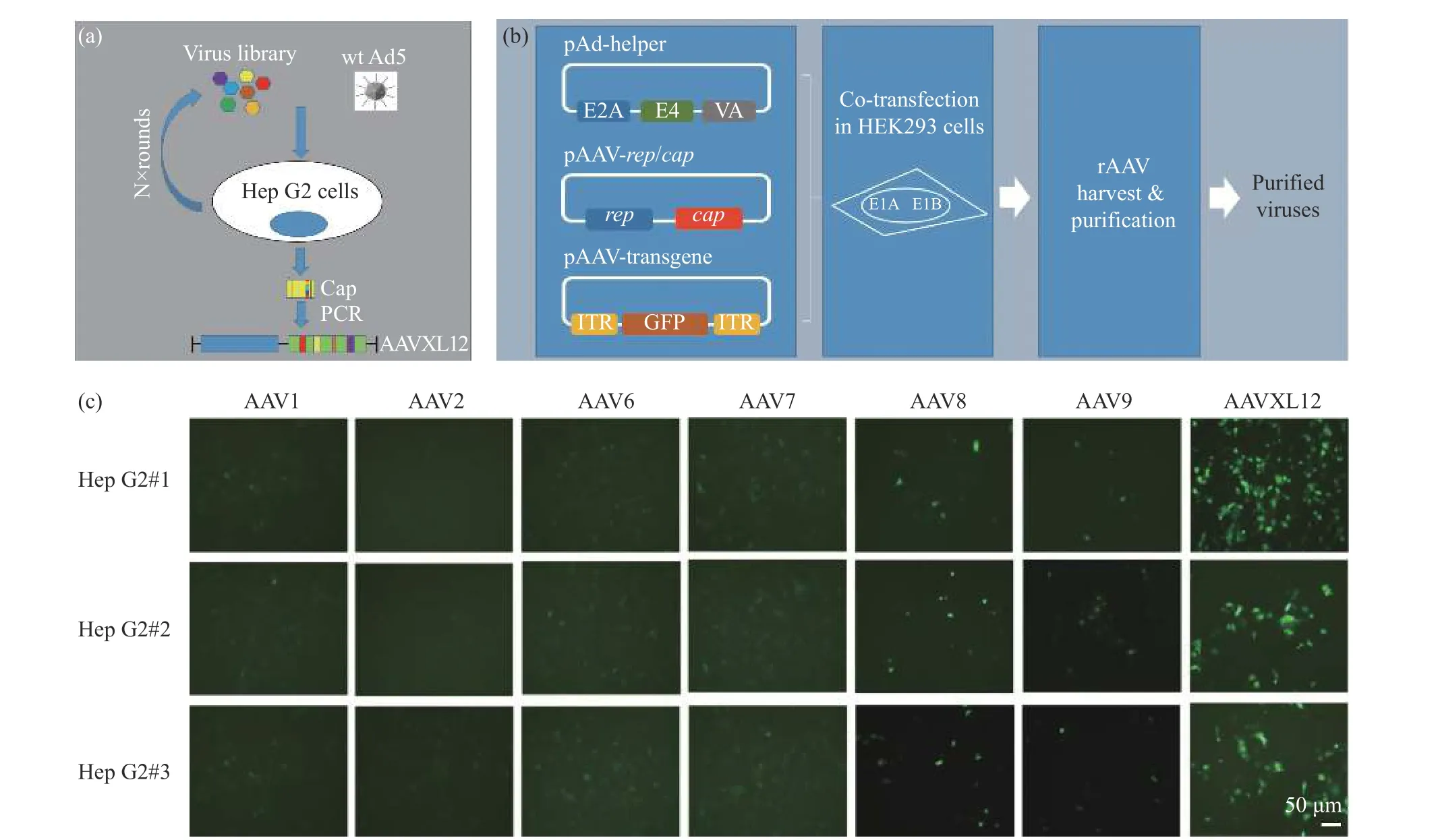
图2 筛选获得新型AAV 血清型载体AAVXL12 capsid 突变体Fig. 2 Screening for a new AAV serotype vector AAVXL12

图3 AAVXL12 cap 的序列组成Fig. 3 Composition of the AAVXL12 cap sequence
2.3 AAV 中和抗体检测
将筛选出来的AAVXL12 与AAV8 用同一病毒量分别感染健康小鼠的肝脏来进行中和抗体的检测,结果如图4 所示。从图4 中看出,所筛选到的新型AAVXL12 血清型载体的Nab 阳性率在30%左右。而AAV8 阳性率在90%左右。因此,AAVXL12更加适用于基因治疗的研究。
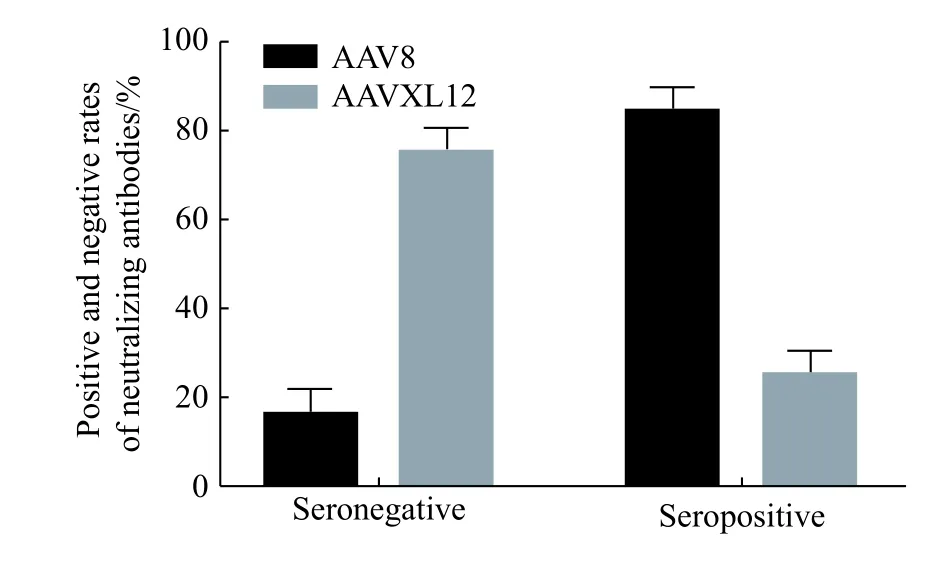
图4 不同AAV 血清型在小鼠中的中和抗体滴度检测Fig. 4 Detection of neutralizing antibody titers in different AAV serotypes in mice
3 讨 论
迄今为止,已从各种物种中分离出超过100 种AAV 基因型,包括山羊、牛、非人灵长类动物和人类[31-32]。目前适用于基因治疗的AAV 血清型载体对不同的组织器官具有不同的感染能力[32]。虽然有个别AAV 血清型载体对小鼠肝脏组织感染能力较强(如AAV8),但普遍特异性较差,同时也会对其他组织器官存在较强的感染能力。在应用于基因治疗研究中时,往往会造成副作用。为了设计具有组合特性的载体,本文通过DNA 改组得到 AAV 衣壳基因文库并进行筛选。本文研究的主要优点是避免血清型偏差的限制。研究结果表明:通过人肝癌Hep G2 细胞筛选到了肝脏高亲和力的新型突变体AAVXL12,增强了对肝细胞的趋向性的同时减少了中和抗体的产生。新型血清型AAVXL12最大的优势是对肝脏的高亲和力,从而大大增强肝细胞基因转导效率,将其用于基因治疗时,只需要很少的用量就能达到理想的治疗效果。因此将基因载体的用量及可能的细胞免疫应答最小化。这一创新载体大大增加了基因治疗用药人群,降低了毒副作用。但是新型血清型AAVXL12 对其他组织器官的感染力还需要进一步研究,之后我们将通过携带荧光蛋白的AAVXL12 载体静脉注射到小鼠中,并通过测定肝脏和几个对照器官中的荧光素酶活性的方法来检测AAVXL12 对其他组织器官的感染效果。
