基于瞬时纳米沉淀法的球形纳米粒子电荷及粒径调控
2020-07-08刘靖康王铭纬徐益升
刘靖康, 李 猛, 王铭纬, 徐益升,3
(1. 华东理工大学化工学院,上海 200237;2. 华东理工大学药学院,上海 200237;3. 石河子大学材料化工工程技术中心,新疆 石河子 832000)
20 世纪80 年代以来,具有生物相容性的高分子材料制备的纳米粒子(NPs)被广泛用来输送抗癌药物。尺寸为10~200 nm 的纳米粒子可以被动地通过高渗透长滞留效应(EPR)累积在肿瘤部位,又不至于被肾过滤排出体外[1-2]。研究表明,抗肿瘤药物的纳米载体的形状、尺寸及表面电荷等因素对于肿瘤的治疗效率有至关重要的影响[3-5]。纳米粒子的传统制备方法(如溶剂扩散法和透析法)是由热力学控制的过程,因此通常需要花费较长的时间,并且所得纳米粒子的大小难以控制。由于纳米粒子的尺寸对于不同部位肿瘤治疗的效率有着较大的影响[5],因此,这也阻碍了纳米粒子针对某种特定类型的癌症的精准治疗。
载药纳米粒子的表面电荷是另一个对治疗效率有重要影响的参数。表面电荷对于纳米载体在体内的循环寿命、在特定肿瘤部位的积累以及肿瘤细胞对于纳米载体的吞噬效率等方面有重要影响[6-7]。通常,聚阳离子的药物递送系统具有优于大部分药物递送系统的巨大潜力,但是由于生物体内细胞膜上带有大量的负电荷,带有正电荷的载药纳米粒子会通过静电作用吸附在细胞上,并与血液中的血清蛋白发生非特异性吸附,降低纳米粒子在人体内的循环寿命[8]。因此需要对表面带有正电荷的纳米粒子进行调节,使其表面电荷具有一定的pH 响应性,在体内循环时表面不带电甚至带有微弱的负电荷,从而避免被吸附,而到达靶向部位时显示正电荷,容易吸附于靶向位置进行给药。一般来说,调节纳米粒子表面电荷的手段主要有以下3 种:(1)在高分子载体的分子链上同时接入两段带有不同电荷的高分子嵌段,通过调节不同链段的相对长度调控纳米粒子表面电荷[9];(2)对高分子链进行功能化修饰,改变带电荷的功能分子的接枝度,从而实现对纳米粒子表面电荷的调控[10];(3)通过酸不稳定的化学键在纳米粒子表面接枝聚氧乙烯(PEG)基团,在适宜的pH 下,酸不稳定化学键断裂,从而使纳米粒子显示内层基团所带电荷[11-12]。但是,这3 种调节纳米粒子表面电荷的方式只能通过合成不同的高分子化合物才能得到,限制了其应用。
瞬时纳米沉淀法(FNP)是一种快速且简单的制备纳米粒子的方法[13-22]。溶有嵌段共聚物及有机功能分子的有机溶剂在毫秒级的时间内和水在多通道涡流混合器中快速混合,使有机溶质形成较高的过饱和度而促使其形成疏水的纳米核心,双亲性嵌段共聚物的疏水段沉积在纳米粒子表面,同时嵌段共聚物的亲水段在纳米粒子的表面形成亲水的保护层阻止其相互聚集。与传统方法(如透析法)制备纳米粒子相比较,瞬时纳米沉淀法不仅可以通过改变各液流流速、溶剂比及聚合物的浓度来系统调节纳米粒子的尺寸、表面电荷及形貌[23-27],而且该方法还可以极大缩短纳米粒子的制备时间,进而可满足工业化生产的需要。
在之前的工作中,作者成功使用FNP 技术制备了包载有生物荧光探针的棒状纳米粒子,并将其成功应用于小鼠体内成像[24]。在此基础上,希望探索以此种方法制备疏水药物纳米粒子领域的更广阔应用。以阳离子型嵌段共聚物聚甲基丙烯酸-2-(二甲氨基)乙酯-b-聚己内酯(PDMAEMA-b-PCL)以及生物相容性嵌段共聚物聚氧乙烯-b-聚己内酯(PEG-b-PCL)为稳定剂,通过FNP 技术制备了包载疏水药物β-胡萝卜素的球形载药纳米粒子。PDMAEMA-b-PCL 可以为纳米粒子提供正电荷,而PEG-b-PCL 具有较高的生物相容性,PCL 可被生物体降解,同时胶束表面所形成的PEG 嵌段带有微弱的负电荷,可以延长载药纳米粒子在生物体内的循环时间,因此被广泛地应用于药物输送领域[28-29]。通过改变聚合物浓度、流速、溶剂比等条件可以准确控制纳米粒子的表面电荷及尺寸。通过瞬时纳米沉淀法制备的电荷可调载药纳米粒子在癌症诊断和治疗方面有潜在的应用价值。
1 实验部分
1.1 实验药品与仪器
实验药品:β-胡萝卜素,纯度>97%(质量分数,下同),梯希爱(上海)化成工业发展有限公司(TCI);乙二醇,w=99%,上海泰坦科技股份有限公司;2-溴代异丁酰溴,纯度98%,上海阿达玛斯试剂公司;三乙胺,纯度99%,北京百灵威科技有限公司;二氯甲烷,纯度99%,上海泰坦科技股份有限公司;氢化钙,纯度>97%,上海天莲精细化工有限公司;ε-己内酯,纯度99%,上海阿达玛斯试剂公司;辛酸亚锡,纯度95%,百灵威科技有限公司;四氢呋喃,纯度99%,上海天莲精细化工有限公司;五甲基二乙烯三胺,纯度99%,美国Sigma-Aldrich 公司;甲基丙烯酸二甲氨基乙酯,纯度97%,梯希爱(上海)化成工业发展有限公司(TCI);苯基甲基醚,纯度99%,上海麦克林生化科技有限公司;氯化亚铜,纯度97%,上海天莲精细化工有限公司;氯化铜,纯度98%,上海天莲精细化工有限公司;正己烷,纯度97%,上海泰坦科技股份有限公司;高纯氮,上海思灵气体有限公司;文中所用去离子水为实验室自制。
仪器:恒温磁力搅拌器,HS-7 型,艾卡(广州)仪器设备有限公司;旋转蒸发仪,RV8 型,艾卡(广州)仪器设备有限公司;电子天平,ME204E 型,梅特勒-托利多(上海)仪器公司;真空干燥箱,DZF-6020 型,上海一恒仪器设备有限公司;注射泵,PHD 2000 型,豪沃生物科技(上海)有限公司;pH 计,Delta320 型,梅特勒-托利多(上海)仪器公司;动态光散射激光粒度仪,NICOMP 380ZLS 型,美国PSS 粒度仪公司;凝胶渗透色谱仪,GPC50 型,英国Polymer Laboratories公司;核磁共振仪,AM400 MHz,布鲁克(北京)科技有限公司;紫外分光光度计,UV-2550 型,岛津(上海)实验器材有限公司;透射电子显微镜(TEM),JEM-1400 型,日本电子株式会社(JEOL)。
小分子引发剂,相对分子量为8 000−7 000 的嵌段共聚物PDMAEMA-b-PCL的合成步骤及表征见文献[24],嵌段共聚物PEG-b-PCL 由组内付智楠博士提供,两嵌段的相对分子量均为5 000。
1.2 纳米粒子的制备
通过FNP 制备纳米粒子,四通道涡流混合器(MIVM)及其内部结构如图1(a)所示,纳米粒子的制备过程见图1(b)。进料1 为有机相,其溶剂为四氢呋喃,溶质包括质量浓度为0.2 mg/mL 的 β -胡萝卜素和总质量浓度为2.0 mg/mL 的两种嵌段共聚物PEGb -PCL、PDMAEMA- b -PCL;进料2、3 和4 均为去离子水。4 股进料中:进料1 与进料2 流速相同,标记为v1,进料3 与进料4 流速相同,标记为v2。使用2 台注射泵推动4 股进料在MIVM 中剧烈混合,得到含有纳米粒子的混合溶液(混合时v1调节范围为6~24 mL/min,v2调节范围为24~96 mL/min),再使用去离子水透析12 h 得到所需纳米粒子水溶液。仅使用1 种嵌段共聚物(PEG-b-PCL 或PDMAEMA-b-PCL),制备出的纳米粒子分别标记为PEG NPs 或PDMAEMA NPs,使用2 种嵌段共聚制备出的纳米粒子标记为PEG/PDMAEMA NPs。调节所得纳米粒子溶液pH 使用的HCl 和NaOH 浓度分别为0.01、0.1 mol/L。所制备的纳米粒子包封率(EE)依据文献[26]中方法测试。
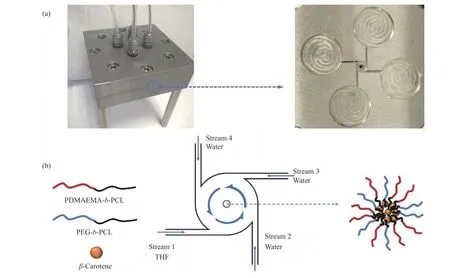
图1 通过FNP 制备纳米粒子:(a) 四通道涡流混合器及其内部结构;(b) 纳米粒子制备流程图Fig. 1 Preparation of NPs using FNP: (a) Multi-inlet vortex mixer and its internal structure; (b) Schematic illustration of NPs preparation
1.3 纳米粒子的测试及表征
使用动态光散射激光粒度仪表征制备出的球形纳米粒子的尺寸、分散性及Zeta 电位。测试温度为23 ℃,散射角固定为90°,测试介质为去离子水,在23℃下,去 离 子 水 黏 度 为0.933 mPa·s,折 光 率 为1.333。表面电荷测试介质为去离子水,电极间距为0.4 cm,电极间电压为5 V,介电常数为78.5。紫外吸收光谱使用岛津紫外分光光度计进行测试,使用透射电子显微镜表征所制备的纳米粒子的形貌。
2 结果与讨论
2.1 聚合物进料质量浓度比对纳米粒子表面电荷及粒径调控
保持嵌段共聚物总质量浓度为2.0 mg/mL,β-胡萝卜素质量浓度为0.2 mg/mL,进料1、2 流速v1为12 mL/min,进料3、4 流速v2为48 mL/min,改变不同嵌段共聚物质量浓度比,考察不同进料质量浓度比对于纳米粒子表面电荷及粒径的影响。按不同嵌段共聚物质量浓度比制备的纳米粒子在pH=5.5 时的粒径(Dh)、分散性(PDI)及包封率列于表1,不同pH 下的Zeta 电位及粒径如图2 所示。
如表1 所示,按不同嵌段共聚物进料质量浓度比制备的纳米粒子的分散性均在0.3 左右,分散性较好。pH=5.5 时,对于不同嵌段共聚物制备的纳米粒子单一的嵌段共聚物所形成纳米粒子,PEG NPs 粒径要小于PDMAEMA NPs 的粒径。所得纳米粒子的粒径随着PDMAEMA-b-PCL 的增多逐渐增大,这可能是由于两种不同嵌段共聚物的不同亲水链段的亲水性不同,因而其疏水链段在纳米粒子的β-胡萝卜素核心表面沉积的速度不同,从而导致其粒径不同。所制备的纳米粒子对于胡萝卜的包封率均高于60%,显示出较高的包封率。

表1 聚合物不同质量浓度比制备的纳米粒子在pH=5.5 时的粒径、分散性及包封率Table 1 Particle size, PDI and encapsulation efficiency of nanoparticles made by different polymer mass concentration ratio at pH = 5.5
由图2 可见,单独的PEG NPs 在pH=5.5 时表面电位为−4.7 mV,显示出微弱的负电性,这是由于PEG 嵌段作为引发剂引发ε-己内酯开环聚合后留下的−OH 基团及ε-己内酯单体之间相连的酯基水化而使纳米粒子表面带有微弱的负电荷[9,30]。pH 在5.5~8.5 之间变化时,其电位及粒径保持相对稳定。而单独的PDMAEMA NPs 在pH=5.5 时电位为+32.4 mV,显示出较为强烈的正电性,这是由于PDMAEMA嵌段上含有大量的胺基,其易于发生质子化而使形成的纳米粒子表面一直带正电。且在pH 由5.5 调整至8.5 的过程中,纳米粒子表面的电荷由+32.4 mV 降低至+17.8 mV,同时纳米粒子的粒径由107.1 nm 下降至69.3 nm。这是由于在pH 增大时,PDMAEMA嵌段的胺基发生去质子化,因此纳米粒子表面电荷减少;同时由于胺基的去质子化导致PDMAEMA 嵌段亲水性下降,从而PDMAEMA 链段发生皱缩,纳米粒子的粒径随pH 的增大而下降。

图2 不同pH 下,聚合物不同质量浓度比下制备的球形纳米粒子的Zeta 电位和粒径Fig. 2 Zeta potential and diameter of spherical nanoparticles prepared with different polymer mass concentration ratios at various pH values
当使用PDMAEMA-b-PCL 与PEG-b-PCL 两种嵌段共聚物制备纳米粒子时,制备出的纳米粒子的电位和粒径会随嵌段共聚物PEG-b-PCL 的增加分别由+32.4 mV 和107.1 nm 减 小 至−4.7 mV 和64.9 nm(pH=5.5)。这是由于嵌段共聚物的总质量恒定,当嵌段共聚物PEG-b-PCL 的质量比增大时,会相应地减少纳米粒子表面的PDMAEMA 嵌段的量,纳米粒子表面胺基减少,因此使制备的纳米粒子表面电位降低。通过调节两种嵌段共聚物的质量比即可对所制备的纳米粒子表面胺基的量进行控制,从而实现对制备的纳 米 粒子表面电荷 在+32.4 mV 至−4.7 mV之间进行精准的调控(pH=5.5)。
2.2 进料流速对纳米粒子表面电荷及粒径调控
制备的电荷可调纳米粒子PEG/PDMAEMA NPs 可通过调节流速比及绝对流速来调节纳米粒子的尺寸。其中嵌段共聚物PDMAEMA-b-PCL 与PEG-b-PCL 质量浓度均为1.0 mg/mL,β-胡萝卜素质量浓度为0.2 mg/mL。
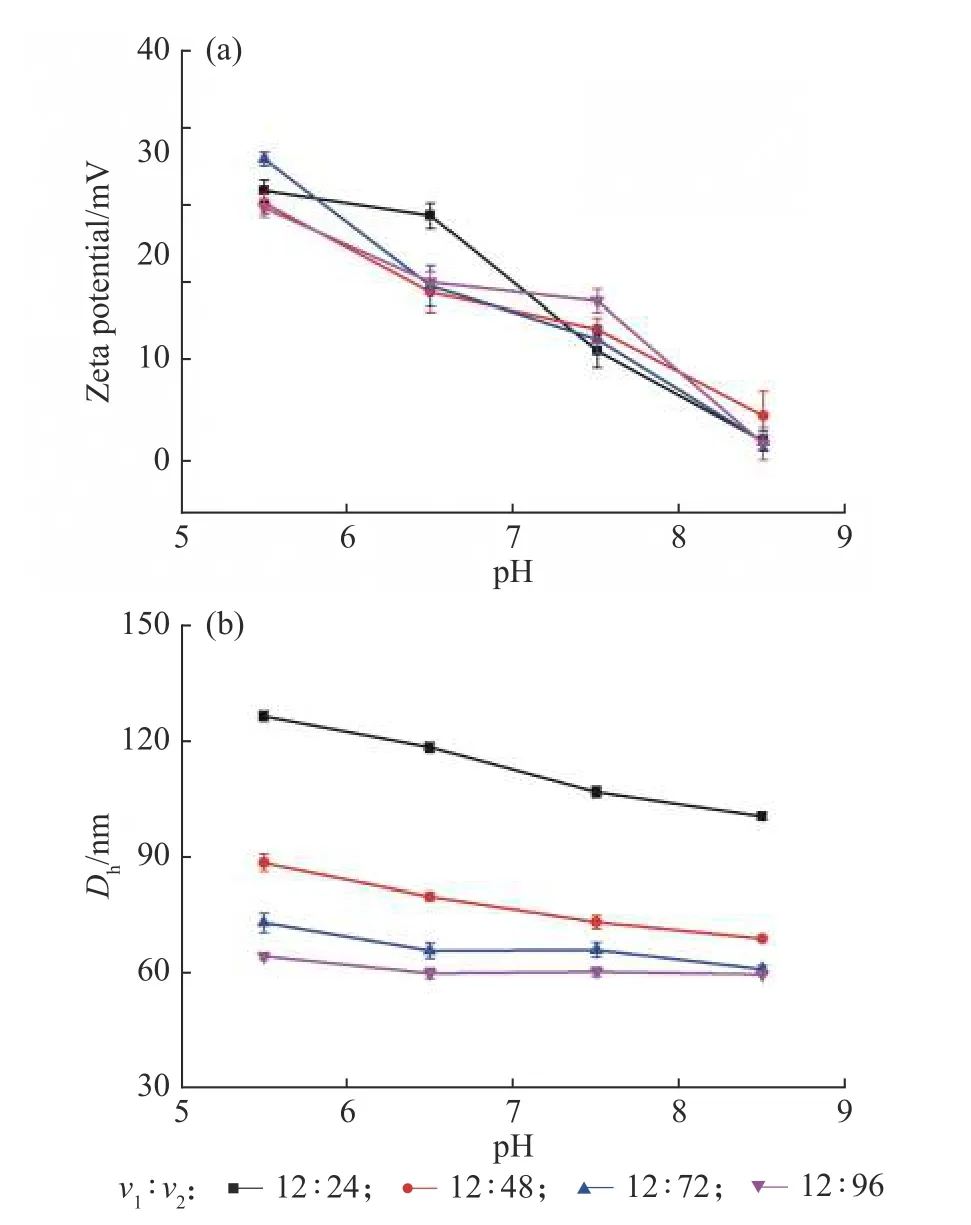
图3 不同pH、不同流速比下制备的球形纳米粒子的Zeta 电位及粒径Fig. 3 Zeta potential and particle diameter of the synthesized NPs by changing v1:v2 at various pH values
2.2.1 不同流速比 将进料1、2 的流速v1固定在12 mL/min,进料3、4 的流速v2由24、48、72 mL/min逐渐增大至96 mL/min,由图3 所示,在pH 由5.5 调节至8.5 过程中,各流速比下制备的纳米粒子的表面电荷均由+25 mV 左右(pH=5.5)下降至+3 mV 左右(pH=8.5)。在相同pH 下,通过不同流速比制备的纳米粒子表面电荷基本相等,说明纳米粒子表面电荷只与不同嵌段共聚物的进料质量浓度比相关,与不同进料口处的流速比无关。保持v1不变,v2由24 mL/min增大至96 mL/min 过程中,纳米粒子的尺寸由126.6 nm(pH=5.5)减小至62.7 nm(pH=5.5)。这是由于当水的相对流速更大时,疏水的β-胡萝卜素在混合的溶液中过饱和度更高,因此会有更多的成核位点形成;同时,在更大的水流速下各进料在混合腔中停留时间较短,纳米粒子的生长时间相应较少,所以使得到的纳米粒子尺寸更小[18,24]。不同流速比下制备的纳米粒子在pH 为5.5~8.5 内调节时其粒径及分散性均保持稳定。
2.2.2 不同绝对流速 除调节进入混合器中各物料的流速比外,提高进入混合器各物料的绝对流速而保持其流速比相同也可调节所得纳米粒子的粒径。选用同一流速比(v1∶v2=1∶4),增大其绝对流速,考察绝对流速对于纳米粒子尺寸及表面电荷的影响,所得结果如图4 所示。当绝对流速增大时,所得纳米粒子粒径由107.5 nm(pH=5.5)减小至77.3 nm (pH=5.5)。而在相同pH 下,不同绝对流速下制备的纳米粒子的表面电荷基本相等。这与不同流速比的实验结果相似。在相同的流速比下,各混合腔内的过饱和度相同,较大的流速使纳米粒子粒径较小,可能是由于在更高的流速下各液体混合得更加均匀,且较高的流速下混合液体在混合腔中停留的时间较短,纳米粒子的生长时间也相应减小,液体的混合时间大于纳米粒子的生长时间[13],使所得纳米粒子的粒径随绝对流速的增加而减小。
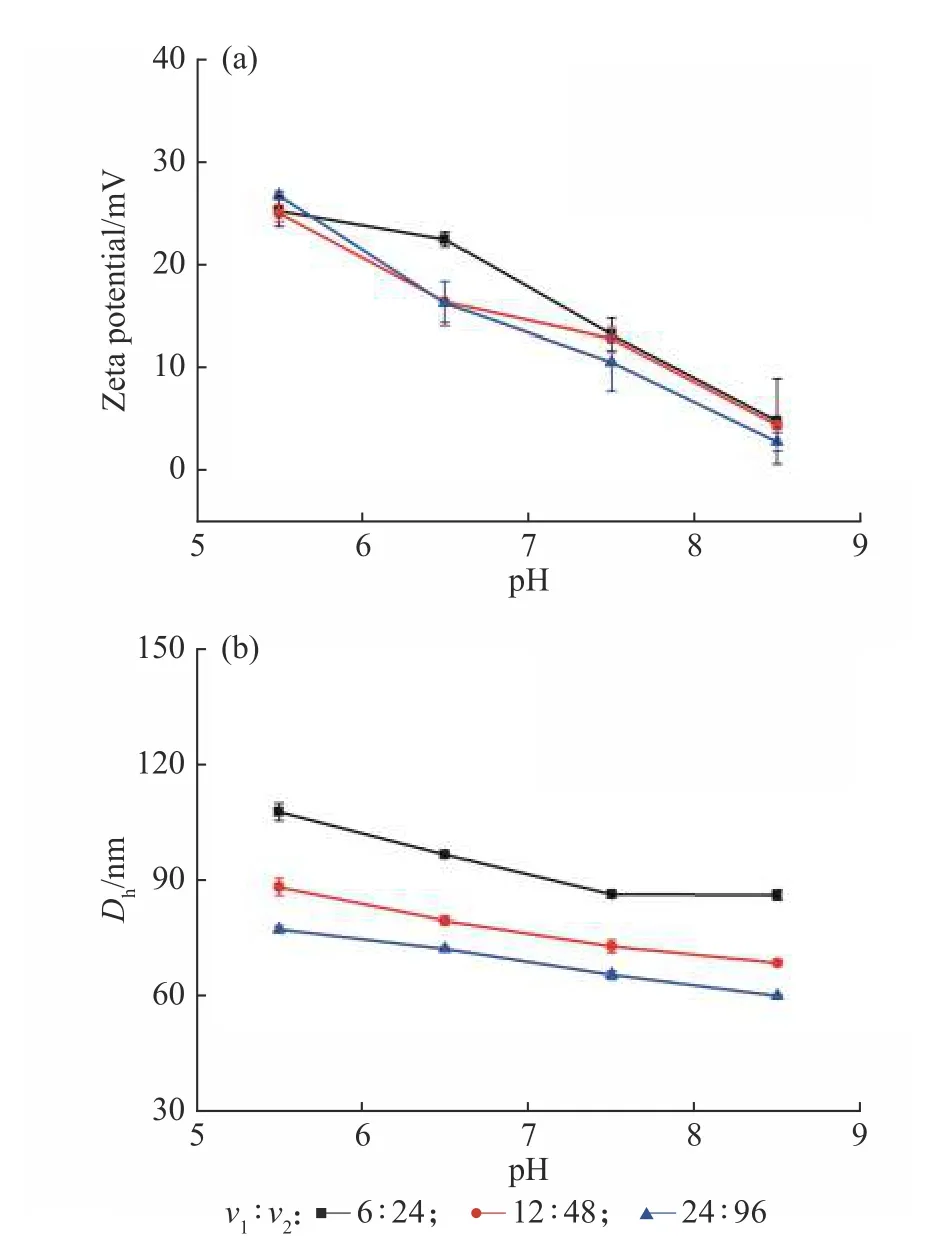
图4 相同流速比(v1:v2=1:4)、不同流速下制备的球形纳米粒子在不同pH 下的Zeta 电位及粒径Fig. 4 Zeta potential and particle diameter of the synthesized NPs by changing flow rate of v1,v2(keeping v1:v2=1:4 ) at different pH values
2.3 球形纳米粒子稳定性和形貌表征
使用动态光散射激光粒度仪监测球形纳米粒子在近一个月内粒径的变化,如图5(a)所示,制备条件: v1=12 mL/min, v2=48 mL/min; ρ(PEG-b-PCL)=ρ (PDMAEMA-b-PCL)=1 mg/mL, ρ (β-carotene)=0.2 mg/mL。所制备的PEG/PDMAEMA NPs 在pH=7.4 的条件下保存近一个月,其粒径稳定在70 nm 左右,未发生明显变化,稳定性良好。

图5 (a) pH=7.4 时PEG/PDMAEMA NPs 粒 径 随 时 间 的变化;(b) PEG/PDMAEMA NPs 的TEM 图Fig. 5 (a) Variations of particle diameter of PEG/PDMAEMA NPs with time at pH = 7.4; (b) TEM image of PEG/PDMAEMA NPs
使 用TEM 表 征 了PEG/PDMAEMA NPs 的 形貌,如图5(b)所示,所制备的PEG/PDMAEMA NPs为均一的球形,其粒径大小约为60 nm,与动态光散射激光粒度仪测试的粒径接近。这一尺寸的纳米粒子既不会由于尺寸过小而被肾过滤出体外,又可以通过高渗透长滞留效应在肿瘤部位积累,适合作为疏水性药物的纳米载体。
3 结 论
(1)通过瞬时纳米沉淀法,使用PEG-b-PCL 和PDMAEMA-b-PCL 两种嵌段共聚物及β-胡萝卜素在MIVM 混合器中剧烈混合制备表面电荷可调的球形纳米粒子。
(2)通过改变嵌段共聚物的进料比使纳米粒子的表面电荷在单一的PDMAEMA NPs 时的+32.4 mV至单一PEG NPs 的−4.7 mV 间连续调节(pH=5.5)。
(3)纳米粒子表面电荷具有一定的pH 响应性,随pH 的增大,纳米粒子表面电荷减小,同时随着PEG-b-PCL 的增多,纳米粒子表面电荷调节范围减小。
(4)纳米粒子的粒径可通过调节流速及流速比系统地进行调节:当流速比v1∶v2由12∶24 至12∶96,纳米粒子尺寸由126.6 nm 减小至62.7 nm;当流速比为1∶4 不变,而绝对流速增大时(v1为6,12,24;v2为24,48,96),纳米粒子的尺寸由107.5 nm减小至77.3 nm。
(5)制备出的纳米粒子粒径在25 d 稳定在70 nm左右,稳定性良好。
(6)通过瞬时纳米沉淀法这一策略可以快速制备电荷可调球形纳米粒子,且对其粒径及表面电荷可以进行准确的调控,在未来癌症诊断和治疗方面有潜在的应用价值。
