基于UPLC-ESI-IT-TOF-MS方法对血府逐瘀汤中8个成分同时含量测定
2020-07-08傅春燕王惠余刘永辉
傅春燕,王惠余,刘永辉,王 杨
1中南大学化学化工学院,长沙 410083;2邵阳学院药学院和食品与化学工程学院;3邵阳学院附属第二医院,邵阳 422000;4中南大学湘雅医院中西医结合研究所,长沙 410008
血府逐瘀汤是著名的中药方剂,源自清代王清任的《医林改错》,由11味药组成:红花、桃仁、生地、当归、牛膝、枳壳、柴胡、赤芍、桔梗、甘草、川芎[1],具有活血,祛瘀,止痛的功能,常用于气滞血瘀、失眠、长期头痛、狂躁、内热等症[2]。药理研究表明,血府逐瘀汤具有抗氧化、抗炎[3]、抗血栓[2,4]、抗血小板活化[4]的作用,临床上还用于颅脑损伤[5]等的治疗。
《中国药典》第一部(2015年版)对血府逐瘀制剂(血府逐瘀丸、血府逐瘀胶囊等)以芍药苷、柚皮苷或苦杏仁苷等少数几个活性成分含量作为质量控制指标,难以全面客观反映中药的整体作用[6]。对血府逐瘀汤化学成分研究,文献报道常用液质联用技术定性[7],用液相色谱技术[8]或薄层色谱技术[8]定量一个或少数几个成分,这些技术都难以实现中药复杂成分的分离,且存在分析时间长、检测灵敏度低的现象。而UPLC-ESI-IT-TOF-MS分析技术,既具有超高效液相色谱的快速、灵敏地分离复杂成分的优点,又能发挥IT-TOF-MS质谱检测器的保留时间稳定、质量数稳定、分子量精确[9]的特点,除用于复杂成分精准定性检测外,还可用于质谱定量分析。因此,采用质谱法对化学成分进行含量测定,不仅准确可靠,还能解决目前血府逐瘀汤制剂分析中分析仪器和分析方法的局限性。
本研究选取血府逐瘀汤的主要活性成分苦杏仁苷、羟基红花黄色素A、甘草苷、芦丁、芸香柚皮苷、柚皮苷、新橙皮苷和柴胡皂苷A,药理研究表明,柚皮苷、新橙皮苷和芸香柚皮苷有抗肿瘤、抗氧化、抗过敏和抗炎活性[10];柴胡皂苷A有抗癌、抗病毒、抗炎和调节免疫作用[11];甘草苷对神经有保护作用[12];芦丁表现出抗氧化活性,阻止低密度脂蛋白氧化,阻断血小板聚集[13];苦杏仁苷有抗动脉粥样硬化、神经保护和免疫调节作用[14];羟基红花黄色素A有扩张血管、降血压、抗血小板凝聚、改善心肌缺血[15],还用于治疗脑缺血[16]。中药通过多种成分、多种途径和多个靶点达到治疗疾病的,是多种活性成分整体作用产生的结果[17]。因此,建立血府逐瘀汤多种有效成分同时测定方法,有利于整体评价中药制剂的质量,为血府逐瘀汤的临床应用奠定基础。
本文基于前期对血府逐瘀汤化学成分定性研究的基础上,采用UPLC-ESI-IT-TOF-MS技术对血府逐瘀汤中的8个成分同时定量研究,建立一种简便、快速、高效、高分辨、高选择性、高灵敏度检测血府逐瘀汤中的化合物的方法,采用准分子离子外标法测定化合物的含量,以期对血府逐瘀汤的化学成分进行有效的质量控制。
1 仪器与试药
超高效液相色谱-电喷雾-离子肼-飞行时间质谱仪(UPLC-ESI-IT-TOF-MS)(Shimadzu,Japan),包括二元梯度泵(LC-30AD)、自动进样器(SIL-30AC)、脱气机(DGU-30A3)、光电二极管阵列检测器(SPD-M20A)、控制器(CBM-20A)、柱温箱(CTO-30AC)、ESI离子源和IT-TOF高分辨质谱仪(Shimadzu,Japan)。对照品苦杏仁苷(amygdalin,批号13011801)、羟基红花黄色素A(hydroxysafflor yellow A,HSYA,批号12081605)、甘草苷(liquiritin,批号13020901)、芦丁(rutin,批号13020911)、芸香柚皮苷(narirutin,批号14060310)、柚皮苷(niringin,批号14101208)、新橙皮苷(neohesperidin,批号14122405)、和柴胡皂苷A(saikosaponin A,批号12052402)都为HPLC级(纯度≥98%,成都曼思特公司)。甲酸为HPLC级(Sigma-Aldrich,上海),甲醇和乙腈都为HPLC级(Merck Darmstadt,德国),水为纯净水(娃哈哈集团,杭州),其他试剂均为分析纯。
8个不同批次血府逐瘀汤处方所用饮片,分别购自同仁堂药房(湖南长沙)4批,怀仁大药房(湖南长沙)4批,由中南大学湘雅医院中药学专家胡随瑜教授鉴定为本药剂的中药饮片,样本保存于本实验室(编号:CSU-20181001-20181008)。
2 实验方法
2.1 色谱条件
参考文献[18],Shim-Pack XR-ODS C18色谱柱(2.0 mm ×75 mm,1.6 μm),以水/甲酸(0.1%)(A)-乙腈(B)为流动相,梯度洗脱:0~1 min,10% B;1~3 min,10%→13% B;3~7 min,13%→17% B;7~11 min,17%→21% B;11~16 min,21%→25% B;16~21 min,25%→35% B;21~28 min,35%→44% B;28~30 min,44%→60% B;30~31 min,60%→70% B;31~32 min,70%→90% B;32~35 min,90% B;流速:0.4 mL/min;进样体积:5 μL;柱温:40 ℃。
2.2 质谱条件
参考文献[18],质谱参数设置为:电喷雾离子化模式为ESI(+)和ESI(-)同时采集;干燥气压力为100 KPa;离子喷雾接口电压:ESI(+)为4.5 kV,ESI(-)为3.5 kV;检测电压为1.56 kV;雾化气流速为液氮1.5 L/min;CDL和加热模块温度均为200 ℃,仪器温度为40 ℃;脉冲式碰撞气为高纯Ar气,碰撞频率为45 kHz。一级MS1质谱全扫描和多级MSn全自动扫描,m/z范围为50~1 500 Da,离子积累时间设置为30 ms(MS1)和50 ms(MS2)。数据采集用LCMS solution 3.8软件(Shimadzu,Tokyo,Japan),借助精确分子量计算软件和分子式预测软件处理数据。
2.3 对照品溶液的制备与标准曲线绘制
精确称取一定质量的上述8个对照品,分别溶于甲醇后配制成一定浓度的溶液,8个对照品溶液的浓度分别为:苦杏仁苷3.50 mg/mL,羟基红花黄色素A 6.70 mg/mL,甘草苷4.70 mg/mL,芦丁2.10 mg/mL,芸香柚皮苷4.80 mg/mL,柚皮苷 3.60 mg/mL,新橙皮苷5.10 mg/mL和柴胡皂苷A 1.07 mg/mL,精确取上述对照品溶液适量,混合后加甲醇稀释得贮备液,逐级2倍稀释贮备液制得6个浓度梯度的对照品混合溶液,按上述“色谱条件”和“质谱条件”分别进样3次,以进样浓度(μg/mL)为横坐标(X),以峰面积为纵坐标(Y)进行线性回归,得到各成分的回归方程、线性关系、检测限(LOD)及定量限(LOQ)。
2.4 血府逐瘀汤供试品溶液的制备
按处方取血府逐瘀汤各饮片共78 g,粉碎(100目),加水1 L浸泡30 min,煎煮15 min,八层纱布过滤,滤液备用。药渣继续加水煎煮两次,每次15分钟,合并三次滤液,在70 ℃以下真空浓缩至粗提物浓度为1.0 g生药/mL,使用前用去离子水稀释100倍,0.22 μm滤膜过滤,制得的待测溶液储存在4 ℃下备用。
2.5 方法学考察
2.5.1 精密度实验
分别精密吸取低、中、高3个浓度梯度的对照品混合溶液,1天之内连续进样6次,连续3天分别进样,计算各成分浓度的RSD,进行日内精密度和日间精密度考察[19]。
2.5.2 稳定性实验:
取批号为20181001血府逐瘀汤处方饮片,按2.4项下方法制得样品溶液,分别在0、2、4、6、8、10、12、24 h连续进样3次,测定各成分的保留时间和峰面积,计算RSD。
2.5.3 重复性实验
取批号为20181001血府逐瘀汤处方饮片共6份,按“2.4”项下分别平行制备样品溶液6份,各进样3次,记录峰面积,计算各成分浓度的RSD。
2.5.4 加样回收率实验
精确吸取已制备的6份已知浓度血府逐瘀汤溶液适量,分别加入等体积对照品混合溶液(含苦杏仁苷13.13 μg/mL、羟基红花黄色素A 670.00 μg/mL、甘草苷5.34 μg/mL、芦丁0.164 μg/mL、芸香柚皮苷9.00 μg/mL、柚皮苷13.50 μg/mL、新橙皮苷12.75 μg/mL和柴胡皂苷A 0.0672 μg/mL),每个样品进样3次,按“(测得量-原始量)/加入量×100”计算各成分平均加样回收率和RSD。
2.6 样品含量测定
按“2.4”项下方法制备8个不同批次的血府逐瘀汤制备液,每份进样3次,测定8个成分的含量。
3 实验结果
3.1 线性关系、检测限及定量限
8个成分的回归方程、线性关系、LOD和LOQ如表1,8个对照品提取离子流(extraction ion current,EIC)如图1,保留时间和质谱信息如表2。结果表明,各成分在其相应线性范围内线性关系良好(r>0.99)。
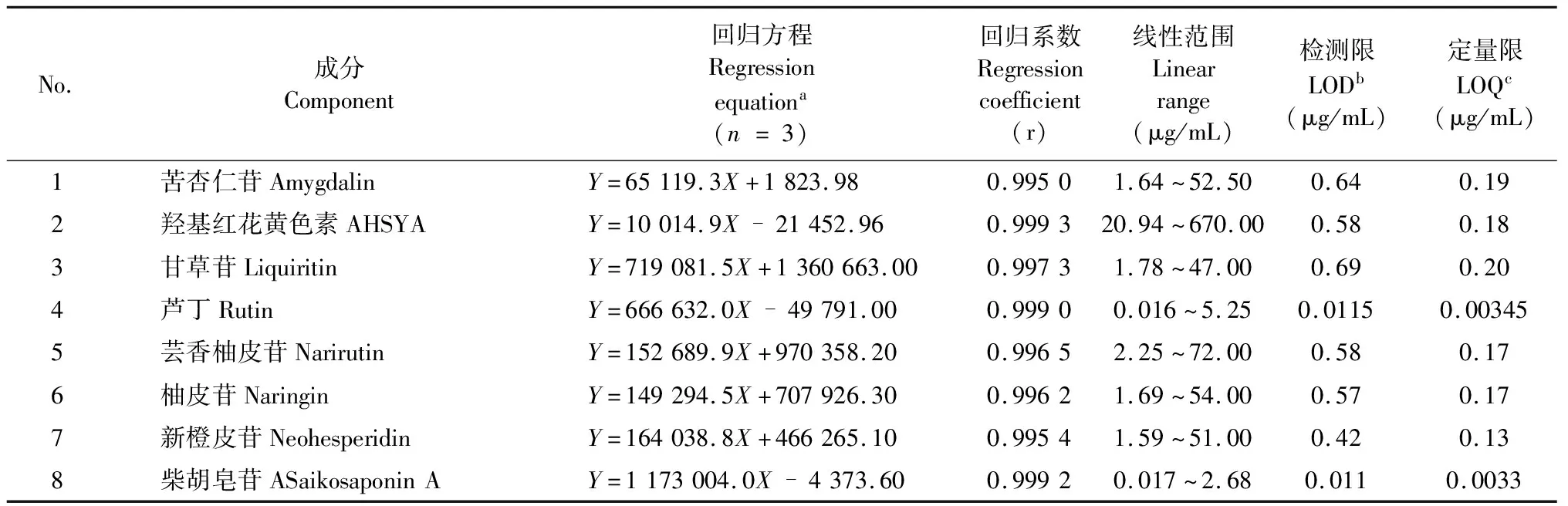
表1 8个成分的回归方程、线性范围、检测限和定量限
注:aY表示峰面积,X表示标准溶液的浓度;bLOD是指检测限,S/N=3;cLOQ是指定量限,S/N=10。
Note:aY is the peak area,X is the concentration of standard solutions;bLOD refers to the limits of detection,S/N=3;cLOQ refers to the limits of quantitation,S/N=10.
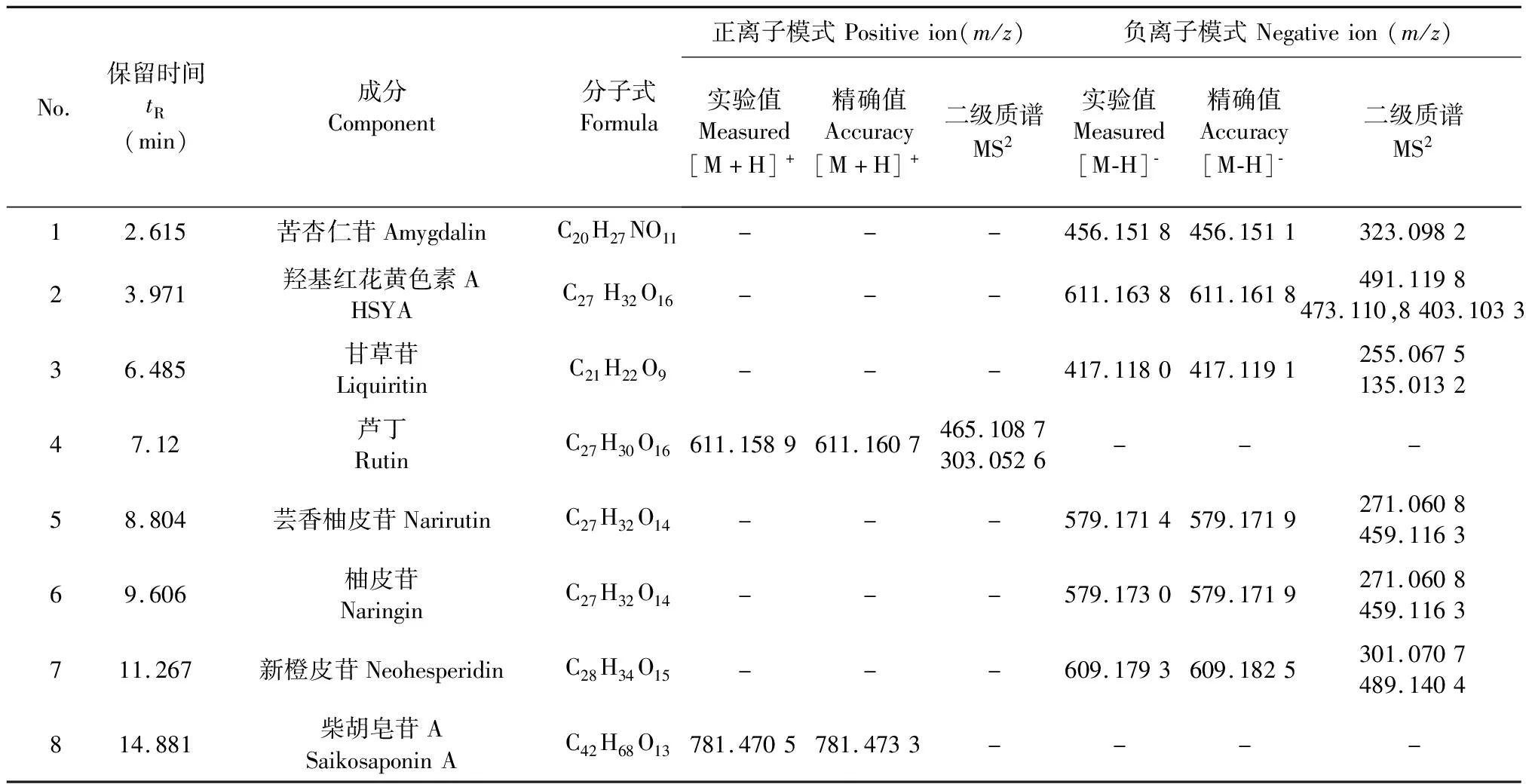
表2 8个对照品的保留时间和质谱信息
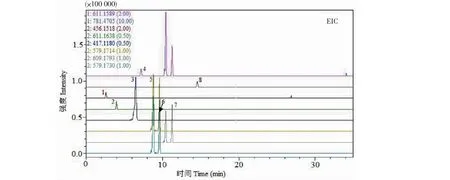
图1 8个成分的提取离子流图
3.2 精密度
以低、中、高3个浓度梯度的对照品混合溶液进行日内精密度和日间精密度考察,如表3,结果表明,日内和日间精密度RSD均小于5%,说明方法的精密度良好。
3.3 稳定性
血府逐瘀汤处方饮片的制备液在24小时内稳定性良好,8个成分的RSD均小于5%,各成分在负离子模式总离子流图(TIC)中的归属如图2A,在正离子模式TIC中的归属如图2B,提取离子流图如图2C。
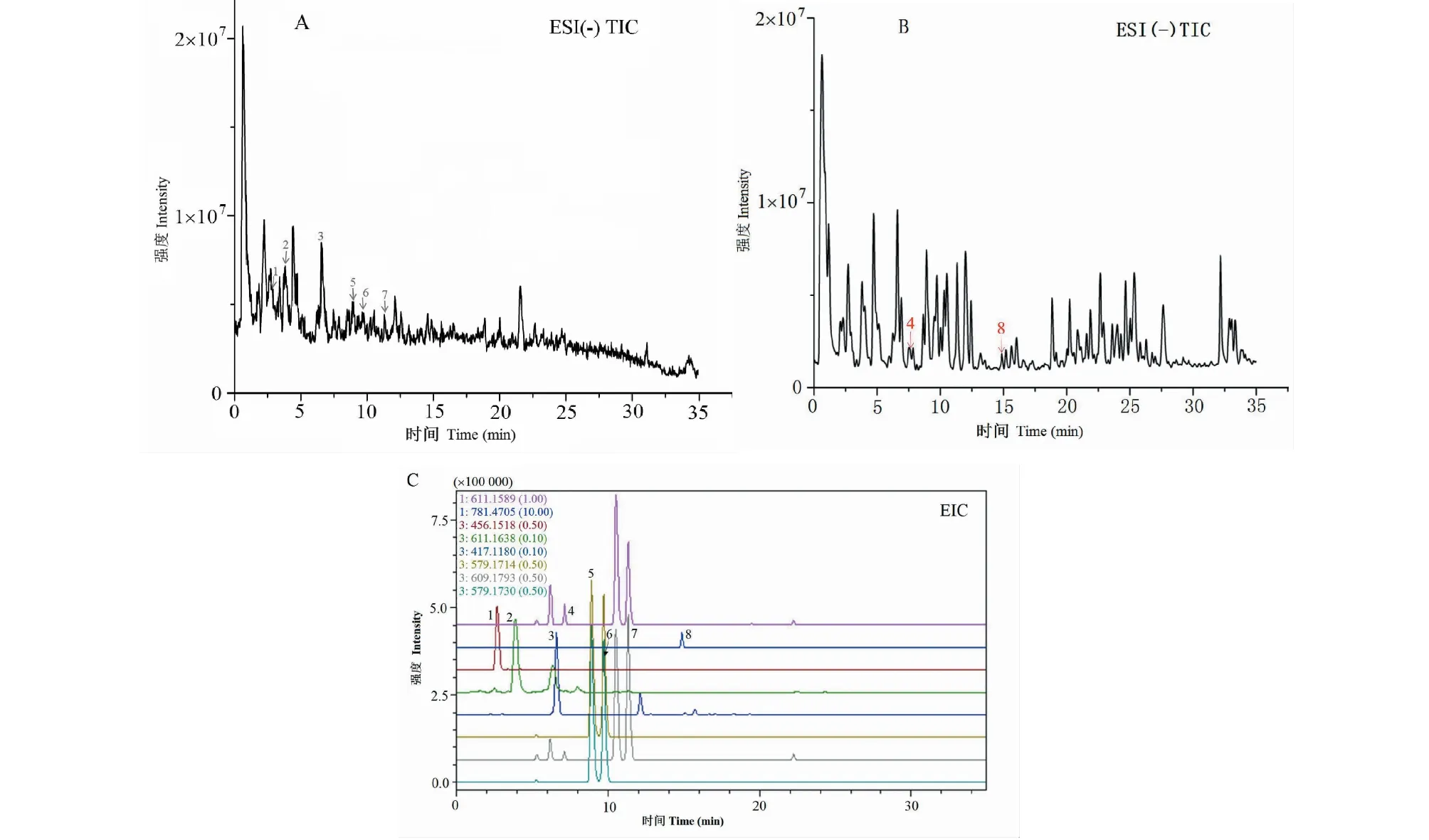
图2 血府逐瘀汤中8个成分的归属图

表3 日内精密度和日间精密度
续表3(Continued Tab.3)
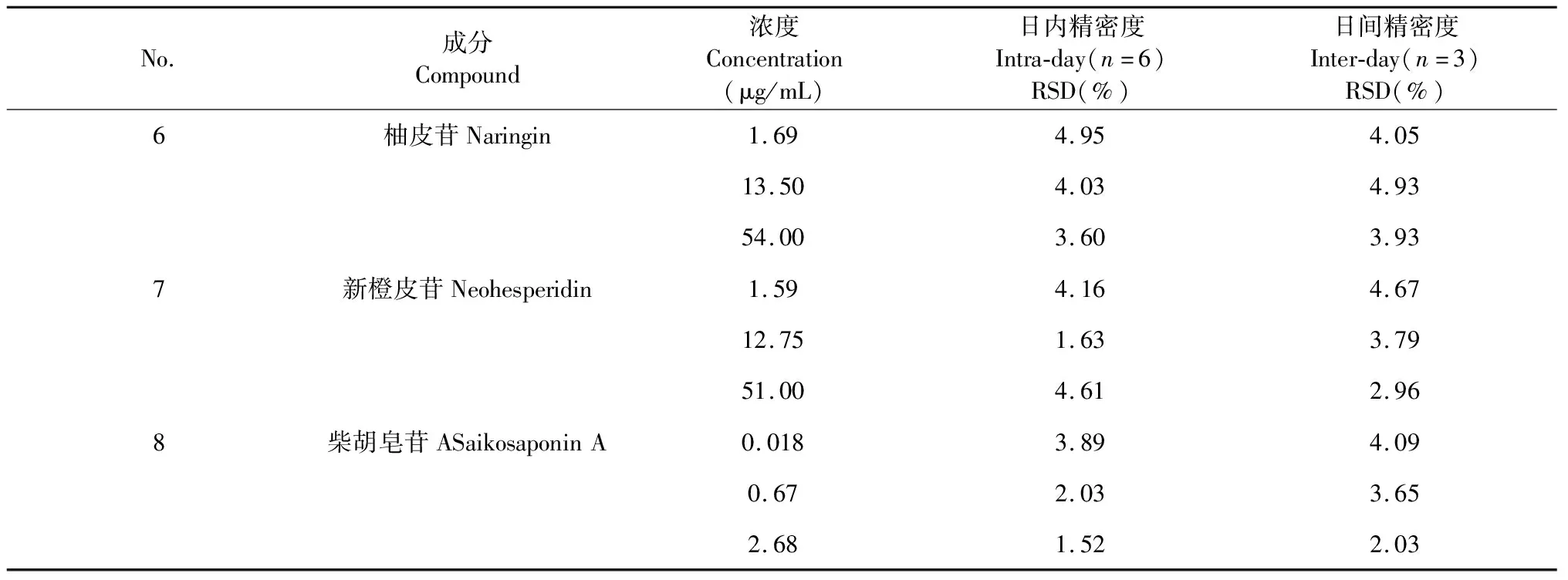
No.成分Compound浓度Concentration(μg/mL)日内精密度Intra-day(n=6)RSD(%)日间精密度Inter-day(n=3)RSD(%)6柚皮苷Naringin1.694.954.0513.504.034.9354.003.603.937新橙皮苷Neohesperidin1.594.164.6712.751.633.7951.004.612.968柴胡皂苷ASaikosaponinA0.0183.894.090.672.033.652.681.522.03
3.4 重复性
取血府逐瘀汤处方饮片6份进行重复性实验,8个成分浓度的RSD分别为:苦杏仁苷3.53%、羟基红花黄色素A 3.20%、甘草苷3.45%、芦丁2.67%、芸香柚皮苷2.35%、柚皮苷3.07%、新橙皮苷3.40%和柴胡皂苷A 4.26%,RSD均小于5%,表明该方法重复性良好。
3.5 加样回收率
8个成分平均加样回收率和RSD如表4,结果表明,各成分的加样回收率都在89.8%~108.1%范围内,3次进样的RSD均小于5%。
3.6 样品含量测定
8个不同批次的血府逐瘀汤中所含8个成分在原溶液中的含量如表5。
4 讨论
4.1 血府逐瘀汤提取方法的选择
本实验考虑到后续将进行血府逐瘀汤的药代动力学研究需要动物实验,故需排除有机溶剂提取时溶剂的残留对动物产生毒性的影响,因此采取水煎煮法提取血府逐瘀汤的制备溶液,既简单方便,又避免了有机溶剂的使用,符合动物口服溶液的要求,同时有利于实现绿色环保化学。
4.2 流动相的选择
实验比较了水/甲酸(0.05%)-乙腈、水/甲酸(0.1%)-乙腈、水/甲酸(0.05%)-乙腈/甲酸(0.05%)、水/甲酸(0.1%)-乙腈/甲酸(0.1%)等流动相系统,实验结果表明,水/甲酸(0.1%)-乙腈流动相系统分离效果较好,色谱峰的峰形较好,达到了被分析物均已基线分离。
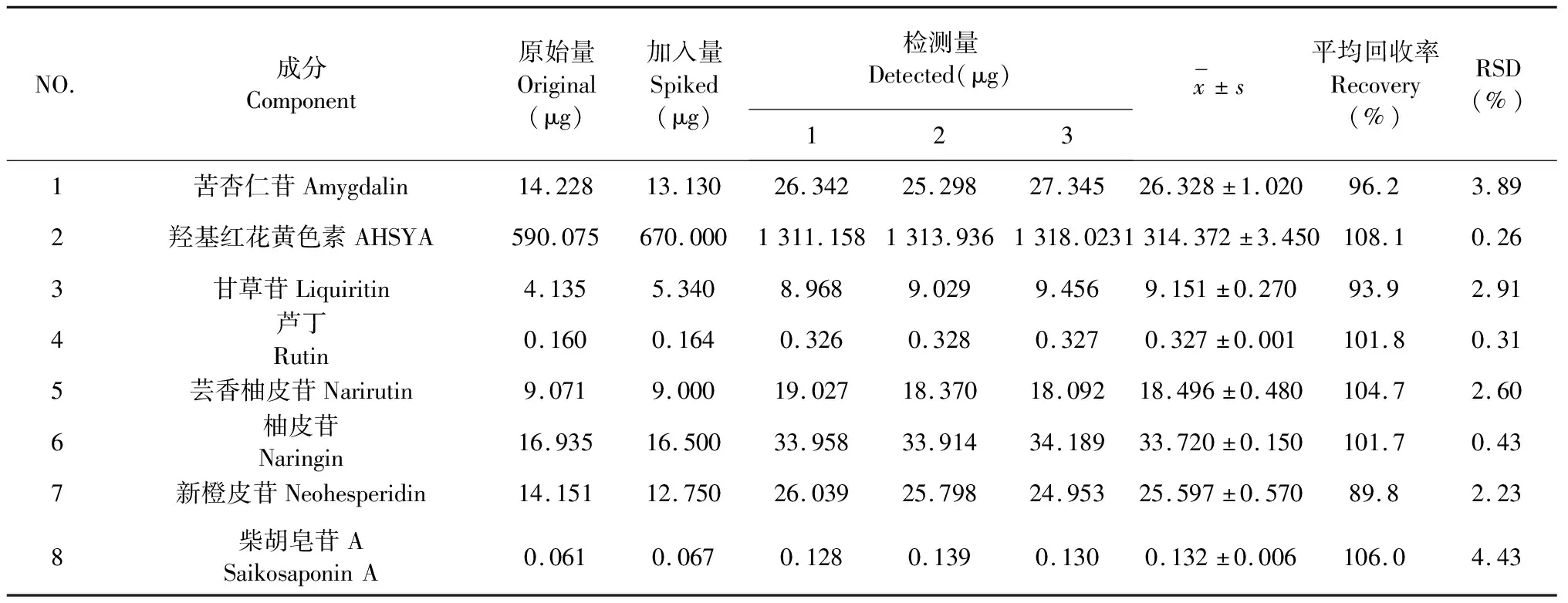
表4 8个成分的加样回收率实验结果
表5 8个不同批次血府逐瘀汤中8个成分的含量
4.3 分析方法的独特优势
本实验是基于UPLC-ESI-IT-TOF-MS的方法对血府逐瘀汤进行定性、定量研究,有着其独特优势:(1)充分利用IT-TOF-MS实现瞬时正负离子模式转换,能提供更多的离子碎片信息,有利于中药成分的定性鉴定。例如,芦丁和柴胡皂苷A在负离子模式下离子化效果不好而检测不到离子碎片,采用正离子模式却能实现定性定量检测,其他6个成分在负离子模式下离子化效果更佳,从而优先选择负离子模式进行分析。相对于其他技术,IT-TOF-MS技术扩大了分析检测的范围,更有利于复杂中药成分的定性定量研究。(2)IT-TOF-MS具有高质量精度、高分辨率、质量数精确和稳定的特点,可以从质谱中提取特征离子峰,以避免的其他离子的干扰,采用外标法定量特征准分子离子峰,从这点上该方法有着其独特的优势,且结果准确可靠。
4.4 杂质干扰较大
由于血府逐瘀汤的制备是采用水提方法,提取物中杂质较多,造成部分成分受杂质干扰大,离子化效果降低,因而化学成分含量降低,如柴胡皂苷A和芦丁的平均含量分别为0.022 3和0.003 0 mg/mL。但是羟基红花黄色素A在血府逐瘀汤中含量相对较高,平均含量达到40.466 9 mg/mL,主要原因可能由于羟基红花黄色素A属于单查尔酮苷类化合物,是红花中的主要水溶性成分[20],水提取法有利于HSYA的溶出。
4.5 合理选择中药方剂中的定量指标
血府逐瘀汤由11味药组成,桃仁、红花为君药;赤芍、川芎、牛膝共为臣药;生地、当归、桔梗、枳壳为佐药;桔梗、甘草调和诸药,为使药。实验选用的8种活性成分中,苦杏仁苷来自桃仁,羟基红花黄色素A来自红花,甘草苷来自甘草,芦丁来自红花、甘草和柴胡,芸香柚皮苷、新橙皮苷、柚皮苷均来自枳实,柴胡皂苷A来自柴胡和川芎,筛选的指标符合“君、臣、佐、使”理论,有利于全面评价血府逐瘀汤的质量。
本研究基于高质量精度IT-TOF-MS方法同时对8个批次血府逐瘀汤中的8个成分(包括1个氰苷、6个黄酮苷和1个三萜皂苷化合物)进行了定量研究,结果表明,各个不同批次成分含量除了新橙皮苷和柴胡皂苷A比较稳定外,其它6种成分的含量有波动,其中羟基红花黄色素A波动较大。该研究为血府逐瘀汤的质量控制提供参考,为后续的应用研究奠定基础。
