术前自体血小板分离对复杂成人先天性心脏病手术的血液保护效果△
2020-07-08雷迪斯曾琳玲巫红梅章晓华黄志锋陈寄梅
雷迪斯 ,曾琳玲,巫红梅,章晓华,陈 星,黄志锋,陈寄梅
[1.广东省心血管病研究所心外科广东省人民医院(广东省医学科学院)广东省华南结构性心脏病重点实验室,广州 510100;2.广东省人民医院烧伤科,广州510100]
复杂成人先天性心脏病(adult congenital heart disease,ACHD)手术患者因自身病理原因和长时间的手术,常面临着术中及术后止血的问题,需要输注各种血制品。异体输血潜在并发症较多,而且血源紧张也影响了临床的供给,围术期的血液保护成为了重点关注的问题。很多药物被用以预防与治疗围术期的出血,如氨甲环酸、重组活化凝血因子Ⅶ等,但其剂量与安全性等尚存争议[1],而且不能阻止体外循环(cardiopulmonary bypass,CPB)对血液的影响。回收式自体输血较常使用在心脏外科手术中,但血浆成分以及血小板在回收清洗时几乎全部丢失,大量失血时需额外补充[2],同样不能阻止CPB 对血液的影响。有些中心应用急性等容性血液稀释(acute normovolemic hemodilution,ANH),在术前采血保存待CPB后回输,用物理方法躲避CPB 对血液的影响[3]。但ANH 受限于患者自身血红蛋白浓度、CPB 预充稀释,未能广泛应用。自体血小板分离(autologous plateletpheresis,APP)技术20 世纪70 年代引入CPB 心脏手术中,取得显著的血液保护效果,目前国内多应用在大血管手术中,本研究回顾分析APP 技术在复杂ACHD 手术的血液保护效果。
1 资料和方法
1.1 一般资料
选择2018 年6 月至2019 年9 月在广东省人民医院行CPB 下复杂ACHD 手术矫治患者并在术前行APP 患者20例,并根据术式配对同期复杂ACHD 手术未行APP 患者20例为研究对象。复杂手术的定义为手术操作复杂,预计CPB 时间超过2 h。行APP 的患者条件为体质量≥50 kg,术前红细胞压积(Hct)>35%,血小板(Plt)计数>150×109/L,术前2周以上未接受抗凝或抗血小板药物,预计CPB 时间>2 h。
1.2 术前自体血小板分离方法
麻醉诱导后经患者右侧颈内静脉置入8F 静脉鞘管供自体血小板采集放血,同侧颈内静脉置入7 F 三腔静脉导管供给药、快速补液及中心静脉测压。监测患者中心静脉压以及血压,确认循环稳定后,使用美国血液公司的Cellsaver Elite 型血液回收机,以60 mL/min 的速度把患者血液引出体外进行分离采集,同时快速经中心静脉导管补充人工胶体,维持循环稳定,必要时使用小剂量血管收缩药物(去氧肾上腺素)。如患者血流动力学不稳,分离采集需减慢甚至暂停,待循环稳定后再继续。全血以枸橼酸钠抗凝剂抗凝,比率为9∶1。预计采集血小板量为血小板总量(血小板总量=患者循环血容量×术前血小板计数)的20%~30%,患者血容量设定为女性65 mL/kg,男性70 mL/kg。每个采集循环大约需要放血500~600 mL,一般采集2~3个循环,获得贫血小板血浆(platelet-poor plasma,PPP)、富血小板血浆(platelet-rich plasma,PRP)和浓缩红细胞。术前红细胞压积<30%或CPB 中红细胞压积<20%、CPB 结束前若红细胞压积<30%予回输浓缩红细胞。PRP 与PPP 待CPB 结束,鱼精蛋白完全中和肝素,无明显活动性出血后回输。对照组患者未行术前血小板分离。两组患者术中均常规使用血液回收装置开展术中自体血液回收。
1.3 体外循环方法
均使用微小化CPB:在负压辅助静脉引流技术下抬高膜肺,缩短CPB 管道,选用合适管径的管道,选择预充量小的膜肺以及超滤器,将预充量从传统的1 700 mL 降低至700~1 000 mL。APP组预充时加入呋塞米10 mg 利尿,CPB 结束前,食道超声确认畸形矫治满意,心内排气完全后,在维持血流动力学稳定的前提下尽可能超滤,CPB 结束后残余机血输送至血液回收机中清洗浓缩后再回输。
1.4 数据采集方法
收集术前PPP、PRP 及红细胞分离量,术中、术后24 h 血制品使用量,收集术后24 h 胸液量、围术期血红蛋白浓度(Hb)、血小板计数、术后呼吸机时间、术后重症监护病房停留时间、住院死亡患者例数等。收集围术期凝血指标,包括凝血酶原时间(PT)、活化部分凝血时间(APTT)、纤维蛋白原(Fib)。采集围术期TEG 结果,包括凝血反应时间(R)、血液凝固时间(K)、最大血块强度(MA)、凝固角(α-Angle)、凝血指数(CI)。
1.5 统计学分析
所有数据采用SPSS 22.0 软件进行统计分析。以PP 图检验数据是否符合正态性分布。符合正态分布的计量资料以()表示,组内比较采用重复测量设计的方差分析,组间比较采用两独立样本t检验;不符合正态分布的计量资料以[M(P25~P75)]表示,采用非参数检验。计数资料以[n(%)]表示,组间比较采用卡方检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者一般情况及手术类型比较
两组患者年龄[(31.3±13.3)岁vs.(30.0±12.9)岁,P>0.05]、体质量[(57.4±9.1)kgvs.(54.0±8.6)kg,P>0.05]比较,差异无统计学意义。两组患者性别及手术类型比较,差异无统计学意义(P>0.05),见表1。APP组血小板分离量:PRP 为(92.3±30.0)mL,PPP为(709.0±322.5)mL,红细胞为(715.8±184.5)mL。

表1 两组患者性别及手术类型比较[n=20,n(%)]
2.2 两组患者术中、术后情况比较
两组患者的CPB 时间、主动脉阻断时间、术后24 h 胸液量、术后机械通气时间以及术后重症监护病房时间比较,差异无统计学意义(P>0.05),详见表2。APP组无院内死亡,对照组1例患者因多器官衰竭死亡。
表2 两组患者术中、术后情况比较 [n=20,±s,M(P25~P75)]

表2 两组患者术中、术后情况比较 [n=20,±s,M(P25~P75)]
2.3 两组患者术中及术后24 h 血制品用量比较
两组患者的异体血浆输注率与输注量比较,差异无统计学意义(P>0.05);APP组异体红细胞输注率和输注量均少于对照组,差异有统计学意义(P<0.05);APP组仅1例输注异体机采血小板1单位,对照组7例患者各输注了异体机采血小板1单位。
表3 两组患者术中及术后24 h 血制品用量比较 [n=20,±s,M(P25~P75)]

表3 两组患者术中及术后24 h 血制品用量比较 [n=20,±s,M(P25~P75)]
注:与对照组比较,*P<0.05
2.4 两组患者围术期血红蛋白浓度及血小板计数比较
两组患者术前血红蛋白浓度和血小板计数比较,差异无统计学意义(P>0.05);两组患者术后及术后第1 天血红蛋白浓度和血小板计数均少于术前,差异有统计学意义(P<0.05),见表4。
表4 两组患者围术期血红蛋白浓度与血小板计数比较 [n=20,±s]

表4 两组患者围术期血红蛋白浓度与血小板计数比较 [n=20,±s]
注:与同组术前比较,*P<0.05
2.5 两组患者围术期凝血指标比较
两组患者术前的凝血酶原时间、活化部分凝血时间及纤维蛋白原浓度比较,差异无统计学意义(P>0.05);两组术后及术后第1 天的凝血酶原时间、活化部分凝血时间均较术前长,术后纤维蛋白原浓度较术前少,差异有统计学意义(P<0.05);术后第2 天纤维蛋白原浓度与术前比较,差异无统计学意义(P>0.05),见表5。
表5 两组患者围术期凝血指标比较 [n=20,±s]
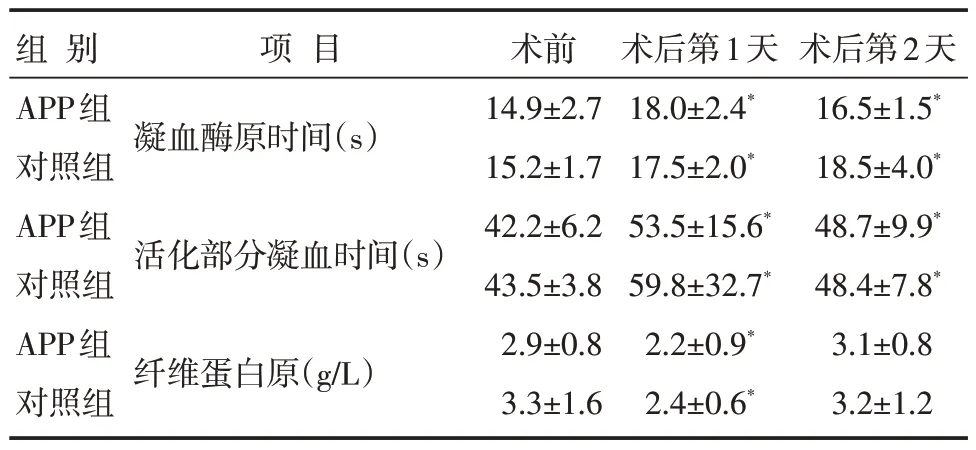
表5 两组患者围术期凝血指标比较 [n=20,±s]
注:与同组术前比较,*P<0.05
2.6 两组患者围术期血栓弹力图结果比较
两组患者围术期TEG 结果比较,见表6。
表6 两组患者围术期血栓弹力图结果比较[n=20,±s]
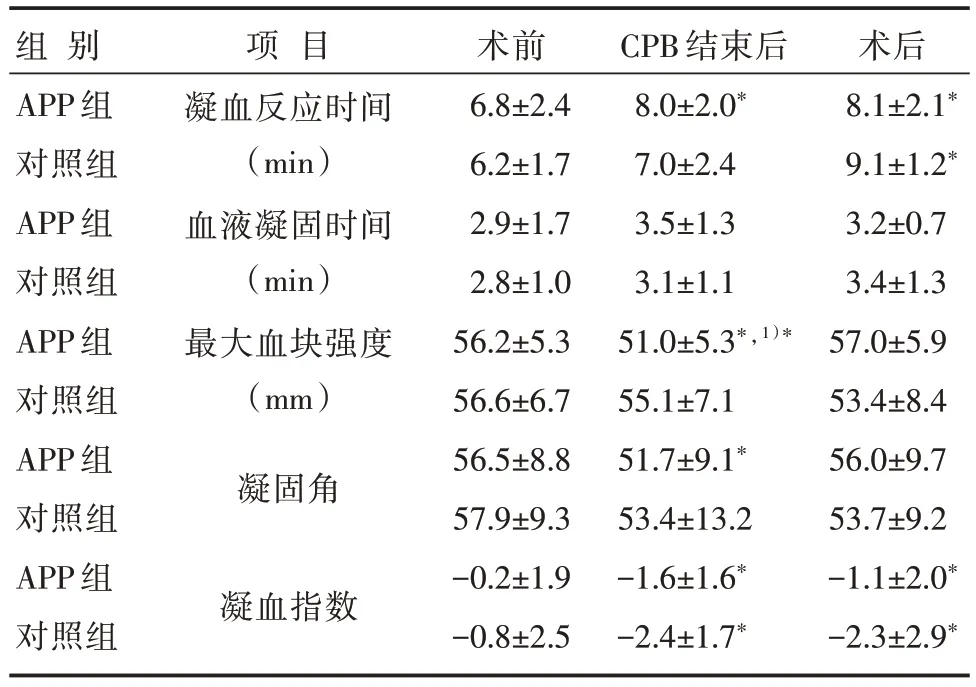
表6 两组患者围术期血栓弹力图结果比较[n=20,±s]
注:与对照组比较,1)*P<0.05;与术前比较,*P<0.05
3 讨论
目前APP技术国内外多应用在大血管手术中[4-5],在先天性心脏病手术的应用报道很少[6-7],且均为简单手术,在复杂ACHD 手术中的使用未见报道。研究显示,CPB 后弥漫性渗血的主要原因是血小板数量和功能下降[8]。APP 血液保护的理论基础和ANH 一样,通过物理方法使血液成分躲避CPB的影响。不同之处在于把红细胞、PPP、PRP 分离保存,按需回输,部分因体质量、血红蛋白浓度原因未能行ANH 的患者可行APP。
多数中心应用APP 技术时,考虑CPB 血液稀释的影响,把分离得到的红细胞和PPP 均即时回输给患者,以满足CPB中适当胶体渗透压和血红蛋白浓度的需要,只保留PRP 在CPB 后回输[9]。本研究中采用微小化成人CPB 回路,把预充量从传统的1 700 mL 降至700 mL 至1 000 mL,大大减少了CPB 对血液稀释的影响,降低了对CPB 前患者的血红蛋白浓度的要求,使得PPP 和部分红细胞也可保存至CPB 结束后再回输。
凝血酶原时间(PT)、活化部分凝血时间(APTT)、纤维蛋白原(Fib)。
常规的凝血指标只能反映凝血过程的部分,不能实时动态反映手术患者的凝血状况。TEG 则可监测凝血至纤溶的全过程,TEG 中最重要的指标是凝血反应时间、最大血块强度、血液凝固时间、凝固角与凝血指数。凝血反应时间反映凝血因子功能,最大血块强度反映血小板聚集功能、血液凝固时间与凝固角反映纤维蛋白原功能,凝血指数是综合凝血指数[10]。本研究中两组患者术后及术后第1 天的凝血酶原时间、活化部分凝血时间均较术前延长,提示轻度凝血异常。两组患者术后纤维蛋白原浓度均较术前降低,但仍高于有效凝血要求的临界值[11]。纤维蛋白原浓度的下降和凝血酶原时间升高与术中出血及CPB 消耗有关。纤维蛋白原浓度术后第2 天回升,可能与自身合成增加或异体血制品的输注有关。与术前相比,APP组在CPB 后凝血反应时间延长、凝固角变小,最大血块强度变小,可能与血小板和血浆在术前分离保存,体内血小板与凝血因子数量减少有关。术后APP组最大血块强度回升,可能因为CPB 后回输PRP 及PPP,但与对照组无显著差异,与研究[12]报道术后APP组最大血块强度显著高于对照组不一样,可能与对照组输注较多异体血小板有关。术后两组患者的凝血反应时间延长和凝血指数降低,虽然均值在正常值范围内,也提示了凝血轻度改变。
本研究中,APP组患者异体血小板的输注率与输注量均较对照组少,而两组在围术期血小板计数无明显差异。与对照组相比,APP组术后24 h胸液量无显著差异,显示APP 可减少异体血小板使用的同时没有使胸液引流量增加,与一些研究的结果一致[5,9]。APP组患者血浆输注率较对照组低,但无显著性差异,可能与患者例数较少,病变种类不完全相同有关。而APP组患者红细胞的使用也较对照组少,围术期两组患者血红蛋白浓度无明显差异,可能是与APP组分离得到的红细胞部分或全部保存至CPB 后回输有关。Zhou 等[13]回顾了685例升主动脉加全弓置换术的患者,与非PRP组患者相比,PRP组患者的机械通气时间、重症监护病房停留时间等明显缩短,院内病死率显著下降。而在本研究中,APP组患者未见相同优势,可能与患者例数较少,病死率低有关。
本研究显示术前自体血小板分离技术对CPB下复杂ACHD 手术有血液保护的效果,在异体血小板输注减少的同时不影响凝血功能,无增加术后胸液引流量,也减少了异体红细胞的使用。在血源紧张的地区,值得推广。不足之处在于样本数量较少,两组患者手术类型并非完全相同,不同病种患者术前凝血功能可能存在差异,未来需要更大样本的临床研究。
