临床试验实施中方案偏离及方案违背的分析研究
2020-07-07陈超
陈超
(菏泽市中医医院,山东 菏泽274000)
随着药物研发全球化的影响,国家对新药研发进一步地重视,国家食品药品监督管理局(CFDA)对各类临床试验政策不断地完善,药物临床试验机构作为临床试验中的管理者和执行者,对在本机构进行的临床试验的质量要求更加严格[1]。遵循《药物临床试验质量管理规范》(GCP)原则、依从伦理委员会批准的试验方案是进行药物临床试验的前提,任何偏离或违反GCP 和试验方案的行为叫做方案偏离/方案违背(PD/PV)[2]。本研究对菏泽市中医医院2017 年7 月—2019 年7 月开展的药物临床试验中出现的PD/PV情况进行统计分析,查找发生的原因,总结出预防该类偏离发生的措施,从而为新开展的临床试验项目提供参考,以更好地提高临床试验的质量。
1 资料与方法
1.1 研究对象 选择我院国家药物临床试验机构自2017年7月—2019年7月开展的17项临床试验作为研究对象,包含了药物临床试验的Ⅱ期、Ⅲ期、Ⅳ期试验及等效性试验(含预试验),共抽查到发生PD/PV的病例109例。
1.2 方法 对PD/PV情况进行统计归类分析并比较各类PD/PV 的发生率;比较在临床研究中存在专职研究人员对PD/PV 的影响;有专业临床研究协调员(CRC)及科室质控人员对PD/PV的影响。
1.3 统计学处理 应用SPSS22.0 对数据进行统计分析,所获数据采用t 检验和χ2检验;以P<0.05 表示差异有统计学意义。
2 结果
2.1 PD/PV发生的类别及发生率 在本次研究中收集病例数840 例,发生PD/PV 者109 例,占12.98% 。在发生PD/PV的病例中访视超窗39份,进餐/用药超窗等依从性问题22份,失访19份,采血/检验超窗8份,主动退出7 份,发生AE/SAE、妊娠事件终止7 份,不符合方案入排标准3份,分别占偏离病例的35.78% 、20.18% 、17.43% 、7.34% 、6.42% 、6.42% 、2.75% 。
2.2 方案偏离的影响因素分析 见表1。
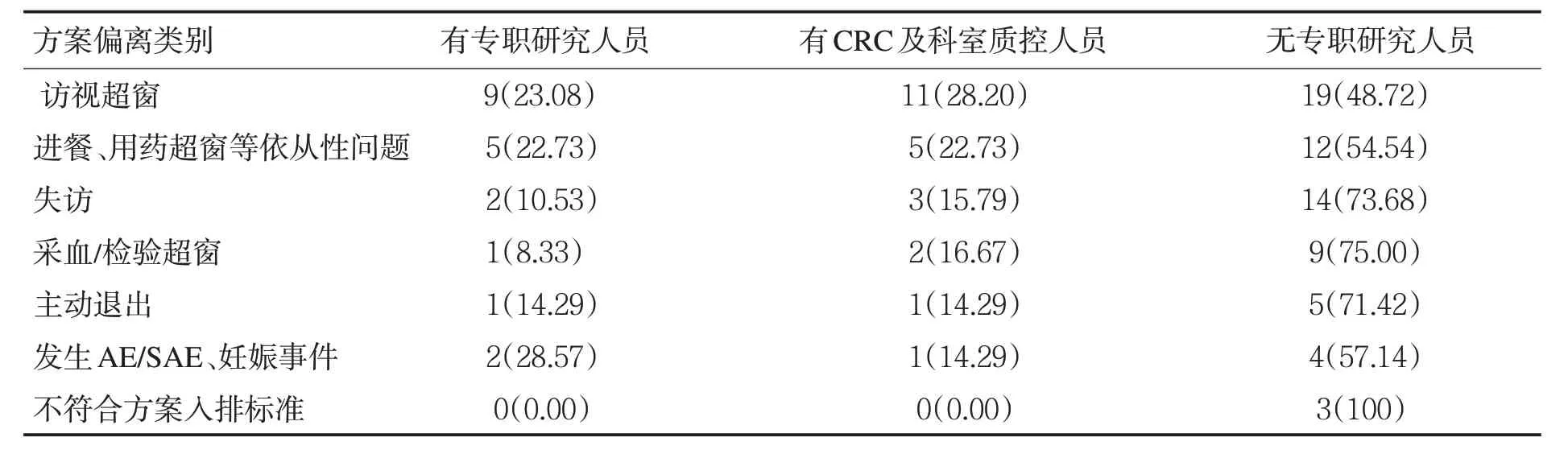
表1 方案偏离的影响因素分析[n(% )]
3 讨论
3.1 PD/PV PD和PV是每一项临床试验都或多或少存在的问题,且伴随着整个临床试验的始终[3]。CFDA在2017年公布的数据核查报告中指出,临床试验中方案不依从性问题占所有发现问题的12.0% ,排名位居第二。目前PD/PV呈多样化、复杂化,这对于临床研究者和监察员、申办方或项目经理来说都是一项非常大的考验。一般情况下,我们将对受试者安全性或对本次研究的评价结果存在严重影响的作为PV,其他的情形视为PD,但这并非统一的标准[4]。虽然GCP 及人用药品注册技术要求国际协调会(ICHGCP)中对其进行相关要求,但就PV和PD的具体表现形式并没有明确划分。因此,目前尚没有明确的规定如何对临床试验过程中出现的不依从方案的现象进行PV或PD的划分。
由于划分界限的不确定性、不同项目的参与人员也不同,加上试验中问题的复杂多样性,使得该类问题处理时也呈现出多样化和复杂化。也正是由于这种性质,PD/PV 已逐渐成为每家试验机构较为关注的问题。
3.2 常见的PV/PD及其原因 在试验过程中出现PV/PD 在所难免,比较常见的PV/PD 主要包括:(1)访视、采血、检验、服药、进餐等时间点超窗。(2)受试者合并用药。(3)受试者失访。(4)受试者主动要求退出。(5)非重要数据点、观察指标或实验室数据缺失等。上述PV/PD并未影响到受试者的安全性和试验最终结果的判定,一般情况下研究者允许受试者继续参与临床研究,在对待该类问题的处理意见上基本一致。上述PV/PD 发生的主要原因,包括:(1)筛查时知情不充分,试验过程中沟通不到位。(2)研究者只关注重点研究内容,缺少必要的核对。(3)受试者对临床研究不重视,随意性过大。(4)受试者虽能够了解知情同意的内容,但参加研究的意志不坚定,容易受周围环境影响。(5)申办者、机构、临床科室对整个临床试验的质量控制及监查不及时。(6)其他不可抗力因素。
3.3 减少临床试验过程中发生PV/PD的有效措施 申办者作为试验项目的发起者,试验机构作为临床试验的承办者,受试者作为临床试验的参与者,分别以不同的身份构成了一个完整的临床试验。参与的各方受到外界及自身等不同因素的影响,导致发生PD/PV的种类也各不相同。为减少临床试验过程中PV/PD的发生,主要应从以下几个方面进行:(1)加强专职研究人员的参与度:专职研究人员一般是指在临床试验机构中专门从事临床试验研究的人员,该类人员相比于临床科室繁忙的医务人员在对于国家相关法规政策的把握以及对本机构的SOP的熟知程度上要具有明显的优势。本次研究同样证明了在临床试验过程中,专职研究人员的参与在减少PD/PV 方面具有明显的优势。(2)加强CRC 参与度、建立强大的专业质控体系:CRC 有着规范的培训和严格的管理程序,对于临床试验具有明显的优势。但由于CRC需要在多地点、多项目中参与临床研究,这种不固定性也导致了他们对于不同机构SOP 的不熟悉,加上不同公司对CRC 的培训及管理也存在差异,导致CRC的服务质量存在较大差别。科室质控员可以将试验过程中可能遇到的风险及问题控制在临床试验启动之前,加上在试验过程中的质量监督,能够有效地减少PV/PD的发生。
本次研究显示,拥有专业CRC 及科室质控的临床试验项目发生PD/PV 的例数明显减少。因此,加强CRC参与度、建立强大的专业质控体系,对于提升临床试验质量有至关重要的作用。(3)加强各专业人员以及各试验环节的培训:临床试验要求各方人员务必各司其职,在自己的岗位上掌握相应的临床试验相关法律法规及基本常识[5]。GCP中规定:作为试验的申办者、研究者、项目监查员全部需要进行GCP相关培训、获得相应资质,申办者在挑选试验机构时应充分考虑研究者的培训情况。加强各专业人员以及各试验环节的培训,有利于增加各方人员对GCP的认识,对试验方案的了解,使得研究人员对其所负责的环节掌握更加巩固,甚至提前预测可能发生的问题,避免出现不必要的PD/PV[6]。(4)加强伦理的审查力度:根据相关规定[7],临床试验过程中出现任何PD/PV,均需报告伦理委员会。由于PD/PV 产生的多样性及影响的不确定性,伦理委员会作为临床试验过程中伦理和科学的把关者、受试者权益的保护和审查者,应对该类现象引起高度的重视,并将其列为伦理审查的重要部分。正确对待临床试验中的PD/PV,根据其表现形式和不同影响,在充分保护受试者权益的前提下,积极采取相应的伦理审查策略,找到行之有效的改进措施,帮助申办方、试验机构及研究者改正问题,切实地帮助临床研究机构人员和研究者提高临床研究意识和研究水平,为临床试验研究保驾护航。
临床试验过程中不论采取何种预防措施,PD/PV 的发生在所难免,但是从申办者到伦理审查,从研究者到监察员,都必须高度重视。在试验结束后我们看到的都只是原始的研究资料,任何发现到的问题都无法完整的还原当时的情景,因此在试验过程中减少PD/PV 的发生,对临床试验来说意义重大。通过一系列的改进措施和方法,减少PD/PV 的发生,提高我们临床试验的质量,值得我们每一位临床试验人为之不懈努力。
