核因子-κB/白细胞介素1β在脂多糖诱导小鼠附睾炎中的作用研究
2020-07-06路保赛国平英刘凯隆尹跃伟张艳平齐进春贾江华冯腾飞梁壮黎玮
路保赛 国平英 刘凯隆 尹跃伟 张艳平 齐进春 贾江华 冯腾飞 梁壮 黎玮
机体在物理、化学损伤或病原体感染等病理状态下,可发生系统性炎症,附睾特殊的免疫微环境平衡被破坏,导致附睾炎和男性不孕不育等并发症[1]。因此,深入研究和探讨附睾功能损伤的因素和分子机制,有助于为附睾炎提供治疗及预防的手段。在众多睾丸炎的诱发因素中,炎症十分重要[2]。研究表明,造成附睾功能损伤的可能机制是病原微生物感染进而诱导机体产生大量炎症因子,从而影响附睾正常的生理功能[2-3]。Ge等[3]报道了脂多糖(LPS)诱发的小鼠附睾炎模型中,炎症反应明显,各类炎症介质如白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、IL-6、干扰素-γ(IFN-γ)、IL-10、一氧化氮合酶2(NOS2)等mRNA表达水平明显升高。同时有学者提出,LPS能明显下调附睾特异蛋白Bin1b的表达,进一步影响精子活力[4]。本研究团队体外实验发现,LPS可以诱导附睾上皮细胞中炎性因子IL-1β、TNF-α、IL-6的表达(待发表);但在附睾炎中发挥作用的细胞因子是否会造成附睾功能损伤以及诱发附睾炎的相关信号通路及分子机制尚未阐明。因此,本研究通过建立LPS刺激诱导小鼠附睾炎模型,探讨LPS引起小鼠附睾炎的机制,寻找诱导附睾损伤的重要细胞因子,为临床治疗提供新的思路和靶点。
1 材料和方法
1.1 实验动物 8~12周、体重(30±5)g的雄性昆明小鼠,购自河北医科大学实验动物中心。每天光照、黑暗各12h规律交替饲养,室温(25±5)℃,湿度 30%~50%,适应性饲养1周。期间小鼠正常摄食饮水,每天观察小鼠毛色、状态等。
1.2 主要试剂及仪器 LPS(L2630-100 MG)购自Sigma-Aldrich公司,小鼠IL-1β酶联免疫吸附测定(ELISA)试剂盒(KE-10003-96 assays)购自 Proteintech公司,小鼠睾酮ELISA试剂(RNH94007-5 Kits)购自Demedtec公司,兔抗小鼠β-actin单克隆抗体(ab179467,100μl)购自Abcam 公司,兔抗小鼠核因子-κB(NF-κB)p65 单克隆抗体(ab2072977,100μg)购自Abcam 公司,山羊抗兔 HRP-IgG(SA00001-15,200μl)购自 Proteintech 公司,JSH-23(HY-13982,10mg)购自MCE 公司。ECL 显影液(WBULS0500,500ml)购自 Millipore 公司,10×RIPA 裂解液(ab156034,15ml) 购自Abcam公司,引物由上海生工公司合成,SYBG Green PCR master Mix(12351080-100 reactions)购自 Invitrogen 有限公司,TrizolTMReagent(R6830-02,100ml)购自OMGA公司,RevertAid First Strand cDNA Synthesis Kit(10928042-100 reactions)购自Invitrogen有限公司。
1.3 动物分组及处理 将40只小鼠按随机数字表法分成3组:LPS组30只,磷酸盐缓冲液(PBS)组5只,LPS+JSH-23组5只。小鼠用10%水合氯醛注射麻醉后固定四肢及尾巴,局部消毒。(1)LPS组:按3mg/kg剂量称取LPS并溶解于PBS;将小鼠左侧睾丸轻轻拉出注射200μl LPS注射液后送回原位,缝合腹部。(2)PBS组:将小鼠左侧睾丸轻轻拉出注射200μl PBS后送回原位,缝合腹部。(3)LPS+JSH-23组:按3mg/kg剂量称取LPS并溶解于PBS,按3mg/kg剂量称取JSH-23(依据文献[5])并溶解于二甲基亚砜;将小鼠左侧睾丸轻轻拉出注射100μl LPS注射液+100μl JSH-23注射液后送回原位,缝合腹部。LPS 组小鼠于造模 0、6、12、24、48h及3周,PBS组、LPS+JSH-23组分别于造模3周采用颈椎脱臼法处死,收集血清及附睾(0.9%氯化钠溶液冲洗3遍)。
1.4 血清及附睾组织IL-1β浓度检测 采用ELISA法。使用不含热原和内毒素的试管收集血液,室温凝血30min,1 000g离心10min,分离血清至另一新管中,-20℃保存备用。附睾组织用液氮迅速冷却研磨粉碎,超声匀浆,600g离心5min,取上清液进行检测。从冰箱中取出IL-1β检测试剂盒恢复至室温;分别设置标准品孔、空白对照孔和待测样本孔,每孔加入待测的血清100μl或附睾组织研磨上清液 100μl(含附睾组织50mg),37℃孵育1.5h;0.01M PBS洗板3 次,每孔加入生物素标记的抗鼠IL-1β抗体工作液100μl,37℃孵育60min;0.01M PBS洗板3次,每孔加入ABC工作液100μl,37℃孵育30min;0.01M PBS洗板5次,每孔加入TMB显色剂 90μl,37℃避光孵育30min;最后,每孔加入终止液100μl,终止反应后以空白孔调零,并15min内用450nm波长测量各孔吸光度(OD)值,根据标准品绘制出标准曲线,再用待测样本的OD值计算对应的样品浓度。
1.5 附睾组织IL-1β mRNA表达水平检测 采用荧光定量PCR(qRT-PCR)法。取100mg附睾组织,加入Trizol试剂及氯仿提取总RNA,使用Nanodrop核酸定量仪检测提取RNA的浓度和纯度。按照Invitrogen qRT-PCR的M-MLV第一链合成系统说明书进行逆转录制备cDNA。以18S为内参在ABI7500 Fast Realtime PCR扩增仪中进行qRT-PCR扩增,以检测各组附睾组织中IL-1β mRNA的表达水平。扩增引物由上海生工公司合成,引物序列见表1。反应条件:50℃预处理2min,循环 1次;95℃预变性 10min,循环 1次;95℃变性15s,循环 40 次;60℃退火 30s,循环 40 次;72℃延伸30s,循环40次。各组均设3个复孔。以2-ΔΔCt法计算目的基因相对表达量。

表1 引物序列
1.6 附睾组织精子常规参数检测 取造模3周小鼠右侧整个附睾组织,置于1ml PBS中剪碎,37℃孵育5min,混匀后用精液分析系统分析精子常规参数,包括精子总数、活动精子百分比、前向运动精子百分比、非前向运动精子百分比、不活动精子百分比。
1.7 附睾组织NF-κB p65蛋白表达检测 采用免疫印迹试验(western blot)法。取附睾组织,加入RIPA细胞裂解液充分研磨,离心收集上清液提取细胞蛋白。BCA法测定细胞总蛋白浓度。各孔取15μg蛋白上样,于10%聚丙烯酰胺凝胶电泳进行蛋白分离(浓缩胶90V电压,30min;分离胶120V电压,90min)。将分离后的蛋白电转移(200mA电流,35min)至PVDF膜。加入5%脱脂奶粉封闭液于摇床上室温封闭2h。分别加入兔抗鼠NF-κB p65和β-actin单克隆抗体(体积稀释比例均为1:1 000)4℃反应过夜。次日先以TBST洗膜5次,10min/次。加入HRP标记的鼠抗兔IgG(体积稀释比例为1:20 000),室温反应1h。再用TBST洗膜5次,10min/次。按ECL试剂盒说明进行显影。采用LK5100电化学发光分析系统对蛋白条带灰度值进行分析。
1.8 血清睾酮浓度的检测 采用ELISA法。使用不含热原和内毒素的试管收集血液,室温凝血30min,1 000g离心10min,分离血清至另一新管中,-20℃保存备用。取出睾酮检测试剂盒,室温平衡30min。取出酶标板,加入稀释好的标准品和待测血清各50μl,空白对照加入50μl ddH2O。每个样品重复检测3次。加入生物素化抗体工作液50μl/孔,用封板胶纸封住反应孔,室温孵育120min。洗板5次,加入洗涤液350μl/孔,甩尽孔内液体,在吸水纸上拍干。加入酶结合物工作液100μl/孔,用封板胶纸封住反应孔,室温孵育30min。洗板5次,方法同前述。加入显色剂100μl/孔,避光、室温孵育10~20min。加入终止液100μl/孔,酶标仪检测OD450值,根据标准品绘制出标准曲线,再用待测样本的OD值计算对应样品浓度。
1.9 统计学处理 采用GraphPad Prism 5.0统计软件。计量资料用表示,两组比较采用两独立样本t检验,多组间比较采用单因素方差分析,两两比较采用SNK-q检验;组内不同时点比较采用重复测量数据的方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 造模期间LPS小鼠血清、附睾IL-1β浓度及mRNA表达水平变化 与0h比较,LPS组小鼠6、12、24h血清及附睾IL-1β浓度明显升高,且呈时间依赖性(P<0.05);至48h开始降低(P<0.05),见表2和图1a-b。附睾组织IL-1β mRNA表达水平变化,与血清及附睾IL-1β浓度变化一致,见表2和图1c。提示LPS可以诱导附睾组织炎性反应。
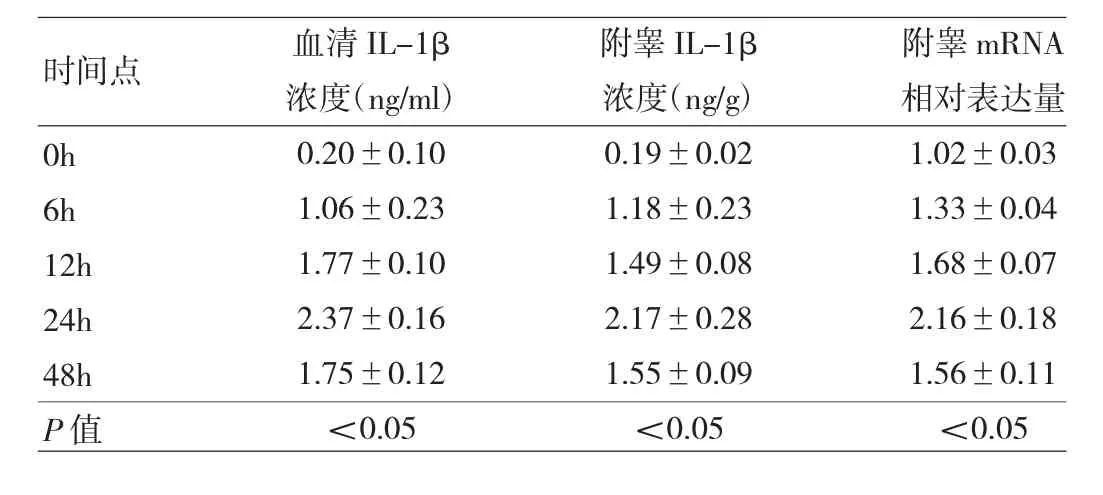
表2 造模期间LPS小鼠血清、附睾IL-1β浓度及mRNA表达水平变化(n=5)
2.2 造模3周后LPS组与PBS组小鼠附睾精子常规参数比较 造模3周后,LPS组精子总数、活动精子百分比、前向运动精子百分比、非前向运动精子百分比较PBS组均明显降低,不活动精子百分比高于PBS组,差异均有统计学意义(均P<0.05),见表3。
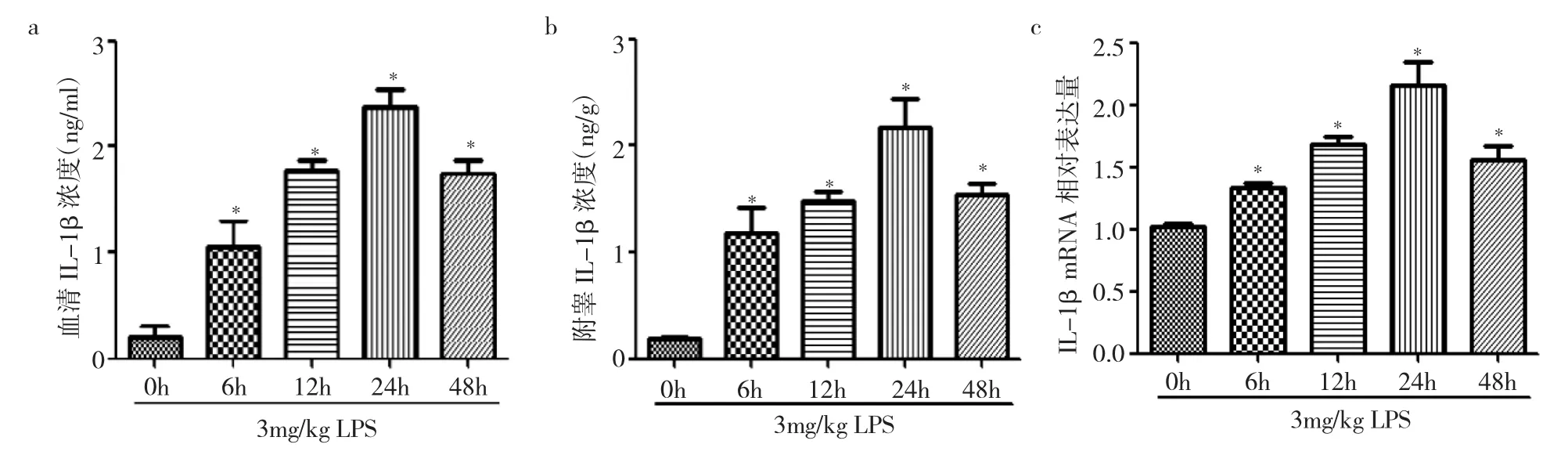
图1 造模期间LPS小鼠血清、附睾IL-1β浓度及mRNA表达水平变化(与0h比较,*P<0.05,n=5)

表3 造模3周后LPS组与PBS组小鼠附睾精子常规参数比较
2.3 造模3周后PBS组、LPS组与LPS+JSH-23组小鼠附睾组织NF-κB p65蛋白表达比较 与PBS组(1.02±0.03)比较,LPS组小鼠附睾组织NF-κBp65蛋白表达(1.61±0.08)明显上调(P<0.05),LPS+JSH-23 组(0.64±0.07)明显下调(P<0.05),见图 2。

图2 3组小鼠附睾组织NF-κB p65蛋白表达的电泳图(n=5)
2.4 造模3周后PBS组、LPS组与LPS+JSH-23组小鼠血清、附睾IL-1β浓度及mRNA表达水平比较 与PBS组比较,LPS组小鼠血清、附睾IL-1β浓度及附睾组织mRNA表达水平均明显升高(均P<0.05),LPS+JSH-23组较LPS组明显降低(均P<0.05),见表4和图3。
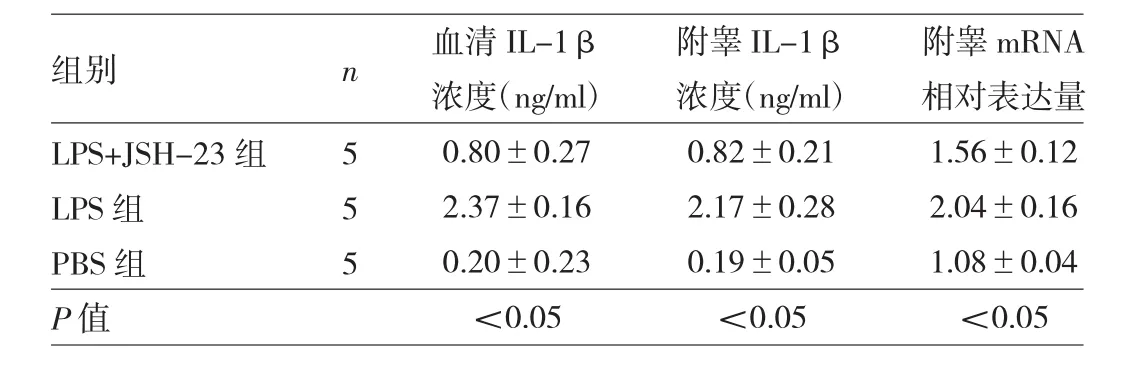
表4 造模3周后PBS组、LPS组与LPS+JSH-23组小鼠血清、附睾IL-1β浓度及mRNA表达水平比较
2.5 造模3周后PBS组、LPS组与LPS+JSH-23组小鼠血清睾酮浓度比较 LPS组小鼠血清睾酮浓度为(0.22±0.06)ng/ml,较 PBS 组(1.76±0.33)ng/ml明显降低(P<0.05);LPS+JSH-23组小鼠血清睾酮浓度为(0.70±0.15)ng/ml,较 LPS 组明显升高(P<0.05)。
3 讨论
附睾具有特殊的免疫保护屏障,可以防御病原微生物的感染,是精子成熟的主要场所。机体受到某些微生物的感染后,会破坏附睾的免疫保护屏障,引起其功能障碍,最终导致男性不育[6-7]。然而,干扰附睾功能的主要细胞因子及分子机制尚未明确。因此,本文针对细胞因子IL-1β在LPS诱导小鼠附睾炎中的作用作一探讨。
有文献报道睾丸内注射LPS,短时间内可以抑制小鼠睾丸雄激素合成,诱导生精细胞凋亡[8]。该研究表明,LPS处理12~24h可以诱导小鼠睾丸功能障碍,但48h后睾丸功能逐渐恢复。因此,本研究在此基础上进一步建立长时间LPS诱导模型,观察睾丸内注射LPS1~3周对小鼠附睾功能的影响。结果发现LPS注射 3周后小鼠精子总数、活动精子百分比、前向运动精子百分比和非前向运动精子百分比均明显低于PBS组,而不活动精子百分比明显高于PBS组,这说明长时间LPS注射可导致附睾功能损伤。临床研究发现,无精症患者的炎症因子水平明显增高[9-10]。另有文献报道,LPS可以诱导IL-6、IL-1β和TNF-α等多种炎症因子的表达,而这些炎症因子可以抑制激素的合成[11-12],进一步提示炎症因子可能参与了附睾功能的损伤。研究表明,IL-6和IL-1β可以通过抑制激素合成酶的表达从而抑制睾酮产生[13-14],但是IL-1β在附睾炎中的作用及相关机制尚未报道。本研究结果发现,注射LPS后小鼠附睾及血清IL-1β浓度及附睾组织mRNA表达水平明显上调。由于NF-κB是炎性反应的经典信号通路,NF-κB p65表达水平可以代表NF-κB通路的活化水平[15],故本研究同时检测了小鼠附睾组织中NF-κB p65蛋白表达。结果发现LPS组附睾组织NF-κB p65蛋白表达明显上调,诱导NF-κB信号通路的活化,提示睾丸内注射LPS可以显著诱导附睾组织的炎性反应。为了进一步明确NF-κB p65在LPS诱导的附睾炎性反应中的作用,笔者进一步观察了LPS与NF-κB抑制剂JSH-23同时注射小鼠附睾后炎性因子IL-1β的表达变化,结果发现IL-1β的表达依赖于NF-κB p65的活化,提示NF-κB抑制剂可以有效抑制LPS诱导的小鼠附睾炎性因子IL-1β的产生,进而抑制小鼠附睾的炎性反应。但在LPS诱导的附睾炎中,小鼠精子参数及血清睾酮浓度的改变是否依赖于NF-κB/IL-1β的活化,有待进一步明确。
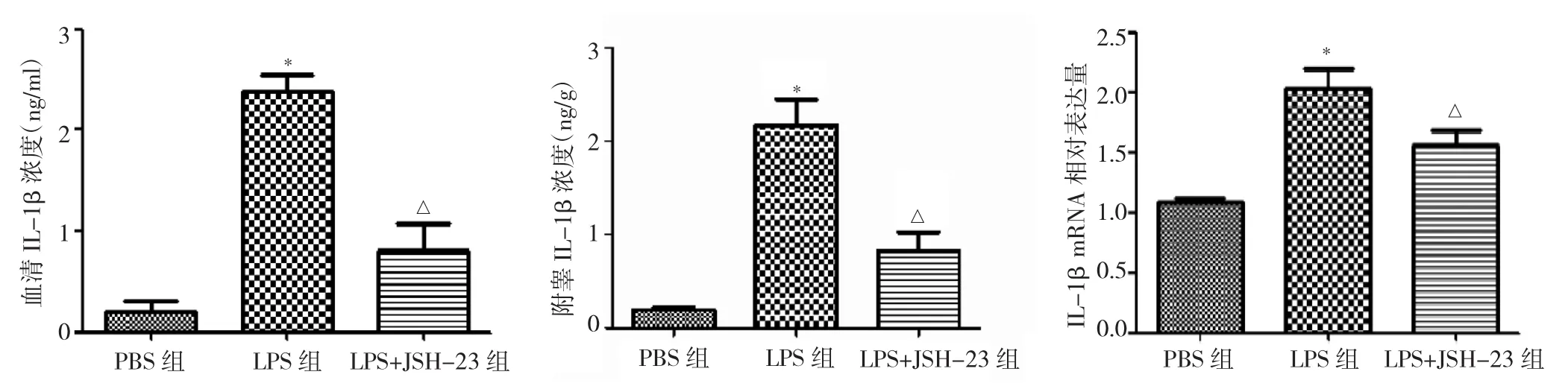
图3 造模3周后PBS组、LPS组与LPS+JSH-23组小鼠血清、附睾IL-1β浓度及mRNA表达水平比较(与PBS组比较,*P<0.05;与 LPS 组比较,△P<0.05;n=5)
综上所述,LPS能显著诱导小鼠附睾炎中IL-1β表达,而NF-κB抑制剂能有效抑制LPS诱导小鼠附睾炎中炎症因子IL-1β的产生,进而抑制小鼠附睾的炎性反应。NF-κB/IL-1β轴的调控可能作为临床治疗附睾炎的手段。
