白芍总苷对缺血性脑损伤后海马神经细胞线粒体保护作用的研究
2020-07-06陈小丽代小兰刘倩菁李红霞
陈小丽 代小兰 刘倩菁 李红霞
线粒体是缺血性损害最主要的亚细胞靶区之一[1],作为细胞能量合成中心,其功能障碍所致能量耗竭而引发细胞凋亡和坏死是缺血性脑损伤最直接的原因[2-3],因此保护线粒体或许是延缓缺血性脑损伤的重要途径。白芍总苷为毛茛科白芍属植物白芍的活性成分,能够通过改善血液流变学指标、抑制氧化应激和炎症反应等对缺血性脑损伤起到一定的保护作用[4-5]。本课题组既往研究发现,白芍总苷对缺血性脑损伤大鼠海马体病理学改变和海马神经细胞超微结构病变具有保护作用[6],但其作用机制仍有待于进一步研究。本实验探讨白芍总苷是否对缺血性脑损伤大鼠海马神经细胞线粒体(简称海马线粒体)具有保护作用,现将研究结果报道如下。
1 材料与方法
1.1 实验动物 无特定病原体(specific pathogen free,SPF)级 8周龄雄性 SD 大鼠 120只,体质量(250±20)g,购自宁波大学实验动物中心[SYXK(浙)2014-0005],动物批次号:20190112004。实验前清洁环境采用光照/黑暗周期 1:1,室温(25±1)℃,相对湿度 60%~70%适应性饲养1周;术前12h禁食,自由饮水。
1.2 药物与试剂 白芍总苷胶囊购自宁波立华制药有限公司(国药准字 H20055058,规格:0.3g/粒,含芍药苷≥104mg,批号:201804005);尼莫地平片购自上海信谊天平药业股份有限公司(国药准字H31022719,规格:20mg/片,批号:18062405)。HE试剂盒购自南京建成生物工程研究所(批号:20180129);ATP含量以及Na+-K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶活性试剂盒购自北京博奥森生物技术有限公司(批号:181107、181030、180812、181005);水合氯醛购自天津市科密欧化学试剂开发中心(批号:20180325);钙标准液购自上海生物制品研究所(批号:181205)。
1.3 实验方法
1.3.1 缺血性脑损伤大鼠模型的制备[7]将120只大鼠按照随机数字表法分为6组,分别为假手术组、模型组、白芍总苷 50mg/kg、100mg/kg、200mg/kg组和尼莫地平1mg/kg组,各20只。缺血性脑损伤模型制备:(1)制作线栓:取直径0.235mm钓鱼线并剪制3.5cm长度分段,轻轻灼烧一侧呈直径约0.35mm的圆球,于距离“圆球”一侧18~20mm处做标记,备用。(2)造模手术操作:假手术组除外,其余各组大鼠禁食12h后(自由饮水),腹腔注射10%水合氯醛溶液(3ml/kg)麻醉,颈部正中切口,剥离右侧颈总动脉、颈外动脉、颈内动脉,充分暴露3者分叉处,动脉夹夹闭颈总动脉,结扎并剪断颈外动脉,使用眼科剪在颈外动脉残端上(距离分叉约1cm处)剪出斜形小口、插入线栓进颈内动脉,遇阻力止,深度距分叉处约18mm,固定线栓后松开颈总动脉动脉夹,逐层缝合,消毒。(3)假手术组操作:假手术组大鼠实施麻醉后,颈部正中切口,剥离右侧颈总动脉、颈外动脉、颈内动脉,然后即逐层缝合、消毒。(4)用药方法:精确称量白芍总苷内容物和尼莫地平,研碎后加入0.9%氯化钠溶液溶解并稀释至相应浓度。术后第2天开始,白芍总苷 50mg/kg、100mg/kg、200mg/kg组及尼莫地平1mg/kg组分别予相应溶液5ml/kg灌胃,假手术组和模型组分别灌胃0.9%氯化钠溶液5ml/kg,1次/d,共28d。
1.3.2 组织病理学检查 第29天,各组按照随机数字表法取6只大鼠,实施麻醉后开胸暴露心脏,心脏灌注300ml 0.9%氯化钠溶液,300ml 4%多聚甲醛溶液,灌注速度由快到慢,断头取脑置于4%多聚甲醛溶液固定24h;然后进行石蜡包埋,应用石蜡切片机(RM2125型,德国Leica公司)2μm厚度切片,经二甲苯透明、梯度酒精脱蜡处理后,行HE染色:苏木精溶液浸泡5min,2次各30s水冲洗,PBS溶液返蓝,30s水洗,伊红溶液浸泡30s,梯度酒精脱水,二甲苯透明,中性树胶封片,倒置光学显微镜(BH-2型,日本Olympus公司)观察并照相保存。
1.3.3 海马线粒体超微结构观察 第31天,各组按照随机数字表法再取6只大鼠,实施麻醉后开胸暴露心脏,心脏灌注300ml 0.9%氯化钠溶液后,灌注4%多聚甲醛溶液至肝脏颜色明显变淡时,立即断头取脑并剥离海马体,切割成约1mm3小块后置4℃预冷的3%戊二醛溶液中于4℃冰箱固定2h,PBS溶液浸洗30min,置于1%四氧化锇溶液于4℃下固定2h,然后依次经梯度酒精脱水、还氧丙烷置换、环氧树脂Epon812浸透、包埋、聚合、光学显微镜下定位后,超薄切片(60nm),经醋酸铀和柠檬酸铅染色后,经10 000倍透射电子显微镜(H-7650型,日本Hitachi公司)观察海马线粒体超微结构并拍照。
1.3.4 海马线粒体肿胀程度、膜流动性和线粒体膜总磷脂(简称膜总磷脂)含量检测 (1)海马线粒体提取及检测蛋白浓度:第32天,取各组剩余的8只大鼠,麻醉后断头并取脑组织,去除脑膜、小脑、嗅球、脑干,用4℃预冷0.9%氯化钠溶液冲洗干净后,剥取缺血侧大脑海马体,参照李富强等[3]报道的方法制备海马线粒体:加入适量冷裂解液{0.1mol/L 氨丁三醇(Tris-HCl),调 pH7.4,0.25 mol/L 蔗糖(Sucrose),0.1mol/L乙二醇双(2-氨基乙基醚)四乙酸[ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid,EGTA]}制备 10%脑组织匀浆液,第1次4℃低温离心(离心力650g)20min后取上清液,第2次4℃低温离心(离心力7 700g)20min后取沉淀,即为海马线粒体。采用Lowry法检测蛋白浓度。(2)海马线粒体肿胀程度测定[8]:取海马线粒体悬液并加入适量蔗糖溶液,4℃低温离心(离心力7 000g,10min)后去上清液,重复一次。依次加入1ml蔗糖溶液、1μl CaCl2溶液(浓度200mmol/L)后,通过紫外-可见分光光度计(UV759型,上海圣科仪器设备有限公司)检测520nm波长处吸光度值(A520nm),3min内每30s检测一次,A520nm越小则说明肿胀程度越高。(3)海马线粒体膜流动性测定:第33天,参照Barkhade等[9]的报道,采用荧光偏振度法测定海马线粒体膜流动性。取1ml海马线粒体悬液加入3ml浓度为2μmol/L的二苯基己三烯(diphenyl hexatriene,DPH)溶液,25℃恒温放置 30min后,通过荧光酶标仪(伯乐生命医学产品有限公司)测定荧光偏振度P(激发波长 362nm,发射波长432nm),P=(I-GI′)/(I+GI′),其中I表示与激发偏振光振动方向平行时的荧光偏振光强度、I′表示与激发偏振光振动方向垂直时的荧光偏振光强度,G为校正因子。由P计算微粘度(η),η=2P(0.46-P),采用 η 值代表线粒体膜流动性,η值越小则说明膜流动性越大。(4)膜总磷脂含量测定:第33天,采用Trinder酶试剂盒法测定膜总磷脂含量。
1.3.5 海马线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)开放度、膜电位检测 (1)MPTP开放度测定:第34天,取海马线粒体悬液,遵照MPTP开放度检测试剂盒(上海碧云天生物技术有限公司)操作说明依步骤处理,操作过程避免光照,通过荧光酶标仪(伯乐生命医学产品有限公司)检测(激发波长540nm,发射波长580nm),荧光强度越高表示MPTP开放度越高。(2)膜电位测定:取海马线粒体悬液,遵照线粒体膜电位水平检测试剂盒(上海碧云天生物技术有限公司)操作说明依步骤处理,通过荧光酶标仪检测(激发波长485nm,发射波长590nm),线粒体膜电位较高时产生红色荧光、较低时产生绿色荧光。
1.3.6 海马线粒体呼吸功能和呼吸酶活性检测 (1)改良Clark氧电极法[10]检测线粒体呼吸功能:第35天,取1mg蛋白量线粒体悬液,加入2.5ml反应介质中,30℃恒温孵育 1min后加入20μl显色底物,2min后加入10μl浓度为45mmol/L的腺苷二磷酸,连续描记Ⅲ态(R3)耗氧曲线和腺苷二磷酸完全磷酸化后的Ⅳ态(R4)耗氧曲线,R3、R4耗氧速率比值为呼吸控制率(respiratory control rate,RCR),根据R3耗氧曲线和R4耗氧曲线计算磷氧比(phosphorus/oxygen,P/O)和氧化磷酸化效率(oxidative phosphorylation rate,OPR)。(2)呼吸酶活性检测:第35天,取海马线粒体悬液,经3次冻融后,按改进氧电极法测定呼吸酶(NADH脱氢酶、琥珀酸脱氢酶和细胞色素C氧化酶)活性。
1.3.7 海马线粒体ATP酶活性、ATP含量及游离Ca2+水平检测 第36天,取海马线粒体悬液,通过超声波破碎后,严格按照各检测试剂盒操作说明步骤检测Na+-K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶活性,以每小时每毫克蛋白分解ATP产生1μmol无机磷的量为1活力单位[μmol Pi/(mg Pro·h)]。采用比色法检测海马线粒体内ATP含量。采用原子化学发光法,以CaCO3为标准,检测海马线粒体内游离Ca2+水平。
1.4 统计学处理 采用SPSS 15.0统计软件。计量资料以表示,多组间比较行单因素方差分析,两组间比较行独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 6组大鼠海马体病理学改变比较 见图1。
由图1可见,白芍总苷50mg/kg组、100mg/kg组海马体神经细胞数量减少,少量细胞空泡变性,细胞核偏移、固缩。白芍总苷200mg/kg组和尼莫地平1mg/kg组神经细胞数量和细胞形态基本正常。模型组神经细胞数量减少、细胞间隙增大,胞体空泡变性、呈三角形或多角形,细胞核固缩等。假手术组海马神经细胞排列整齐规则、层次清晰,细胞呈圆形,结构清楚,核膜、核仁边界清晰,形态结构均未见异常。
2.2 6组大鼠海马线粒体超微结构改变比较 见图2。

图1 6组大鼠海马体病理学改变比较(a:白芍总苷50mg/kg组;b:白芍总苷100mg/kg组;c:白芍总苷200mg/kg组;d:尼莫地平1mg/kg 组;e:模型组;f:假手术组;HE 染色,×400)
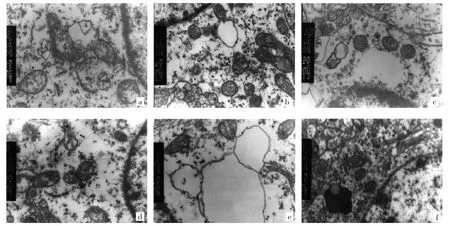
图2 6组大鼠海马线粒体超微结构改变比较(a:白芍总苷50mg/kg组;b:白芍总苷100mg/kg组;c:白芍总苷200mg/kg组;d:尼莫地平1mg/kg 组;e:模型组;f:假手术组;醋酸铀 - 柠檬酸铅双染色,×10 000)
由图2可见,白芍总苷50mg/kg组海马线粒体数量减少,基质透明化,膜磷脂层破坏,嵴断裂溶解、间隙增大。白芍总苷100mg/kg组海马线粒体数量减少,膜磷脂层破坏,嵴断裂溶解。白芍总苷200mg/kg组海马线粒体数量基本正常,膜磷脂层和嵴结构基本完整。尼莫地平1mg/kg组海马线粒体数量减少,膜磷脂层破坏,嵴断裂溶解、间隙增大。模型组海马线粒体数量减少,基质透明化,膜磷脂层破坏,水肿、崩解,嵴断裂溶解、消失、间隙增大。假手术组海马线粒体超微结构未见明显异常。
2.3 6组大鼠海马线粒体A520nm值、η值、膜总磷脂含量比较 见表1。

表1 6组大鼠海马线粒体A520nm值、η值、膜总磷脂含量比较
由表1可见,6组大鼠间海马线粒体A520nm值、η值、膜总磷脂含量比较,差异均有统计学意义(P<0.05或0.01)。与假手术组比较,模型组大鼠海马线粒体A520nm值显著降低、η值显著升高、膜总磷脂含量显著降低,差异均有统计学意义(均P<0.01)。与模型组比较,白芍总苷100mg/kg、200mg/kg组和尼莫地平1mg/kg组A520nm值显著升高、η值显著降低,白芍总苷100mg/kg、200mg/kg组膜总磷脂含量显著升高,差异均有统计学意义(P<0.05或 0.01)。
2.4 6组大鼠海马线粒体MPTP开放度、膜电位比较 见表2。
由表2可见,6组大鼠海马线粒体MPTP开放度、膜电位比较,差异有统计学意义(均P<0.01)。与假手术组比较,模型组大鼠海马线粒体MPTP开放度显著升高、膜电位显著降低,差异有统计学意义(均P<0.01)。与模型组比较,白芍总苷100mg/kg、200mg/kg组和尼莫地平1mg/kg组MPTP开放度显著降低且膜电位显著升高,差异均有统计学意义(P<0.05或0.01)。

表2 6组大鼠海马线粒体MPTP开放度、膜电位比较
2.5 6组大鼠海马线粒体呼吸功能和呼吸酶活性比较见表3。
由表3可见,6组大鼠海马线粒体R3、RCR、P/O、OPR及NADH脱氢酶、琥珀酸脱氢酶、细胞色素C氧化酶活性比较,差异均有统计学意义(均P<0.01)。与假手术组比较,模型组大鼠海马线粒体R3、RCR、P/O、OPR显著降低而R4显著升高,NADH脱氢酶、琥珀酸脱氢酶、细胞色素C氧化酶活性显著降低,差异有统计学意义(均P<0.01);与模型组比较,白芍总苷100mg/kg、200mg/kg组和尼莫地平 1mg/kg 组 R3、RCR、P/O、OPR显著升高且R4显著降低,NADH脱氢酶、琥珀酸脱氢酶、细胞色素C氧化酶活性显著升高,差异均有统计学意义(P<0.05或 0.01)。
2.6 6组大鼠海马线粒体ATP酶活性、ATP含量及游离Ca2+水平比较 见表4。
由表4可见,6组大鼠海马线粒体Na+-K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶活性及ATP含量、游离Ca2+水平比较,差异均有统计学意义(均P<0.01)。与假手术组比较,模型组大鼠缺血侧海马线粒体Na+-K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶活性和ATP含量均显著降低,游离Ca2+水平显著升高,差异有统计学意义(均P<0.01);与模型组比较,白芍总苷 100mg/kg、200mg/kg组和尼莫地平1mg/kg组Na+-K+-ATP酶、Ca2+-ATP酶、Mg2+-ATP酶活性和ATP含量显著升高,游离Ca2+水平显著降低,差异有统计学意义(P<0.05或0.01)。

表3 6组大鼠海马线粒体呼吸功能和呼吸酶活性比较

表4 6组大鼠海马线粒体ATP酶活性、ATP含量及游离Ca2+水平比较
3 讨论
线粒体是细胞呼吸及能量代谢的中心,在细胞各种生理过程中均发挥着重要作用,保护线粒体结构完整是维持其功能的基础[11]。而线粒体是易受缺血性脑损伤累及的细胞器之一,本研究发现缺血性脑损伤大鼠海马体呈现神经细胞数量减少、间隙增大,胞体空泡变性、呈三角形或多角形,细胞核固缩等明显的病理性改变;并且通过透射电镜观察发现,海马线粒体呈现数量减少,基质透明化,膜磷脂层破坏,水肿、崩解,嵴断裂溶解、消失、间隙增大等明显的超微结构病变,该结果与Jankauskas等[12]的研究结论一致;此外,缺血性脑损伤将导致海马线粒体膜肿胀程度升高、膜流动性降低、膜磷脂含量降低,与李桂生等[13]研究报道一致,线粒体为膜性细胞器,其生理功能依赖膜结构的完整性,而膜肿胀程度、膜流动性、膜总磷脂含量能够反映线粒体膜完整性及其功能。白芍总苷是一种具有多种生物活性的天然化合物,本研究结果显示白芍总苷具有抑制缺血性脑损伤大鼠海马神经细胞结构病变、抑制海马线粒体超微结构病变的作用,缓解海马线粒体膜水肿并提高膜流动性和膜总磷脂含量。
线粒体膜电位是生物膜内负外正而形成的电位差,对维持线粒体功能起着关键作用,其中ATP合成与其密切相关,Alizadeh等[14]研究发现膜电位降低将直接导致ATP合成减少并影响正常生命活动。MPTP是一种非特异性通道,其开放度受体内氧化应激水平及Ca2+离子水平调节,当膜完整性遭到破坏时MPTP开放度升高,致使正常情况下不能通过的大分子量离子自由通过,破坏离子平衡,此外有学者研究发现MPTP开放度升高将导致膜电位下降、释放促凋亡蛋白而触发线粒体凋亡通路[15]。本研究发现,经白芍总苷治疗能够有效抑制缺血性脑损伤大鼠海马线粒体膜电位的降低和MPTP开放度的升高。
线粒体的重要生理功能之一是通过呼吸链反应产生ATP而供给能量,线粒体受损所致能量代谢障碍是缺血性脑损伤发生发展的关键因素。本实验结果显示缺血性脑损伤大鼠海马线粒体呼吸功能降低且呼吸酶活性均明显降低。线粒体呼吸功能降低将直接导致ATP合成受阻并间接影响能量依赖性的ATP酶活性,其中Na+-K+-ATP酶活性降低将导致Na+内流,一方面降低膜电位而进一步抑制ATP合成,另一方面将引发Na+/Ca2+交换,使Ca2+进入线粒体,正常情况下Ca2+能够在Ca2+-ATP酶、Mg2+-ATP酶作用下被泵出而维持线粒体Ca2+平衡,但ATP合成受阻所致Ca2+-ATP酶、Mg2+-ATP酶活性降低而使线粒体Ca2+泵出受限而引发钙超载[16],并且钙超载将抑制线粒体氧化磷酸化功能而抑制ATP合成,从而形成“ATP合成障碍-钙超载-ATP合成障碍”的“恶性循环”,最终加重缺血性脑损伤。本研究发现,经白芍总苷治疗能够明显改善缺血性脑损伤大鼠海马线粒体呼吸功能、提高呼吸酶活性和ATP含量,提高海马线粒体ATP酶活性、降低海马线粒体Ca2+水平,提示白芍总苷具有保护缺血性脑损伤大鼠海马线粒体功能的作用。
综上所述,白芍总苷具有抑制缺血性脑损伤大鼠海马线粒体病变并保护线粒体功能的作用。
