人参皂苷Rb3糖基水解酶的纯化及其反应特性
2020-07-04张睿哲徐龙权宋建国鱼红闪
张睿哲 徐龙权 宋建国 鱼红闪
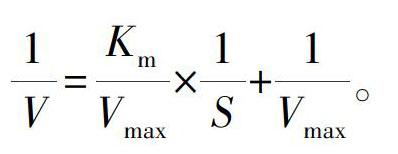


摘 要: 人參皂苷Rb3是三七茎叶皂苷的主要成分。为了充分利用廉价的三七茎叶皂苷,该研究以微生物Aspergillus sp. P90r菌为对象,综合运用生物转化的方法,经过提取、分离纯化和酶活力测定等步骤,最终以确定酶反应途径的方式得到了所产的特异性人参皂苷Rb3糖基水解酶的相关性质和动力学等反应特性。结果表明:该酶比Absidia sp. GRB3-X8r菌产酶活力高15%~25%,SDS-PAGE电泳结果测得分子量约为65.6 ku,纯化后酶蛋白的含量为0.237 mg·mL-1,蛋白比活力可达到169 U·mg-1,纯化倍数为13.70,回收率为9.39%。人参皂苷Rb3糖基水解酶在pH=5.0的偏酸性环境下酶活力很高,最适反应条件:pH=3.0~5.0,温度45 ℃,其中在pH=4.0~6.0范围内相对稳定。该酶在20 min时进入混合级反应,酶反应米氏常数Km值为8.77 mmol·L-1,Vmax为57.44 mmol·L-1·h-1,在60 min时反应速度达到最大,Vmax趋于稳定,为66.63 mmol·L-1·h-1。通过对酶的催化特性研究表明,该酶先水解Rb3的20-O-木糖基,其次水解3-O-葡萄糖基,最终催化反应产物中有F2和C-K生成。综上结果,微生物Aspergillus sp. P90r菌酶具有能水解人参皂苷Rb3木糖基和葡萄糖基的特异性。
关键词: 人参皂苷Rb3, 人参皂苷Rb3糖基水解酶, 酶学性质, 酶分离纯化, 酶促反应动力学
中图分类号: Q814.1
文献标识码: A
文章编号: 1000-3142(2020)05-0706-09
Purification and reaction characteristics of hydrolyzed ginsenoside Rb3-glycosylase
ZHANG Ruizhe, XU Longquan, SONG Jianguo, YU Hongshan*
( College of Biology Engineering, Dalian Polytechnic University, Dalian 116034, Liaoning, China )
Abstract: Hydrolyzed ginsenoside Rb3 is the main component of Panax notoginseng stem and leaf saponins. In order to make full use of cheap P. notoginseng stem and leaf saponins, the microorganism Aspergillus sp. P90r was studied, and we used the biotransformation methods comprehensively. Related properties, kinetics and other reaction characteristics of the specific ginsenoside Rb3-glycosylase were produced by determining the way of enzymatic reaction through extraction, separation, purification, enzyme activity determination and other steps. The results were as follows: This enzyme activity was 15%-25% higher than the enzyme by Absidia sp. GRB3-X8r. The result of the molecular weight of enzyme protein was 65.6 ku by SDS-PAGE electrophoresis. The content of enzyme protein was 0.237 mg·mL-1 after purification, the specific activity of the protein was attainable as 169 U·mg-1, the purification factor was 13.70 and the recovery rate was 9.39%. And the enzyme activity of ginsenoside Rb3-glycosylase was higher in the pH 5.0 of acidic environment. The enzyme was suitable condition in the range of pH 3.0-5.0, in the temperature of 45 ℃, and it was relative stable in the range of pH 4.0-6.0. The enzyme entered the mixed-order reaction at 20 min, and the results of the enzyme reaction kinetics showed that the Km value was 8.77 mmol·L-1 and Vmax was 57.44 mmol·L-1·h-1. The reaction rate reached the maximum at 60 min, and the speed tended to be stable, and Vmax was 66.63 mmol·L-1·h-1. The results on catalytic properties of enzymes showed that the enzyme firstly hydrolyzes 20-O-xylose of ginsenoside Rb3, secondly hydrolyzes 3-O-glucosyl, eventually which the catalytic reaction products include the formed substance of F2 and C-K. In summary, the microbial Aspergillus sp. P90r enzyme has the specificity to hydrolyzed ginsenoside Rb3-xylose and Rb3-glucose.
Key words: hydrolyzed ginsenoside Rb3, hydrolyzed ginsenoside Rb3-glycosylase, enzyme properties, isolation and purification, enzyme kinetics
我国高产量的人参属植物是人参(Panax ginseng)、三七(P. notoginseng)、西洋参(P. quinguefolus)等,其人参属植物中化学成分比较复杂,主要的有效活性物质是人参皂苷(宋亚会和姜晓军,2009)。其主要活性成分为人参皂苷Rb1、Rb2、Rb3、Rc、Rd、Re、Rg1等(金凤燮,2009)。目前,已分离鉴定出182种人参皂苷(Kim et al., 2017)。现代药理学研究发现,某些稀有人参皂苷具有很好的药理和临床方面的疗效。因此,利用生物转化法,用含量较高的人参皂苷为底物,获得产量大、纯度高的稀有人参皂苷,具有非常重要的科研意义和社会价值(张怡轩等,2008;吴红金和刘宇娜,2008;Jia,2009;Jin et al., 2012;居乃香和孙静,2014;韩淑娴和游云,2016;毛柳珺,2017)。
三七茎叶皂苷以Rb3为主,Rb3分子带有20-O-Xyl-Glc-糖链和3-O-Glc-Glc-糖链,活性低、难吸收,因此三七茎叶利用率低(金凤燮,2009)。为了提高三七茎叶皂苷的利用价值,将Rb3转化为高活性、低糖基的F2、C-K皂苷,是提高三七茎叶皂苷利用度的可行途径。为此,本实验室研究了Rb3的生物转化,Asperginllus niger g.48菌产人参皂苷酶I型(分子量为74 kD),同时水解Rb3的20-O-木糖基和3-O-葡萄糖基,通过Rb3→C-Mx1→C-Mx→C-K途径和Rb3→Rd→F2→C-K的两个途径水解Rb3(Liu et al., 2014);还有A. niger g.848菌所产的人参皂苷酶I型(分子量为75kD),水解Rb3的糖基,生成Rd、F2、C-K等皂苷(Liu et al., 2015);但上述两种A. niger所产的人参皂苷酶水解的三七茎叶皂苷主要生成人参皂苷C-Mx和C-K,并有越南参皂苷R7和三七参皂苷Fc残留,说明A. niger菌产酶与三七茎叶复合皂苷反应时,很难水解C-Mx或Rb3皂苷的20-O-末端木糖基,对R7和Fc皂苷的3-O-末端木糖基无水解作用,影响了高活性皂苷C-K的产率。为了解决酶很难水解三七茎叶皂苷的木糖基问题,赵信平等(2018)研究了Absidia sp. GRB3-X8r菌产特异性人参皂苷Rb3木糖苷酶(分子量66.7 kDa),但是该酶仅能水解Rb3的20-O-木糖基,欠缺进一步水解3-O-葡萄糖基生成F2的酶活力。因此,本文利用生物转化法研究另一种微生物Aspergillus sp. P90r菌所产的人参皂苷Rb3糖基水解酶,以期獲得纯酶的相关性质和动力学等反应特性。
1 材料与方法
1.1 材料、试剂和仪器
Aspergillus sp. P90r菌,本实验室从大曲中筛选分离得到。人参皂苷Rb3、Rd、F2、C-K,由天乐集团提供。标准蛋白(齐崴等,2005),购于大连宝生物公司。柠檬酸、过硫酸铵为天津市大茂化学试剂厂产品;丙烯酰胺、甲叉双丙烯酰胺为北京化工厂产品;甘氨酸、溴酚蓝、考马斯亮兰G250、四甲基乙二胺(TEMED)购置于国药集团化学试剂有限公司;十二烷基硫酸钠为北京鼎国生物技术发展中心产品;以上试剂均为分析纯试剂。
薄层层析板Silica gel 60-F254,德国Merck公司产品;DEAE-Cellulose DE-52,英国Whatman公司产品;CS930双波长薄层扫描仪购置于日本津岛公司;BSZ-160自动部分收集器由上海金生达生化仪器有限公司提供;蛋白质电泳仪购置于Bio-Rad 公司;Waters 2695高效液相色谱仪;Waters 2996 PDA光电二极管阵列检测器;Knauer C18色谱柱(5 μm,3 mm × 250 mm)。
1.2 方法
1.2.1 粗酶液的制备 Aspergillus sp. P90r菌接种于含5%的麦汁、1%的三七茎叶浸出液,pH=6.6的察氏培养基中,在30 ℃摇床培养5~6 d;离心除菌体,上清液中缓慢加入已研磨好的硫酸铵粉末至80 %饱和度,摇匀,于4 ℃下静置6 h;离心收集蛋白质沉淀。将沉淀溶于少量的0.01 mol·L-1 pH=3.0磷酸氢二钠-柠檬酸缓冲液,透析,每2 h更换一次缓冲液,透析20 h;离心除杂,沉淀溶于0.02 mol·L-1 pH3.0磷酸氢二钠-柠檬酸缓冲液中,即为粗酶液。
1.2.2 酶活力的测定 取0.1 mL的0.2%的人参皂苷Rb3(0.02 mol·L-1,pH3.0磷酸氢二钠-柠檬酸缓冲液)与0.1 mL粗酶液混合,在45 ℃条件下反应24 h,加入0.2 mL水饱和正丁醇终止酶反应,取上层有机相作TLC薄层层析或HPLC检测。酶活力单位,定义为每小时降解1 mmol Rb3酶量为一个酶活力单位。
1.2.3 薄层层析(TLC) 酶水解人参皂苷Rb3生成产物用TLC方法测定。展开剂为V(氯仿)∶V(甲醇)∶V(水)的比例为7∶3∶0.5,展开后用10% H2SO4水溶液,于105 ℃加热显色。TLC检测图中的各组分的百分含量,利用Bandscan分析软件分析(Liu et al., 2015)。
1.2.4 高效液相色谱(HPLC) 色谱条件:色谱仪,Waters 2695高效液相色谱分析仪,Waters 2996 PDA光电二极管阵列检测器及Empower色谱工作站进行检测。色谱柱:Knauer C18柱;流动相:乙腈(A)-水(B);0~20 min,20%A等度;20~31 min,20%A~32%A线性梯度;31~40 min,32%A~43%A线性梯度;40~70 min,43%A~100%A线性梯度;进样量:10 μL;柱温:35 ℃;体积流速:0.6 mL·min-1;检测波长:203 nm。
1.2.5 酶的分离纯化 先向DEAE-cellulose DE52阴离子交换柱中缓慢上样6 mL粗酶液,进行分离提纯。再配制由20 mmol·L-1 pH3.0的磷酸氢二钠-柠檬酸缓冲体系溶液溶解的浓度为40、50、60、70、80、90、100 mmol·L-1的KCl溶液,对上样后的粗酶液进行梯度洗脱,每一梯度洗100 mL,控制流速为1 mL·min-1,用自动部分收集器,大约每3 mL收集1试管洗脱液;收集酶液与0.1% Rb3反应,TLC检测,筛选出含有Rb3糖基水解酶活力的洗脱液。
1.2.6 蛋白质分子量的测定 将含有酶活力的洗脱液,做SDS-PAGE电泳,确定产生单一条带的试管,同时计算人参皂苷Rb3糖基水解酶的分子量(李建武,1997)。SDS聚丙烯酰胺凝胶的浓缩胶和分离胶分别为5%和12%,电压分别为60 V和120 V。
1.2.7 人参皂苷Rb3糖基水解酶最佳反应条件 测定最佳pH:分别配制pH值为1.3、2.2、3、4、5、6、7、8、9、10的缓冲溶液,将0.1%的人参皂苷Rb3溶于不同pH值的缓冲溶液中,每个pH值底物溶液与同pH值的酶液等体积均匀混合,在适宜的条件下做酶促反应,用TLC法检测人参皂苷Rb3的水解情况。确定pH稳定性:取纯化酶液与不同pH值的缓冲液等量混合,室温下放置30 min,加入人参皂苷Rb3底物溶液,于酶的最适pH值反应体系中检测酶活力,以未经处理过的酶活力作为100%计算相对酶活力。确定最佳反应温度:在上述反应条件下,采用35、40、45、50、55℃ 条件下进行酶催化反应。确定最佳反应时间:在最佳反应温度下,将酶液与底物溶液分别反应1/6、1/3、1/2、1、2、4、8、12、24 h,用TLC法检测人参皂苷Rb3的水解情况。
1.2.8 酶反应动力学 配制浓度分别为14.3、16.7、20.0、25.0、33.0、50.0 mmol·L-1的Rb3底物溶液与等体积纯酶液混合,最终浓度分别为7.15、8.35、10.0、12.5、16.5、25.0 mmol·L-1的Rb3底物溶液;于45 ℃反应5、10、20、40、60、90、120、180 min后,对Rb3反应产物做TLC检测,利用分析TLC版皂苷斑点中Rb3的降解量,确定Rb3各底物浓度在5、10、20、40、60 min时的Rb3酶反应初速度(平均值)。根据酶反应初速度,作Lineweaver-Burk曲线(齐崴等,2001;张华新等,2006;陈娇娇等,2011;史刘辉等,2012):
通过所得到的直线方程可以得到横轴的截距-1/Km,纵轴的截距1/Vmax,即可计算出Km和Vmax值,将结果代入得Michaelis-Menten方程。这为酶反应工程设计提供依据。
1.2.9 以pNP为底物的酶活性測定 以对硝基苯酚单糖苷(pNP-α-D-Gal、pNP-β-L-Ara、pNP-α-L-Rha、pNP-β-D-Xyl、pNP-β-D-Glu)为底物,含有400 μL的0.08 mmol·L-1的pNP底物溶液,与酶样品100 μL混合,45 ℃反应30 min后加入5 mL 1 mol·L-1 Na2CO3终止反应,测定405 nm下的吸光值。酶活力定义为单位时间内释放1 μmol硝基苯酚的酶量为一个酶活力单位。
2 结果与分析
2.1 粗酶液的制备
由Aspergillus sp.P90r菌接种得到的粗酶液,在Rb3浓度0.01%~0.5%范围内,均能转化为Rd、F2和C-K。最佳反应温度为45 ℃,最佳反应时间2 h,pH值在1.3至6.0的状态下反应效果较好,酶反应最佳pH为 3.0~5.0,而在pH4.0~6.0范围内相对稳定,其中在pH5.0的偏酸性环境下稳定性最高,如图1和图2所示。
经三次实验结果表明,Aspergillus sp. P90r菌产酶活力,在相同条件下比文献中的Absidia sp. GRB3-X8r菌产酶活力,提高了15%~25%。
2.2 酶的分离纯化
将上述粗酶液经DEAE-Cellulose DE52离子交换柱洗脱,收集的第 81、93、94、95试管,具有将人参皂苷Rb3水解生成人参皂苷Rd、F2和C-K的高酶活力。因此对第81、93、94、95管的酶液进行PAGE电泳, 结果第93、94管酶基本为电泳单带;将上述电泳单带的酶蛋白切胶回收, 进一步采用
SDS-PAGE电泳法检测,结果如图3所示。
经硫酸铵沉淀以及DEAE-Cellulose DE52分离纯化的结果见表1。从表1可以看出,纯化后酶蛋白的含量为0.237 mg·mL-1,蛋白比活力为169 U·mg-1,纯化倍数为13.70,回收率为9.39%。
由图3可知,提纯分离的Aspergillus sp. P90r菌的第93、94管洗脱液,产生了电泳单一条带,证明是纯酶蛋白。根据SDS-PAGE中各标准蛋白条带的相对迁移率,得到蛋白质分子质量标准曲线和相对迁移率的回归方程:y=5.090 9-0.956 6x(R2=0.993 9)。经计算得到人参皂苷Rb3糖基水解酶的分子量约为65.6 ku。
利用其提纯的糖基水解酶与0.1%的人参皂苷Rb3反应,其反应产物用HPLC测定结果,如图4所示。图4结果表明,人参皂苷Rb3在人参皂苷Rb3糖基水解酶的催化作用下,产物主要是Rd、F2和C-K,其中Rd含量最多,其次是F2,C-K相对较少。
2.3 酶促反应动力学
将不同浓度的Rb3底物溶液与等体积纯酶液混合,最终浓度分别为7.15、8.35、10.0、12.5、16.5、25.0 mmol·L-1的Rb3底物溶液,于45 ℃反应5、10、20、40、60、90、120、180 min后,对其Rb3 6种浓度、8种不同反应时间段的Rb3反应产物,作TLC检测,如图5所示。
由图5可知,人参皂苷Rb3糖基水解酶的催化反应随时间的延长,Rb3的降解量在不断提高,在5~10 min Rb3的降解量较低,20 min后Rb3的降解量明显提高。利用软件分析图4中Rb3皂苷斑点的降解量,取催化反应5、10、20、60、90 min时Rb3降解量,计算Vmax。在5 min时计算得到Km=2.94 mmol·L-1,Vmax =20.21 mmol·L-1·h-1;在10 min时计算得到Km =5.32 mmol·L-1,Vmax =28.73 mmol·L-1·h-1;在20 min时计算得到Km =8.77 mmol·L-1,Vmax =57.44 mmol·L-1·h-1; 在60 min时计算得到Km =8.93 mmol·L-1,Vmax =66.63 mmol·
L-1·h-1;在90 min时计算得到Km=9.89 mmol·L-1,Vmax =65.98 mmol·L-1·h-1。其中60 min的情况如表2所示。
从表2可得Km =8.93 mmol·L-1,Vmax =66.63 mmol·L-1·h-1,即Michaelis-Menten方程:
从上述数据可以得出,人参皂苷Rb3糖基水解酶的酶反应速度遵循米氏方程的规律,底物浓度较低时,先遵循一级反应,反应速度随底物浓度上升而上升,然后在20 min时进入混合级反应,最后在60 min时反应速度达到最大,反应速度不再随浓度上升而上升,进入零级反应,此时Vmax趋于稳定。
从图4和图5可以看到,Aspergillus sp. P90r菌所产的人参皂苷Rb3糖基水解酶,水解人参皂苷Rb3的产物主要有Rd、F2和C-K。该酶先水解人参皂苷Rb3的20-O-木糖基变为Rd,进一步水解人参皂苷Rd的3-O-葡萄糖基变为F2,再进一步水解人参皂苷F2的3-O-葡萄糖基变为最终产物C-K。也就是说,Aspergillus sp. P90r菌所产的人参皂苷Rb3糖基水解酶具有水解木糖基和葡萄糖基的特异性。其酶反应途径如图6所示。
2.4 以pNP单糖苷为底物酶催化特性
用纯化后的第93、94管酶液,采用1.2.9方法,进行酶活力测定,结果如表3所示。表中数据表明,该酶不仅能水解β-D-木糖苷,还能水解β-D-葡萄糖苷,对α-D-半乳糖苷、α-L-鼠李糖苷、β-L-阿拉伯糖苷无水解能力,表现出独特的水解特性。
3 讨论与结论
本文的Aspergillus sp. P90r菌产人参皂苷Rb3糖基水解酶活力,在相同条件下比文献中的Absidia sp. GRB3-X8r菌产酶活力高15%~25%;本文Aspergillus sp. P90r菌所产酶蛋白的比活力为169 U·mg-1,对人参皂苷Rb3的糖基具有较好的水解活力;SDS-PAGE电泳测得分子量约为65.6 ku,接近于Absidia sp. GRB3-X8r菌酶分子量66.7 ku。该酶在pH5.0的偏酸性环境下酶活力很高,在接近中性环境以及碱性环境下酶活力迅速下降,在pH值8.0及以上完全没有酶活性。最适反应条件是pH=3.0~5.0、45 ℃,在pH=4.0~6.0范围内相对稳定。该酶在20 min时进入混合级反应,反应米氏常数Km值为8.77 mmol·L-1,Vmax为57.44 mmol·L-1·h-1;在60 min时反应速度达到最大,Vmax趋于稳定,为66.63 mmol·L-1·h-1。上述研究成果,为酶转化三七茎叶皂苷制备稀有人参皂苷提供了理论基础。
该酶先水解人参皂苷Rb3的20-O-木糖基变为人参皂苷Rd,进一步水解人参皂苷Rd的3-O-葡萄糖基变为人参皂苷F2,再进一步水解人参皂苷F2的3-O-葡萄糖基变为最终产物C-K。对于葡萄糖苷酶对多种糖基具有水解作用的研究,Larsbrink et al.(2014)在研究Bacteroides ovatus中木葡聚糖分解代谢相关的酶基因时发现,其中BoGH31A在切除α(1→6)-木糖基后允许水解β-葡萄糖基和β-半乳糖基;Opassiri et al.(2004)从水稻(Oryza sativa)中克隆得到bglu1基因,其表达产物β-葡萄糖苷酶不仅能水解一些天然的葡萄糖苷,也能水解对硝基苯基β-岩藻糖苷、β-半乳糖苷和β-木糖苷,另外他们也克隆得到os4bglu12基因,其表达产物同样也具有水解多种糖基的特性,对β-葡萄糖苷、β-半乳糖苷、β-甘露糖苷、β-木糖苷和a-阿拉伯糖苷都有水解作用(Opassiri et al., 2006);Tsukada et al.(2006)从Phanerochaete chrysosporium中克隆了糖基水解酶家族1中的两个β-葡萄糖苷酶BGL1A和BGL1B,其中BGL1B对β-葡萄糖苷和β-半乳糖苷都有降解作用。上述研究中发现的β-葡萄糖酶都归属为酶学数据库内EC.3.2.1.21酶类,都属于GH1家族,且该家族中能水解多种糖基的糖苷酶种类也较多。本文中Aspergillus sp. P90r菌所产人参皂苷糖基水解酶也具有水解人参皂苷Rb3木糖基和葡萄糖基的特性,认为此糖苷酶应归属于GH1家族。
参考文献:
CHEN JJ, SUN J, JIN FX, et al., 2011. Characterization of ginsenoside-glyosidase from Absidia sp. G8r [J]. J Dalian Polytech Univ, 30(1): 13-17. [陳娇娇, 孙键, 金凤燮, 等, 2011. G8r菌产人参皂苷糖苷酶的酶性质及酶水解作用 [J]. 大连工业大学学报, 30(1):13-17.]
HAN SX, YOU Y, 2016. Balance between cardiovascular pharmacological and hemolytic effects of saponins of Panax notogenseng [J]. Chin J Chin Mat Med, 41(5): 818-822. [韩淑娴, 游云, 2016三七总皂苷心脑血管药理作用及其溶血反应 [J]. 中国中药杂志, 41(5):818-822.]
JIA L, ZHAO Y, LIANG XJ, 2009. Current evaluation of the millennium phytomedicine—ginseng(Ⅱ): Collected chemical entities, modern pharmacology, and clinical applications emanated from traditional Chinese medicine [J]. Curr Med Chem, 16(22): 2922-2942.
JIN FX, 2009. Biotransformation of natural products [M]. Beijing: Chemical Industry Publishing House:74-75. [金凤燮, 2009. 天然产物生物转化 [M]. 北京: 化学工业出版社:74-75.]
JIN FX, YU HS, FU YY, et al., 2012. Biotransformation of Ginsenosides(Ginseng Saponins) [J]. Glob Sci Books, 6: 33-44.
JU NX, SUN J, 2014. Advances in pharmacological effects of Panax notoginseng [J]. J N Pharm, 11: 90-91. [居乃香, 孙静, 2014. 三七药理作用的研究进展 [J]. 北方药学, 11:90-91.]
KIM JH, YI YS, KIM MY, et al., 2017. Role of ginsenosides, the main active components of Panax ginseng, in inflammatory responses and diseases [J]. J Gins Res, 41(8):435-443.
LARSBRINK J,ROGERS ET, HEMSWORTH RG, et al., 2014. A discrete genetic locus confers xyloglucan metabolism in select human gut Bacteroidetes [J]. Nature, 506(7489): 498-502.
LI JW, 1997. Principles and methods of biochemical experiments [M]. Beijing: Peking University Publishing House: 216-223. [李建武, 1997. 生物化学实验原理和方法 [M]. 北京:北京大学出版社: 216-223.]
LIU CY, JIN YH, YU HS, et al., 2014. Biotransformation pathway and kinetics of ginsenosidase type I hydrolyzing 3-O- and 20-O-multi-glucosides of PPD type ginsenosides [J]. Proc Biochem, 49: 813-820.
LIU CY, ZUO KZ, YU HS, et al., 2015. Preparation of minor ginsenosides C-Mx and C-K from notoginsengleaf ginsenosides by a special ginsenosidase type-I [J]. Proc Biochem, 50: 2158-2167.
MAO LJ, CAI XL, LIAO ZZ, 2017. Pharmacological mechanism of Panax notoginseng saponins on nervous system diseases [J]. Contemp Med Forum, 15(15): 48-49. [毛柳珺, 蔡小玲, 廖曾珍, 2017. 三七總皂苷对神经系统疾病药理作用机制的研究 [J]. 当代医药论丛, 15(15):48-49.]
OPASSIRI R, HUA YL, WARA-ASWAPATI O, et al., 2004. β-Glucosidase, exo-β-glucanase and pyridoxine transglucosylase activities of rice BGlu1 [J]. Biochem J, 379: 125-131.
OPASSIRI R, POMTHONG B, ONKOKSOONG T, et al., 2006. Analysis of rice glycosyl hydrolase family 1 and expression of Os4bglu1 2β-glucosidase [J]. BMC Plant Biol, 6: 33.
QI W, HE ZM, HE MX, 2005. Mechanism and kinetic model of enzymatic yydrolysis of protein [J]. J Tianjin Univ, 38(9): 768-773. [齐崴, 何志敏, 何明霞, 2005. 蛋白质酶促水解反应机理与动力学模型 [J]. 天津大学学报, 38(9):768-773.]
QI W, HE ZM, SHI DQ, 2001. Enzymatic hydrolysis of casein to phospopeptides Ⅱ. Hydrolys ate analysis and kinetic model [J]. Food Sci, 22(8): 37-40. [齐崴, 何志敏, 史德青, 2001. 酪蛋白质酶制备酪蛋白磷酸肽研究Ⅱ. 产物分析及反应动力学模型 [J]. 食品科学, 22(8):37-40.]
SHI LH, ZHU S, LOU ZX, et al., 2012. Study on extraction of cod skin collagen and reaction kinetics [J]. Sci Technol Food Ind, 33(9): 153-162. [史劉辉, 朱松, 娄在祥, 等, 2012. 鳕鱼皮活性胶原的提取及酶解动力学研究 [J]. 食品工业科技, 33(9):153-162.]
SONG YH, JIANG XJ, 2009. Study on extraction technology of ginsenosides [J]. Heilongjiang Sci Technol Inform, 31: 240. [宋亚会, 姜晓军, 2009. 人参皂苷提取工艺研究 [J]. 黑龙江科技信息, 31:240.]
TSUKADA T, IGARASHI K, YOSHIDA M, et al., 2006. Molecular cloning and characterization of two intracellular β-glucosidases belonging to glycoside hydrolase family 1 from the basidiomycete Phanerochaete chrysosporium [J]. Appl Microbiol Biotechnol, 73(4): 807-814.
WU HJ, LIU YN, 2008. Ginsenoside Rg1 inhibits apoptosis of myocardial cells induced by 60Co irradiation [J]. Med Rev, 14: 3332-3334. [吴红金, 刘宇娜, 2008.人参皂苷Rg1抑制60Co照射诱导心肌细胞凋亡 [J]. 医学综述, 14: 3332-3334.]
ZHANG HX, HUANG X, YAN CN, et al., 2006. Study on the dynamics of enzymatic reaction by fluorescence method [J]. Chem Bioengin, 23(3): 4-6. [张华新, 黄星, 颜承农, 等, 2006. 酶催化反应动力学的荧光法研究进展 [J]. 化学与生物工程, 23(3):4-6.]
ZHANG YX, CHEN XY, ZHAO WQ, et al., 2008. Advances in studies on biotransformation of ginsenosides [J]. J Shen-yang Pharm Univ, 25(5): 419-422. [张怡轩, 陈晓莹, 赵文倩, 等, 2008. 人参皂苷生物转化的研究进展 [J]. 沈阳药科大学学报, 25(5):419-422.]
ZHAO XP, XU LQ, SONG JG, et al., 2018. Purification and enzymatic properties of ginsenoside Rb3 Xylidase [J]. Sci Technol Food Ind, 17: 112-117. [赵信平, 徐龙权, 宋建国, 等, 2018. 人参皂苷Rb3木糖苷酶的纯化及其酶学性质 [J]. 食品工业科技, 17:112-117.]
(责任编辑 何永艳)
