PMA/EMA-LAMP法应用于VBNC状态活菌检测的研究进展
2020-07-02冯雪王冠蕾侯俊材
冯雪,王冠蕾,侯俊材
(1.东北农业大学乳品科学教育部重点实验室, 哈尔滨150030;2. 承德石油高等专科学校, 河北承德067000)
0 引 言
作为全球关注的食品安全问题,食源性致病菌在过去几十年对公众健康造成了重大威胁。而且世界卫生组织的调查表明,食源性致病菌的毒力感染呈上升趋势[1]。活的不可培养(viable but non-culture, VBNC)状态是细菌对抗恶劣环境的独特生存策略。VBNC 状态的细菌不能在异养板上生长,但仍具有代谢活性、致病性和毒性。VBNC 状态的细菌在适宜的条件下能够恢复和恢复培养和致病性。VBNC 状态下食源性病原体的出现促进了食源性感染的发生[2],且使检测变得更加困难。因此,本文概述了VBNC 的特点和基于LAMP 的方法检测VBNC,以期为检测VBNC 的方法更新提供理论参考。
1 VBNC 细菌概述
1982 年,徐怀恕等人[3]对霍乱弧菌和大肠杆菌进行观察研究时,首次发现并且提出关于细菌的“有活力但不可培养(Viable but non-culturable, VBNC)”状态。细菌在处在不适宜的环境条件下,其细胞就会在形态和生理上发生变化,不再进行分裂,导致在常规培养基上不能形成菌落,但是细胞仍然保持完整的结构和代谢活性。许多专家认为VBNC 状态是某些不产生芽胞的革兰氏阳性(G+)细菌和多种革兰氏阴性(G-)细菌的抗逆反应,这种状态能够帮助细菌度过逆境;也有一些专家认为VBNC 状态只是细菌生命循环的一个过程。
乳及乳制品含有丰富营养物质,能够满足人体对多种营养元素的需要,因此它也是大部分食源性致病菌的天然培养基[4]。部分乳制品在巴氏杀菌过程中能够杀死绝大部分食源性致病菌,同时乳制品的酸性条件也可以有效地抑制致病菌的生长和增殖[5]。但是,目前越来越多的研究成果表明,乳及乳制品中的致病菌能够被诱导,然后进入VBNC,它们保留毒力,在适当的条件下会复苏,仍具有活力。2002 年,Gunasekera等人[6]的研究结果表明,经过巴氏杀菌的鲜乳中明显含有细胞亚群进入VNBC,热处理过程中大量的细胞不能够形成菌落,但仍然可以转录翻译,具有可以测量的代谢活性,并具有致病性。1996 年,Gahan 等人[7]对单增李斯特菌在酸奶、普通奶酪、低脂奶酪以及全脂奶酪中的耐酸性研究发现,70 d 后,低脂奶酪和全脂奶酪中的单增李斯特菌突变体ATM56 恢复活性,研究结果表明单增李斯特菌在乳及乳制品中存在VBNC 状态,但是其诱导和复苏因素需要进一步研究。VBNC 状态下的细胞复苏能力、代谢活性、平板培养能力和细胞完整性区别其它几种常见的细胞状态,具体区别如表1所示[1]。
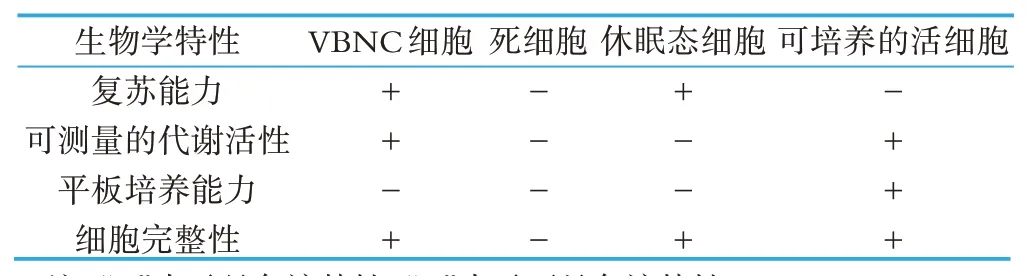
表1 不同状态细胞的不同生物学特性的比较
迄今为止,已有85 种以上的细菌被诱导进入VBNC 状态,包括大肠杆菌、李斯特菌、沙门氏菌、痢疾志贺氏菌、创伤弧菌和乳酸杆菌[8]。Diane 和Nystrom[9]的研究表明VBNC 状态是非芽孢细菌对抗不利环境(暴露于极端温度、紫外线光休克、重金属、低pH、缺乏营养和氧化应激)的适应性策略。细胞在VBNC 状态下维持代谢活性。进入VBNC 状态后,细胞在保持其代谢活性的同时不受损伤,其诱导机制与孢子形成相似。目前,食源性细菌通常由实验室采用标准培养方法进行监测和鉴定,包括预富集和选择性富集,然后进行一系列形态学和生化鉴定,通常4~7 d才能获得鉴定结果[10]。VBNC 状态下的细菌不能在常规平板培养基上定植,传统的食源性致病菌检测方法复杂、耗时长,已不适用于VBNC 状态下的细胞检测,在食品质量和食源性致病菌的监测中,迫切需要有效的方法[11]。
2 VBNC 细菌形成机制
近年来,人们对VBNC 状态的形成机理逐渐了解。2011 年,Moorhead 等[12]人发现空肠弯曲杆菌(Campylobacter jejuni)对群体感应(Quorum sensing,QS)信号分子 C4-HSL、OH-C4-HSL、HSL 和 C12-HSL等有反应,具体表现为延缓进入VBNC 状态以及阻碍生物膜的形成,此菌株自身同样分泌一种新的化合物,其结构功能与QS 信号分子相似,所以QS、VBNC状态及生物膜的形成的调节机制可能相似。2014 年,这一推测被Ayrapetyan 等[13]人进一步证实,他们发现创伤弧菌(V.vulnificus)在VBNC 状态下可直接被其QS信号分子AI-2 唤醒,并证明不产生AI-2 的突变菌株不能从VBNC 状态复苏,添加外源AI-2 后可以复苏,但是此复苏过程不仅与信号分子AI-2 相关,可能还与σ 因子Rpo S 相关,缺失Rpo S 的突变株不能复苏,并且加入外源AI-2 后仍然不能复苏。这一结果与2013年Kusumoto等[14]人的研究相一致,发现鼠伤寒沙门氏菌(S.enterica)的LT2 VBNC 突变体具有较高的Rpo S 表达能力,具体表现为延缓进入VBNC 状态,从而推测Rpo S对VBNC 状态具有调控作用。
另一方面,无机聚磷酸盐的代谢对细胞的功能具有重要的调节作用[15]。有学者发现,调节无机磷酸盐代谢的聚磷酸盐激酶能够促使细菌进入VBNC 状态[16-17]。并且有明确的证据指出,无机磷酸盐及其同源酶同时存在于许多细菌体内,说明了在细菌体内,无机磷酸盐的代谢可能普遍存在。而这些细菌中的大部分都具有进入VBNC 状态的能力[18],这就大大增加了无机磷酸盐代谢参与VBNC 状态调节的可能性。但是目前为止,有关无机磷酸盐对细菌进入VBNC 状态调节用的机理,触发和复苏等问题仍不清楚,需进一步研究。
3 LAMP法概述
2000 年,Notomi等人[19]首次报道了一种新的检测方法—环介导等温核酸扩增(loop-mediated isothermal amplification, LAMP)。LAMP 采用了具有长链置换活性的Bst DNA 聚合酶和4-6 条引物,以高特异性识别目标序列的6 个不同区域,并具有独特的扩增机制,其产物在琼脂糖凝胶电泳上能够呈现出典型的阶梯状条带;同时,反应体系中的Mg2+与从dNTPs中析出的P2O74-结合,生成副产物白色Mg2P2O7沉淀;另外,因为扩增产物的大量生成,加入荧光染料后,紫外灯下能够观察到明显荧光。所以,LAMP 扩增不但观察结果方式多样,且结果鉴定操作简便,对于高通量的快速检测极为适合。因为LAMP技术具有快速、灵敏、特异等优点[20],已经逐渐被应用于中沙门氏菌、阪崎肠杆菌、分支杆菌属、金黄色葡萄球菌等病原微生物的检测[21-24]。然而,LAMP法仍然存在一些缺点,例如,PCR或LAMP本身无法区分存活的死细胞和VBNC细胞的存在,导致对目标微生物的高估。为了克服这个缺点,PCR 和LAMP 结合活性染料直接检测活的食源性病原体[25]。近年来,人们利用DNA 插层剂来阻止死亡细菌的DNA 扩增,乙锭单叠氮化合物(ethidium monoazide bromide,EMA)或 叠氮 溴 化 丙 锭(propidium monoazide,PMA)染料能穿透膜损伤细胞并与DNA分子结合,从而抑制死细胞的DNA 扩增,同时允许活细胞的未结合DNA 扩增,因此,将这些染料与PCR 或LAMP结合,来区分VBNC细胞与死细胞[26-27]。
4 LAMP的原理
LAMP 技术主要应用的原理为链的置换[28],如图1所示,恒温条件下通过Bst 2.0 DNA 聚合酶催化反应的进行。LAMP 扩增反应分为两步进行,即哑铃状模板形成的起始步骤和反应扩增的循环步骤。反应过程包含内外部两种引物,内部引物由FIP(Forward Inner Priner)和 BIP(Backgroud Inner Priner)组成,其中FIP 包括 F1c 和 F2,BIP 包括 B1c 和 B2,外部引物由 F3和B3组成。
哑铃状模板形成的起始步骤中,经过LAMP 循环后,每条链的末端会形成发夹状的DNA 即为起始结构。FIP上的F2与其互补序列F2c结合形成双链,通过Bst2.0 DNA 聚合酶的催化作用,DNA 扩增自 F2 的 5’末端开始,形成一条新的DNA单链与其模板链结合后形成新的DNA 双链。以外部引物F3为起始的新链与其模板链结合形成双链,原合成的DNA单链被置换下来,在5’末端的F1和F1c两个区域内进行碱基配对,从而产生发夹结构。BIP上的B2与互补序列B2c相结合从而形成新链,然后与其模板互补配对形成新的DNA双链,与此同时,5’端的环状结构打开,外部引物上的B3与B3c杂交,并以其为起点开始合成新链,以BIP起始的单链解离下来形成新的单链,其两个末端分别为FIP 和BIP。由于两个末端发生碱基互补配对,所以两个发夹结构,这就是LAMP的基础结构。
在反应的扩增循环步骤中,发夹结构中的F1 末端作为起点,模板是其自身,进行DNA 的扩增延伸。同时,FIP 中的F2 与F2c 杂交,新一轮的置换反应开始。F1 末端的合成单链脱离模板解离为单链。而解离后的单链核酸存在互补结构从而导致环状结构的形成。环状结构上形成的B2c,与BIP 的引物杂交,开始新一轮扩增反应。LAMP 的反应产物为类似花状的环结构和双链发夹结构。

图1 LAMP技术反应原理
5 PMA/EMA-LAMP 在 VBNC 状态细菌检测中的应用
PMA 和EMA 作为一种 DNA 分子核酸染料,只能渗透死亡细菌的细胞壁或细胞膜,并与其中的DNA 共价结合,阻碍其扩增反应的发生。PMA/EMA-LAMP 利用优化的引物,探索了VBNC 状态下3 种食源性致病菌不同组分的水平和比例[29]。PMA/EMA-LAMP的详细设计如下。
首先,用一定浓度的PMA 或EMA 原液处理0.1 mL 达到107CFU 的细胞悬液,然后立即移入暗室(室温下)静置5 min,然后将其置于碎冰中,在15 cm的距离处暴露于卤素灯(500 W)15 min。根据常用的基因组DNA 提取试剂盒的指示,对VBNC 和死亡细胞进行总DNA 提取,然后进行前面描述的LAMP 反应。最后,通过变色、浊度、琼脂糖凝胶分析和实时荧光分析,验证了该方法的可行性。
5.1 大肠杆菌
大肠杆菌(Escherichia coli)作为环境中最常见的革兰氏阴性菌之一,引起人类严重的胃肠道疾病,如出血性腹泻、出血性结肠炎和溶血性尿毒症综合征,儿童和老年人死亡率高达50%以上[30]。此外,大肠杆菌中VBNC 态的诱导条件(紫外线或低温)也给消除过程带来了障碍。VBNC 状态下的细胞在培养过程中可能出现阴性结果,影响实验结果。
2014 年,Wang 等人[31]用 PMA 或 EMA 进行 VBNC状态细胞与死亡细胞的分化。以大肠杆菌中特定的 rfbE 基因为靶点,采用PMA-qPCR 法对VBNC 状态下的细胞进行定量分析。该方法的定量限为102mL-1,但PMA-PCR 检测时间长、检测限低、成本高等缺点给其进一步应用带来了很大的障碍。有研究学者采用了rBE 基因,以及主要毒素基因(STX1 和STX2)基因,并分别从快速检测VBNC 状态中开发出三个PMA-LAMP 检测。研究表明,PMA 浓度为40 mg/mL 时,LAMP 检测完全被抑制,且比色LAMP 检出限为 10 pg/mL,比 PCR(10 ng/mL)更敏感,特异性和阳性预测值均为100%。
5.2 副溶血性弧菌
副溶血性弧菌(Vibrio Parahemolyticus)作为一种广泛分布于沿海和河口环境中的嗜盐菌,在所有流行的食物中毒暴发中,特别是在生的或未煮熟的海鲜中,有50%~70%被分离为致病因子[32]。副溶血性弧菌是一种革兰氏阴性杆菌,在低温下易被诱导进入VBNC 状态。目前,副溶血性弧菌的常规检测方法需要7 d 的时间。因此,迫切需要快速、准确的检测方法[33]。
大量研究表明[34-35],耐热直接溶血素(tdh)基因作为副溶血性弧菌的特异性标记物,可以使用PMA-PCR 筛查VBNC 状态。然而,很少有研究报道EMA 或PMA 联合LAMP 检测副溶血性弧菌。2012年,Wang[36]开发了一种EMA-LAMP分析法,用于区分副溶血性弧菌的VBNC状态细胞和死亡细胞。值得注意的是,EMA 对VBNC 状态下的副溶血性弧菌DNA扩增没有抑制作用,这与PMA不同。LAMP法和PCR法对模板的敏感性分别为9 fg/管和900 pg/管,说明LAMP 法比 PCR 法更敏感。此外,Zhong[37]等人在2016年开发了一种基于PMA的实时荧光灯分析法,用于检测VBNC状态下的副溶血性弧菌,该方法利用了副溶血性弧菌中的热标记溶血素(tlh)基因。26株中有10株为不同血清型的副溶血性弧菌,非副溶血性弧菌有16株。结果表明,PMA-RF-LAMP在4mg/mL的PMA作用下,再暴露5 min,可用于区分活细胞和死细胞。另一方面,在不受食物基质、死细胞和其他细菌干扰的情况下,对26株参考菌株的特异性为100%。
5.3 葡萄球菌
金黄色葡萄球菌(S.aureus)是一组革兰氏阳性、兼性需氧菌,通常是未被包裹的有机体,可导致多种组织感染和多种疾病[38](包括皮肤感染、肺炎、心内膜炎和骨髓炎)。葡萄球菌肠毒素可引起的葡萄球菌食物中毒,是一种重要的食源性致病菌,是世界上最重要的食源性疾病之一,占食物中毒暴发病例的95%,是世界范围内公共卫生的主要问题。传统的金黄色葡萄球菌培养基检测方法通常需要6 d,可能存在假阴性[39]。同时,在VBNC 状态下,用上述培养基方法检测不到金黄色葡萄球菌。在金黄色葡萄球菌的监测中,建立一种快速、灵敏、经济、操作简便的检测方法,对处于VBNC 状态的金黄色葡萄球菌进行鉴定,并采取相应的预防措施[40]。
目前,已有学者证明可以将LAMP 应用于以nuc基因为靶点的金黄色葡萄球菌分离株的鉴定。然而,nuc 基因作为检测金黄色葡萄球菌的合适靶点的适用性可能需要进一步深入的研究,因为它的敏感性低于PCR。2012 年,Xu[41]等人。首次对耐甲氧西林金黄色葡萄球菌、耐甲氧西林凝固酶阴性葡萄球菌和非葡萄球菌进行了3 种LAMP 鉴别试验的开发和应用。此外,PMA-LAMP 法在VBNC 状态下检测金黄色葡萄球菌方面也取得了显著进展。该方法具有快速、简单(对于过程和结果测定)、成本效益低(等温设备、水浴或热块)、灵敏度高、广泛性和应用灵活性高的显著优点。在不含环引物的情况下,该方法在65 ℃下检测时间为65 min,与传统的培养基检测和PCR 检测相比,缩短了检测时间。
5.4 单增李斯特菌
单增李斯特菌(Listeria monocytogenes)是一种重要的食源性致病菌,也是乳制品、蔬菜和畜禽产品等食品的主要污染菌[42],世界卫生组织已将其列为四大食源性致病菌之一[43],所以,研究者密切关注单增李斯特菌的污染问题。传统的检测方法需要分离、筛选以及生化鉴定等步骤,费时费力,因此,建立快速准确的检测方法具有十分重要的意义。
由于LAMP 技术特异性高、灵敏性强、简便快速的特点,被广泛地应用于检测致病菌的研究中[44],但是LAMP 技术是以DNA 为检测对象,所以此方法不能区分活/死细胞,易出现结果呈假阳性的现象。2011年,蒋亚男等人[45]建立了PMA-LAMP 的分析方法快速检测单增李斯特活菌,同时,比较分析了PMA-PCR 方法的灵敏度。2012 年,吕淑霞等人[46]采用EMA-LAMP 方法,同样可以快速的检测单增李斯特菌。利用PMA/EMA-LAMP 技术,不仅能够有效识别单增李斯特菌的活/死细胞,而且具有较高的灵敏度。同时,PMA/EMA 与LAMP 相结合的技术与PCR 技术、实时荧光 PCR 技术等[47-48]相比,避免使用类似PCR 等昂贵的设备,减少了DNA 热变性、温度循环等步骤,所以其检测成本更低、反应更迅速、操作更简便。
6 展 望
食源性致病菌的VBNC 状态是各种食源性致病菌存在的独特机制,给公众健康带来了严重威胁。采用可靠的检测方法对VBNC 细胞进行简单、灵敏的鉴定是非常重要的。由于VBNC 细胞的活性和不可培养性,给传统的CFU 检测带来了障碍,基于LAMP 的检测方法已逐渐成为鉴定VBNC 状态细胞的可靠工具。虽然表现相同,但PMA 比EMA 更有效地抑制活、死信号。综上所述,PMA/EMA-LAMP 或其他基于LAMP 的方法在人们面临多种传染病威胁的地区研究局部流行病具有很大的潜力。此外,建立了PMA-RF-LAMP 法定量分析细菌的VBNC 状态,拓宽了其应用范围。然而,在扩增反应中还存在一些缺陷和缺陷,如污染和假阳性现象。在今后的工作中,各种技术(PMA/EMA-LAMP 和表面等离子体共振生物传感器)的合作可以开发出简单有效的遗传检测装置,能更有效的检测VBNC 细胞。
