埃塞俄比亚发酵食品中乳酸菌的分离鉴定
2020-07-02郭艳荣党娜苏馨刘文俊孙天松
郭艳荣,党娜,苏馨,刘文俊,孙天松
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,内蒙古自治区乳品生物技术与工程重点实验室,呼和浩特010018)
0 引 言
埃塞俄比亚位于非洲东北部,是中东、非洲及亚洲的“十字路口”,以咖啡贸易著称,有传统手工咖啡制作和传统发酵面食等食品加工技艺。同时,埃塞俄比亚也是非洲最大的蜂蜜生产国,其蜂蜡生产排名世界第四,有多达几百万蜂蜜集群和800 多种蜂蜜资源作物[1]。
蜂蜜酒是酒的一种,蜂蜜中加水稀释,经过发酵生成酒精而制成[2]。蜂蜜中含有极高的糖分,极高的渗透压使微生物难以繁殖,将蜂蜜以水稀释后,糖分的浓度下降,微生物能够在适宜的渗透压下繁殖,开始发酵。蜂蜜酒被认为是人类酿造的第一种酒精饮料,约有1 万年的历史[3]。Mead 是埃塞俄比亚出产的著名蜂蜜酒。它是用当地的蜂蜜制成的,用烟、树叶和 Gesho(Rhamnus Prinoides)的树枝调味,给人一种酒花般的味道[4]。
面引子是传统面食加工中的发酵剂,其中含有多种微生物,包括各类酵母菌及少量细菌,能引发多个生化反应,混合协同发酵产生复杂的风味物质,赋予面食更加细致的质地、细腻的口感和更为丰富的风味[5]。Teff是埃塞俄比亚地区由不同谷物制成的发酵食品,包括高粱,玉米,小麦,大麦等一些谷物的组合[6]。大多数埃塞俄比亚人对Teff 的喜爱程度超过了其他任何食品。它是一种稀薄的软发酵烘焙食品,通常使用来自不同来源的天然发酵剂[7],根据环境温度进行24~96 h的发酵后获得[8-9]。
埃塞俄比亚也是咖啡生长的天然产地,独特的地理环境和气候条件,使得这里的咖啡富有一种葡萄酒的香味,由此酿造的咖啡果酒也深受人们喜爱[10]。
这些传统发酵食品和饮品,使用传统技术经多种原材料制成,独特的加工方式,加之饮食结构和地理位置等的差异,导致发酵产品中乳酸菌的多样性,越来越受到研究人员的关注。而目前,咖啡,蜂蜜酒和面引子中关于酵母菌的报道较为常见[11-13],而对其中的乳酸菌却鲜有报道。本文采用实验室纯培养方法对埃塞俄比亚地区采集的4 份发酵食品中的乳酸菌进行分离纯化,运用16S rRNA 基因序列分析方法对分离株进行鉴定,对埃塞俄比亚地区发酵食品中乳酸菌的多样性进一步分析,以便了解该地区食品中乳酸菌的组成与种类,为丰富传统发酵食品中乳酸菌资源提供菌种。
1 材料与方法
1.1 样品来源
本实验所研究的样品是由中国科学院微生物所研究员惠赠,研究人员于2019 年5 月,在埃塞俄比亚季马,Sekoru 等地区采集,包括咖啡、蜂蜜酒、面引子等共计4 份样品。将采集的样品立即放置在低温保存,及时带回实验室进行乳酸菌的分离纯化等研究。

表1 埃塞俄比亚地区采集样品信息
1.2 培养基与试剂
培养基:MRS 固体培养基和MRS 液体培养基,M17 固体培养基和 M17 液体培养基。MRS、M17 培养基均购自英国Oxoid 公司。
试剂:脱脂乳保护剂,提取DNA 所用试剂,PCR扩增和电泳检测所用试剂。细菌基因组DNA 提取试剂盒,天根生物技术(北京)有限公司。
1.3 仪器与设备
pH 计(FE20),梅特勒-托利多仪器(上海)有限公司;全自动高压干热灭菌器(ADVANTEC SP-650),日本ALP 公司;恒温培养箱(LRH-500F),上海一恒科技有限公司;光学显微镜(BX50),日本OLYMPUS公司;电热恒温水浴锅(HWS28),上海一恒科技公司;梯度基因扩增仪(MJRESEARCH PTC-200),伯乐公司;电泳仪(DYY-12),北京六一生物科技有限公司;凝胶成像分析系统(UVPGDS-8000),UVP 公司;微量紫外分光光度计(ND-1000),Nanodrop公司。
1.4 乳酸菌的计数
乳酸菌计数根据参考文献[13]采用MRS 和M17 培养基法菌落计数法,将样品用PBS 缓冲液进行梯度稀释,然后用倾注法进行计数,37 ℃培养48 h 进行菌落计数,所有样品进行3次重复。
1.5 乳酸菌的分离纯化及保存
蜂蜜酒,咖啡等液体样品中乳酸菌计数方法参考刘红新等人对哈萨克斯坦传统发酵乳制品中乳酸菌多样性的研究,采用涂布培养法[14]。
面引子样品需要先在脱脂乳培养基中进行增菌培养12 h,然后取发酵凝乳的培养基0.5 mL 进行10 倍梯度稀释,倾注培养。厌氧培养48 h 后,菌落形成进行计数,并计算样品活菌数。
采用涂布法对样品进行稀释涂布,37 ℃培养48后,获得样品中的不同菌落,观察并记录菌落形态(颜色、形状、大小、边缘等),挑取特征菌落,于对应的固体培养基上划线2~3 次,直至获得纯培养物。经革兰氏染色,过氧化氢酶触试验,将疑似乳酸菌的纯培养物进行保藏,以待后续试验。
1.6 总DNA 的提取及纯度的检测
将乳酸菌二代纯培养液(2 mL),8 000 r/min 离心1 min,弃上清液,收集离心到的菌体。采用细菌基因组DNA 提取试剂盒提取乳酸菌DNA,并用ND-1000型微量紫外分光光度计对DNA 浓度和纯度进行检测并记录。
1.7 16S rRNA 基因的 PCR 扩增
将浓度偏大的DNA 稀释到100 ng/μL 左右,配制PCR 反应体系,利用梯度基因扩增仪进行16S rRNA扩增和测序。PCR 扩增反应,以提取菌株的基因组DNA 的稀释液为模板,引物为27F(5'-AGAGTTTGATCCTGGCTCAG-3')和 1495R(5'-CTACGGCTACCTTGTTACGA-3')[15]。PCR 反应体系(50 μL)及扩增程序如表2所示。
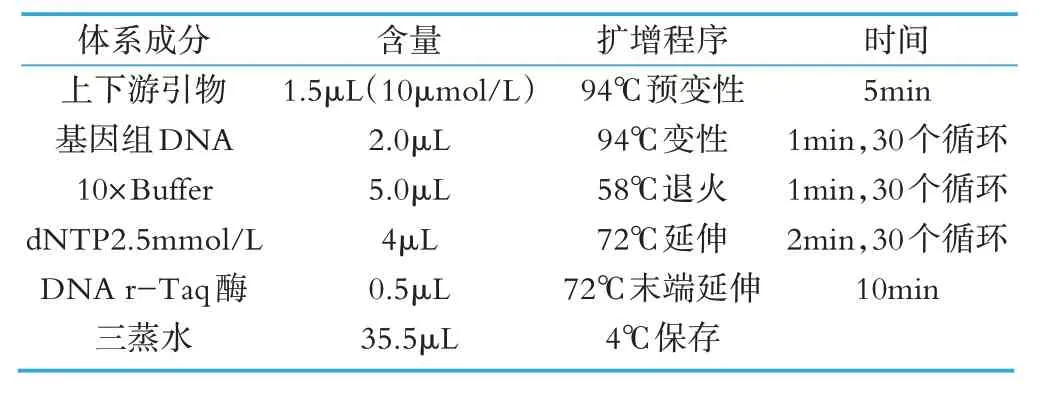
表2 PCR反应体系(50 μL)及扩增程序
扩增完毕后,将PCR 扩增产物用1%的琼脂糖凝胶进行电泳检测,若在1 500 bp 处有清晰明亮的扩增条带,且无拖尾、弥散现象,则PCR 扩增成功[16]。将PCR 扩增产物送往上海美吉生物公司进行纯化和DNA 测序。
1.8 同源性分析
将测序得到的 DNA 序列运用 SeqMan(DNAStar5.01)软件进行序列拼接后,通过Blast 程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)与 Gen Bank数据库中的已知细菌的核酸序列进行同源性比对分析,以同源性大于99%为种的分界阈值,将待鉴定菌株与对应模式菌种的16S rRNA 基因序列用MEGA 6.0建立系统发育树,进行系统发育关系研究。
2 结果与分析
2.1 乳酸菌的计数结果

表3 埃塞俄比亚地区采集样品乳酸菌活菌计数结果
由表3 可知,本次采集样品中两份面引子样品的活菌数相对较高,而蜂蜜酒和咖啡样品中含乳酸菌较少。
2.2 乳酸菌的鉴定
2.2.1 乳酸菌分离株的菌落形态及表型特征
根据乳酸菌的形态学特征[17-18],初步从4 份样品中共分离出55 株疑似乳酸菌的菌株。在MRS 和M17 固体培养基上菌株的菌落呈圆形,中等大小,凸起,乳白色,湿润,边缘整齐,有些菌落表面光滑,有些粗糙。经过革兰氏染色、过氧化氢酶反应,均为革兰氏阳性,过氧化氢阴性菌。初步将55 株菌定为乳酸菌。
2.2.2 菌种DNA 提取和16S rRNA 扩增结果
DNA 浓度和 OD260/280的测定:OD260/280值在 1.8~2.0 间即为纯DNA 样品。将其质量浓度稀释至100 ng/μL 后对乳酸菌分离株16S rRNA 基因进行扩增。经1.0%琼脂糖凝胶电泳检测,可以观察到在大约1 500 bp 的位置处有一条清晰明亮的条带,并且无弥散现象,无明显非特异扩增现象。

图1 部分菌株的16S rDNA PCR扩增产物电泳结果
2.2.3 系统发育树的构建和乳酸菌鉴定结果
将测序获得的16S rRNA 基因序列通过NCBI 数据库中BLAST 进行同源序列比对分析,以与模式菌株序列同源性大于99%为种的鉴定阈值,将55 株分离株鉴定为乳酸菌的3个属,11个种。
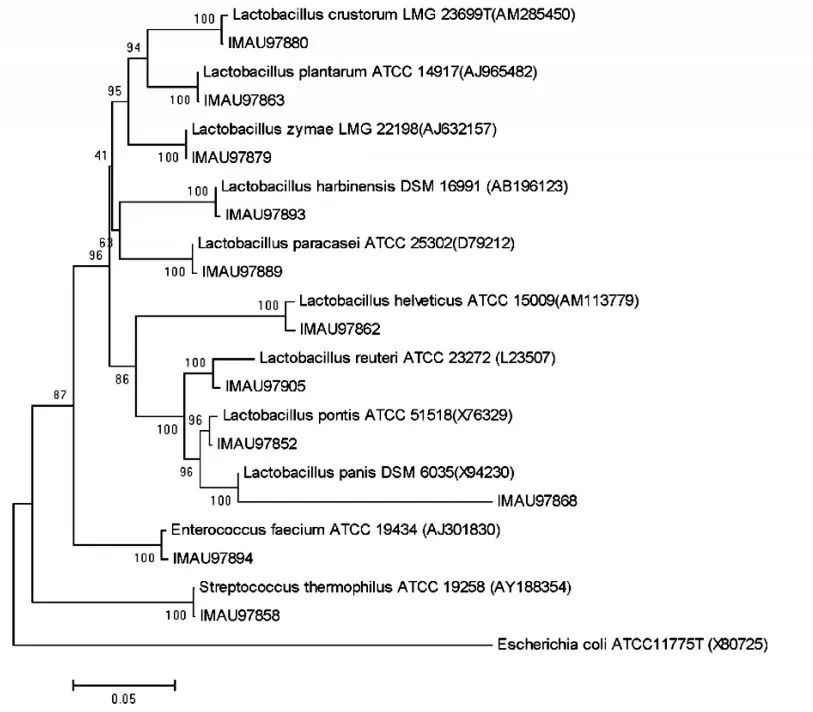
图2 部分菌株的系统发育树
由图2可以看出,IMAU97880与模式菌株Lactobacillus crustorum(AM285450)聚为一类,且同源性为100%,故将其鉴定为Lactobacillus crustorum。菌株IMAU97863与 模 式 菌 株Lactobacillus plantarumATCC14917(AJ965482)聚为一类,且同源性为100%,因此可将其鉴定为Lactobacillus plantarum。菌株IMAU97879 与模式菌株Lactobacillus zymae(AJ632154)聚为一类,且同源性为 100%,故将其归为Lactobacillus zymae。菌株IMAU97858 与模式菌株Streptococcus thermophilusATCC 19258 聚为一类,且同源性为100%,因此可将其归为Streptococcus thermophilus。菌株IMAU97894 与模式菌株Enterococcus faeciumATCC19434(AJ301830)聚为一类,同源性为100%,将其鉴定为Enterococcus faecium。菌株IMAU97893与模式菌株Lactobacillus harbinensis(AB196123)聚为一类,且同源性高达100%,因此可将其归为Lactobacillus harbinensis。菌株菌株IMAU97889与模式菌株Lactobacillus paracaseiATCC25302(D79212)聚为一类,且同源性达到100%,因此鉴定为Lactobacillus paracasei。菌株IMAU97862与模式菌株Lactobacillus helveticus(AM113779)聚为一类,同源性达到100%,故将其归为Lactobacillus helveticus。IMAU97905 与模式菌株Lactobacillus reuteriATCC23272(L23507)聚为一类,且同源性高达100%,故将其鉴定为Lactobacillus reuteri。菌株IMAU97852与模式菌株Lactobacillus pontisATCC51518(X76329)聚为一类,同源性为98%,故将其归为Lactobacillus pontis。IMAU97868 与模式菌株Lactobacillus panis(X94230)聚为一类,且同源性为100%,故将其鉴定为Lactobacillus panis。
2.3 优势菌种分析
乳酸菌的分布结果如表4所示。
埃塞俄比亚地区发酵食品中乳酸菌的分离结果见表4。由表4 可知,4 份发酵食品中分离出的55 株乳酸菌疑似株,经16S rDNA 序列测定和同源性分析鉴定,分属于3 个属11 个种或亚种,Lactobacillus pontis为埃塞俄比亚地区发酵食品中的优势菌种,占总分离株的32%。其中ASE1 蜂蜜酒样品共分离出16 株乳酸菌,Lactobacillus paracasei为优势菌种,占 ASE1 样品总分离数的75%。ASE2 咖啡果酒样品仅分离出2 株乳酸菌,均为Lactobacillus reuteri。ASE3、ASE4 两份面引子样品共分离出37 株乳酸菌,均含有Lactobacillus pontis和Lactobacillus helveticus,但优势菌种不同,ASE3 样品的优势菌种为Lactobacillus pontis,占ASE3 样品总分离数的78%,而ASE4 样品的优势菌种为Lactobacillus zymae,占ASE4样品总分离数的55%。

表4 埃塞俄比亚地区发酵食品中乳酸菌的分离结果
如表5 所示,为不同研究人员对3 种发酵食品中乳酸菌的分离鉴定结果对比,我们发现,不同地区蜂蜜酒中所含的微生物不同,Bulgasem 等人对马来西亚等地区中蜂蜜的分离鉴定表明蜂蜜中重要含有乳杆菌属和片球菌属乳酸菌[19],Snowdon 等人的研究则在蜂蜜中发现了芽孢杆菌,肠球菌和产黄菌属(Flavobacterium)乳酸菌[20],而我们从埃塞俄比亚地区蜂蜜酒中分离到了乳杆菌属及肠球菌属乳酸菌。咖啡中乳酸菌相对较少,Bruyne 等人从咖啡中分离到1 株Leuconostoc holzapfeliisp. nov[21],本研究中也仅分离到2 株罗伊氏乳杆菌。我们也对比了同为埃塞俄比亚地区的面引子中乳酸菌的分离情况,发现GASHE 等人分离的TEF 面引子样品中优势菌株为乳杆菌属[22],Tilahun等人的分离鉴定结果则表明肠球菌属是优势菌株[23],而我们对2 份面引子的研究结果也表明乳杆菌属是优势菌株。
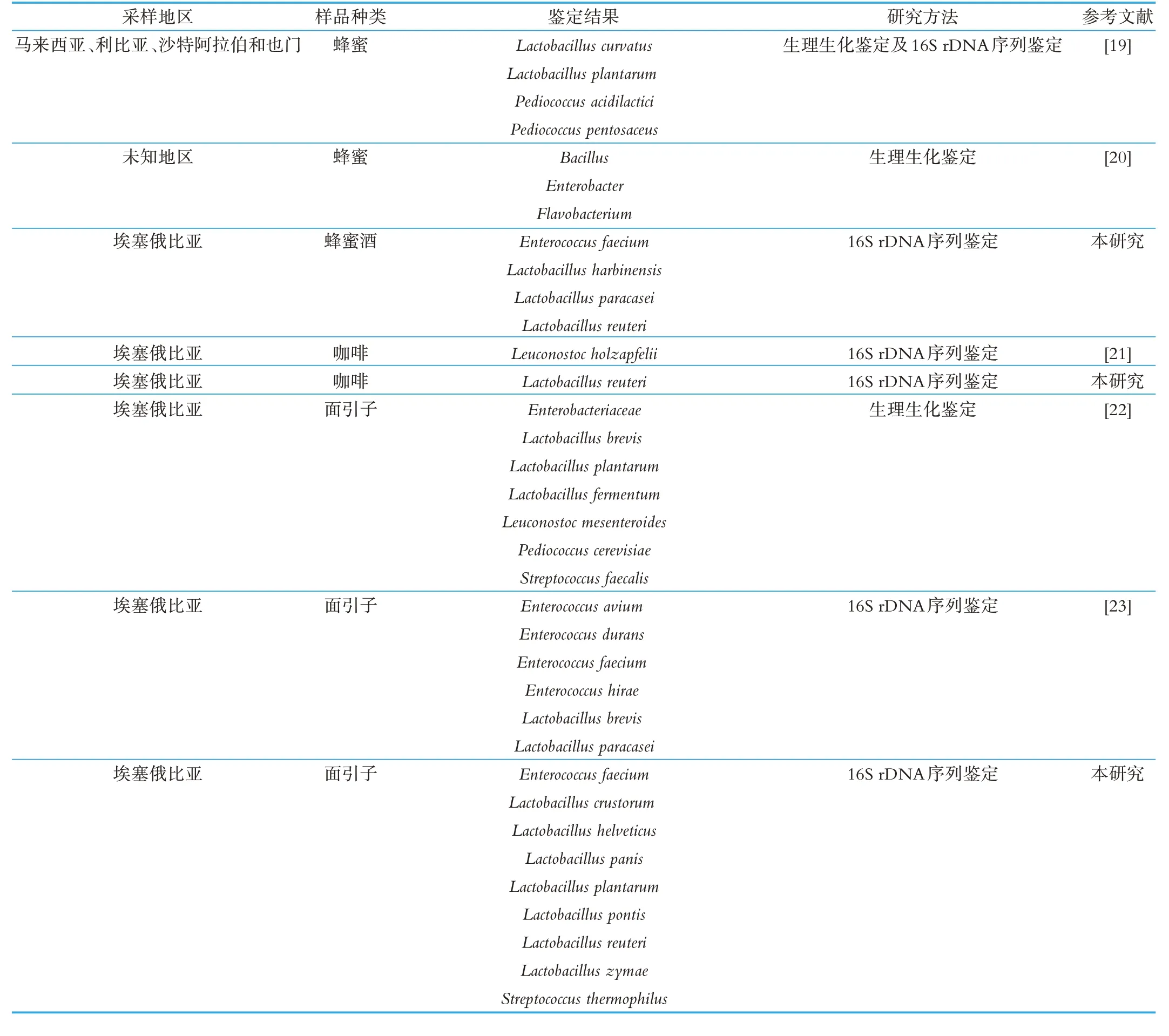
表5 不同地区3种传统发酵食品中乳酸菌的菌群结果比较
3 结 论
从埃塞俄比亚地区采集的4份传统发酵食品样品中乳酸菌活菌数为 1.7×101~1.25×104CFU/mL,乳酸菌含量均较低。4份乳样品中共分出55株菌,经鉴定分别归属 于Lactobacillus pontis、Lactobacillus paracasei、Lactobacillus zymae、Lactobacillus reuteri、Lactobacillus panis、Enterococcus faecium、Lactobacillus helveticus、Lactobacillus harbinensis、Streptococcus thermophilus、Lactobacillus plantarum、Lactobacillus crustorum11 个种或亚种。其中Lactobacillus paracasei为埃塞俄比亚地区蜂蜜酒中的优势菌株,占该样品总分离株的75%,Lactobacillus pontis为该地区面引子中的优势菌种,占该样品总分离株的41%。
