表达猪瘟病毒E0-E2 蛋白的重组腺病毒疫苗免疫效力研究
2020-07-02梁易晓王志鹏杨玉艾范根成孙永科
梁易晓,张 会,王志鹏,杨玉艾,范根成,孙永科*,张 恒,*
(1. 云南农业大学 动物医学院,云南 昆明 650210;2. 青岛易邦生物工程有限公司动物基因工程疫苗国家重点实验室,山东 青岛 266114;3. 青岛韦力国际集团,山东 青岛 266000)
猪瘟(Classical swine fever,CSF)是由CSF 病毒(CSFV)引起的一种急性、热性和高度接触传染的病毒性传染病[1],其主要特征表现为发病急、高热稽留和细小血管变性,引发全身泛发型小点出血,脾梗死,给中国及世界养猪业造成了巨大的经济损失[2]。目前,疫苗接种仍然是预防猪瘟的有效途径之一,但猪瘟感染的症状逐渐趋向于慢性、隐性等非典型性流行形式,因此研制安全、有效的疫苗以控制猪瘟的流行势在必行。
随着分子生物学技术的发展,逆转录病毒、腺病毒及痘苗病毒等已成为现如今研制活载体疫苗较为成熟的病毒载体。其中,腺病毒载体以其安全、高效、宿主范围广、转移和表达外源基因能力强的特点,成为继逆转录病毒载体后在基因治疗、基因免疫等方面应用开发得较早的一种病毒载体[3]。特别是复制缺陷型腺病毒载体已经发展到了第三代,由于缺失了病毒非必要基因区(E1/E3),使得能够携带大片段的外源基因,并且只能够在特定的细胞系中繁殖。另外, 该载体系统还引入了CMV 启动子,使得外源基因可以高水平的表达[4]。
目前已经确定的CSFV 结构蛋白有5 种,即Npro、C、E0(Erns)、E1 和E2。其中E0 和E2 是病毒诱导机体产生中和抗体的两个主要保护性抗原,同时也是病毒吸附、进入敏感细胞的必需蛋白[5]。CSFV 的宿主嗜性与E0 有关,用E0 中和单克隆抗体可有效阻断CSFV 对易感动物细胞的感染[6]。在体外E2 可诱导产生病毒的中和抗体,体内可诱导抗CSFV的保护免疫,保护猪抵抗致死量CSFV 的攻击[7]。另外,E0 和E2 嵌合抗原能明显提高血清学诊断的敏感性,并且比单独使用E2 抗原提前7 日检测到猪瘟病毒的感染[8]。
本实验室前期研究发现E0,E2 基因的重组腺病毒活载体疫苗具有良好的免疫保护效果[9-10]。本研究对前期构建的活载体疫苗(rAd-E0-E2 株)[11]的免疫效力进行研究,以确定其最小免疫剂量及免疫期,为该疫苗后续的应用研究提供参考依据。
1 材料与方法
1.1 主要实验材料 表达猪瘟病毒E0-E2蛋白的重组腺病毒疫苗(rAd-E0-E2 株),简称“活载体疫苗(rAd-E0-E2 株)”,每头份病毒含量为1.58×107.0IFU[12],由青岛易邦生物工程有限公司研发中心冻干保存;猪瘟活疫苗(脾淋源,C 株),简称“C 株”,由青岛易邦生物工程有限公司冻干苗车间生产;攻毒用猪瘟病毒石门系(CVCC AV1411)血毒(F115 代),≥105.0MLD,购自中国兽医微生物保藏中心(CVCC),由青岛易邦生物工程有限公司复壮、鉴定、保存和提供;猪瘟病毒ELISA 抗体检测试剂盒购自IDEXX 公司。
45~55 日龄健康易感仔猪(猪瘟病毒ELISA 抗体均阴性,猪瘟病毒、PCV2、猪繁殖与呼吸综合征病毒均阴性)40 头,由青岛易邦生物工程有限公司自繁自养备用。
1.2 试验分组及设计 试验设计见表1,攻毒方式为颈部肌肉注射猪瘟病毒石门系血毒1.0 mL(病毒含量不低于105.0MLD)。
1.3 猪瘟病毒抗体检测 1~5 组试验猪于免疫后7 d、14 d前腔静脉采血,分离血清;6~8组试验猪于免疫后7 d、14 d、21 d,30 d、60 d、90 d、120 d、150 d、180 d、210 d前腔静脉采血,收集血清。利用猪瘟病毒ELISA抗体检测试剂盒检测各组猪瘟病毒抗体。
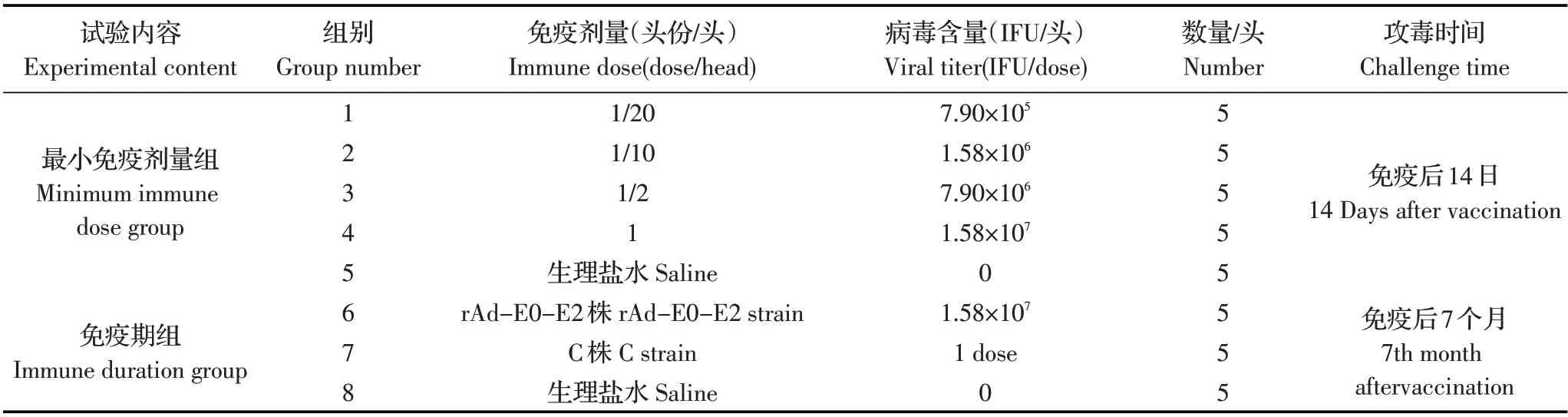
表1 试验设计Table 1 Experimental design
1.4 攻毒后体温监测 所有试验动物于攻毒前2 日至攻毒后16 日,每日定时测温1 次,记录并统计温度变化。
1.5 临床症状及剖检 所有试验动物于攻毒前2 d至攻毒后16 d,每日定时观察猪的精神、采食、饮水、粪便和发病情况;攻毒后16 d 剖检所有存活试验猪,观察组织病变,记录并统计攻毒保护率。
2 结 果
2.1 CSFV 抗体检测结果
2.1.1 最小免疫剂量抗体检测结果 1~4 组分别免疫不同剂量活载体疫苗(rAd-E0-E2 株)后7 d、14 d收集血清,检测猪瘟病毒ELISA 抗体,结果显示,1 组猪免疫后14 d 的抗体平均阻断率为15.5%,0/5抗体为阳性;2 组猪免疫后14 d 的抗体平均阻断率为35.3%,1/5 抗体为阳性;3 组猪免疫后14 d 的抗体平均阻断率为45.8%,5/5 抗体为阳性;4 组猪免疫后14 d 的抗体平均阻断率为51.0%,5/5 抗体为阳性;5 组阴性对照组猪免疫后14 d 的抗体阻断率均≤16.4%,0/5 抗体为阳性。1/10 头份的活载体疫苗(rAd-E0-E2 株)免疫猪后14 d 抗体水平就接近阳性,1/2 头份以上的活载体疫苗(rAd-E0-E2 株)免疫猪后14 d 猪瘟抗体水平全部转为阳性(图1)。表明该疫苗免疫效果较好,最小免疫剂量为1/10 头份。
2.1.2 免疫期抗体检测结果 6组实验猪使用1头份活载体疫苗(rAd-E0-E2 株)免疫后不同时间点采血,分离血清,ELISA 测定血清中猪瘟病毒抗体。结果显示,免疫后14 d抗体全部转阳,抗体至少持续至免疫后7个月;7组猪接种1头份C株,免疫后14 d有4/5抗体出现为阳性,随后抗体稍下降为可疑水平,之后抗体逐渐全部转为阳性;阴性对照组抗体阻断率至试验结束一直为阴性(图2)。表明,1 头份活载体疫苗(rAd-E0-E2 株)免疫猪,抗体水平能持续至少为7 个月,且抗体水平高于同期1头份C株免疫的抗体水平。

图1 不同剂量的活载体疫苗(rAd-E0-E2 株)免疫猪后抗体平均阻断率变化规律Fig.1 Blocking rate of antibodies from pig immunized with different doses of live carrier vaccine(rAd-E0-E2 strain)

图2 活载体疫苗(rAd-E0-E2 株)免疫猪后抗体水平变化Fig.2 Dynamic changes of antibody levels in piglets after immunization with live vector vaccine(rAd-E0-E2 strain)
2.2 最小免疫剂量组攻毒后体温变化、临床症状及其保护结果
2.2.1 最小免疫剂量组攻毒后体温变化 1 组4/5 于攻毒后2 d 体温升高超过40 ℃,1/5 至攻毒后16 d 没有出现高热稽留;2 组、3 组、4 组攻毒后体温正常,无发热现象;5 组对照组于攻毒后2 d~3 d 均体温升高,出现高热稽留。即用1/10 头份及以上的活载体疫苗(rAd-E0-E2 株)免疫14 d 后攻毒,没有出现猪瘟的典型发热现象(图3)。表明,免疫1/10 头份的活载体疫苗(rAd-E0-E2株)就对猪具有保护作用。

图3 不同剂量的活载体疫苗(rAd-E0-E2 株)免疫猪后攻毒体温变化Fig.3 Dynamic changes of body temperature in challenged piglets immunized with different doses of live vector vaccine(rAd-E0-E2 strain)
2.2.2 最小免疫剂量组攻毒后临床症状与剖检结果
1 组攻毒后4/5 出现高热稽留,眼结膜发炎,精神沉郁,食欲下降并且出现便秘或腹泻,解剖可见这4头猪出现脾脏肿大,边缘有梗死;肾脏有大小不一弥散性出血点;心脏出现针尖状出血点;喉头有出血点和淤血;膀胱内壁有出血点等组织器官病变;2组、3组、4组攻毒后无临床症状,剖检组织无病变;5组阴性对照组攻毒后5/5出现典型的CSF症状,剖检后发现典型病变(图4)。表明,用1/10 头份及以上的活载体疫苗(rAd-E0-E2 株)免疫猪14 d 后,能保护猪不因猪瘟强毒的攻击而出现猪瘟临床症状及其组织器官病变。
2.2.3 最小免疫剂量组攻毒后疫苗保护结果 1 组于攻毒后仅1/5 保护,有4 头在攻毒后11 d~12 d 死亡,表现典型猪瘟症状和组织病变;2 组、3 组、4组在攻毒后均5/5 保护,没有出现CSF 临床症状,剖检无病变;5 组对照组在攻毒后9 d~10 d 全部死亡,期间体温高热稽留,表现典型的CSF 症状,剖检组织病变严重(图5、表2)。表明,用1/10 头份及以上的活载体疫苗(rAd-E0-E2 株)免疫猪14 d 后,能完全保护猪不因为猪瘟强毒的攻击而死亡。
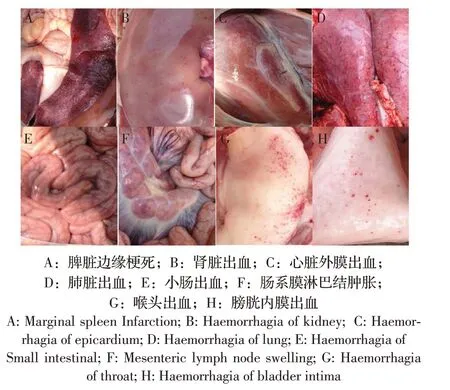
图4 组织病变图Fig.4 Pathological changes of tissues

图5 不同剂量的活载体疫苗(rAd-E0-E2株)免疫猪后攻毒生存曲线Fig.5 Survival curve of challenged piglets with different doses of live vector vaccine(rAd-E0-E2 strain)

表2 不同剂量的活载体疫苗(rAd-E0-E2 株)免疫猪后攻毒保护率统计结果Table 2 Statistical result of the challenge protection efficacy of challenged pigs with different doses of live vector vaccine(rAd-E0-E2 strain)
2.3 免疫期组攻毒后体温变化、临床症状及其保护结果
2.3.1 免疫期组攻毒后体温变化 6 组、7 组攻毒后体温正常,均无发热现象;8 组阴性对照组于攻毒后2 d~3 d 开始发热,体温升高超过40 ℃,出现高热稽留(图6)。表明,活载体疫苗(rAd-E0-E2 株)、C株均能保护免疫猪至少7 个月不受猪瘟石门系野毒株的感染。
2.3.2 免疫期组攻毒后临床剖检结果 6 组、7 组免疫后7 个月攻毒,观察无猪瘟典型临床症状出现,16 d 后剖检组织无病变;8 组阴性对照组攻毒后5/5出现CSF 症状,剖检后组织器官均有典型的猪瘟病变(表3)。表明,活载体疫苗(rAd-E0-E2 株)、C 株均能保护免疫猪至少7 个月不受猪瘟石门系野毒株的感染。
2.3.3 免疫期组攻毒后疫苗保护率 6 组、7 组攻毒后均5/5 保护,无CSF 临床症状,剖检无病变;8 组阴性对照组在攻毒后14 d 内全部死亡,期间体温高热稽留,表现典型的CSF 症状,剖检组织发现病变(表3)。表明,活载体疫苗(rAd-E0-E2 株)、C 株均能保护免疫猪至少7 个月免受猪瘟强毒的侵害。

图6 免疫期组攻毒后体温变化Fig.6 Dynamic changes of body temperature in pigs after challenge in the immune duration group

表3 免疫期组攻毒保护率统计结果Table 3 Statistical results of the protection rates of challenged pig in the immune duration group
3 讨 论
猪瘟活载体重组疫苗是将猪瘟病毒的抗原基因重组到能表达外源性病毒蛋白的活载体中制得的一种疫苗,该疫苗直接免疫动物后可引起机体产生特异性的免疫反应,具有能够激发机体产生特异性免疫反应,不散毒及便于储存和运输等优点,是近年来研究的一个热点。Sun 等基于重组腺病毒5 型构建了CSFV E2 基因的活载体疫苗rAdV-E2,使家兔和猪免疫后体内产生高水平的CSFV 特异性中和抗体,具有很好的保护作用[13-15]。本实验室前期已经构建了活载体疫苗(rAd-E0-E2 株),并对其进行了安全性检验,即在小鼠体内的存留时间分析证明活载体疫苗(rAd-E0-E2 株)在小鼠体内的最长存留时间为72 h,验证了活载体疫苗(rAd-E0-E2 株)对小鼠的安全性[16]。根据中华人民共和国兽用生物制品质量标准,现行的猪瘟疫苗免疫效力检验主要依靠家兔或猪进行动物试验。前期本实验室已经在兔体上对活载体疫苗(rAd-E0-E2 株)的免疫原性进行了分析[17],确定了活载体疫苗(rAd-E0-E2 株)在兔体上的保护效力。本研究以猪为靶动物对活载体疫苗(rAd-E0-E2 株)进行免疫效力分析,并确定其最小免疫剂量和免疫期,为后期的生产和应用提供理论基础。
本研究使用实验室试制活载体疫苗rAd-E0-E2株,以猪为靶动物,通过检测抗体水平、猪瘟石门系血毒攻毒、体温监测、临床症状观察及剖检病变等几种方法共同评价活载体疫苗(rAd-E0-E2 株)的免疫效力。通过以上方法分析发现,1/10 头份活载体疫苗(rAd-E0-E2 株)免疫猪后7 d 和14 d 抗体平均阻断率均未达到阳性,但是免疫14 d 攻毒后却能完全保护猪, 表明虽然1/10 头份活载体疫苗(rAd-E0-E2 株)免疫猪后通过体液免疫产生的抗体水平并不高,但可能通过激活细胞免疫或黏膜免疫共同抵御猪瘟强毒的致死量攻击。所以使用活载体疫苗(rAd-E0-E2 株)能在短时间内通过细胞免疫或粘膜免疫等途径来共同保护猪,减少了猪在免疫空窗内感染猪瘟病毒从而发病的机率;使用1 头份活载体疫苗(rAd-E0-E2 株)免疫猪,免疫后7 d 抗体阻断率全部转为可疑水平,免疫后14 d 抗体阻断率全部转为阳性,高水平抗体持续至免后7 个月,并且高于同期1 头份C 株免疫猪产生的抗体水平,即表明活载体疫苗(rAd-E0-E2 株)的免疫效力高于C株;并且免疫7 个月攻毒后猪完全被保护,说明使用本品疫苗免疫一次就可达到至少7 个月的保护,为大规模的养殖提供了便利,更降低了时间成本和养殖成本。
综上所述,疫苗的最小免疫剂量为1/10 头份(1.58×106.0IFU),考虑到临床实际应用影响因素较多,为确保免疫效果,将疫苗的使用剂量定为最小免疫剂量的10 倍,即1 头份。活载体疫苗(rAd-E0-E2株)免疫猪1头份后免疫期至少为7 个月。
