PD-1/PD-L1单克隆抗体治疗头颈部鳞癌的研究进展*
2020-07-01
头颈部肿瘤主要为鳞状细胞癌病理分型,多发于口腔、口咽和喉部,每年约60万新增病例[1]。约2/3的头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)应用目前的治疗手段仍无法有效控制疾病进展,5年生存率<50%。此外,铂类难治性HNSCC患者的中位生存期小于6个月,因此亟需新的治疗策略[2]。
近年研究表明,宿主免疫系统的抑制在HNSCC的发生发展中发挥着关键作用。HNSCC患者固有免疫系统和适应性免疫系统中有许多关键组成部分存在功能障碍,包括自然杀伤细胞的活性、抗原呈递细胞的功能以及树突状细胞的成熟等[3]。T淋巴细胞等功能细胞中,也存在免疫抑制现象,免疫抑制调节T细胞和免疫抑制细胞因子的数量增多,而淋巴细胞的总数减少[4]。
自从免疫检查点抑制剂在黑色素瘤、非小细胞肺癌、肾细胞癌和膀胱癌中获得理想的疗效,越来越多的学者对其治疗HNSCC产生较高的期望。目前多种检查点抑制剂正处于临床研究阶段,其主要研究热点集中在程序性细胞死亡分子-1(programmed death-1,PD-1)/程序性细胞死亡分子配体-1(programmed death-ligand 1,PD-L1)轴[5]。PD-1 及其配体PD-L1 在肿瘤的发生、发展中发挥重要作用。2016年,美国食品和药物监督管理局(FDA)批准了PD-1 单克隆抗体(mAbs)派姆单抗(pembrolizumab)和纳武单抗(nivolumab)治疗复发或转移性(recurrent or metastatic,R/M)HNSCC。新版美国国立综合癌症网络(NCCN)指南将这两种药物纳入晚期HNSCC 的治疗策略中[6]。与传统治疗方法相比,PD-1 阻断免疫疗法用于治疗晚期HNSCC患者显示出令人欣喜的疗效[5]。本文对PD-1/PD-L1 通路在HNSCC 中的作用及应用进行综述。
1 PD-1及PD-L1的结构
PD-1 是由染色体2q37.3 上的5-外显子PDCD1基因编码的Ⅰ型跨膜蛋白。PD-1由288个氨基酸组成,包含免疫球蛋白(Ig)超家族结构域、跨膜结构域和含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)和免疫受体酪氨酸开关基序(immunoreceptor tyrosine-based switch motif,ITSM)细胞内结构域。在基因蛋白质水平上,人类和小鼠PD-1均具有较高同源性[7]。PD-L1是小鼠19 号染色体和人9 号染色体Cd274 基因编码的Ⅰ型跨膜蛋白,含有290 个氨基酸。Cd274 由7 个外显子组成,分别为非编码区、信号序列、IgV 样结构域、IgC样结构域、跨膜结构域和细胞内结构域[8]。PD-1和PD-L1在目前报道的物种中均高度保守。
2 PD-1/PD-L1的表达
接触抗原后,T细胞被激活并表达PD-1,后者能抑制效应T细胞的增殖和细胞因子的产生,使T细胞耗竭[9]。除T细胞外,B细胞、自然杀伤细胞、单核细胞和树突状细胞也有PD-1表达。PD-L1不仅表达于淋巴细胞(如单核细胞、树突状细胞和T细胞)和非造血细胞(如内皮细胞和上皮细胞),在许多肿瘤中也有表达。目前已有多项研究表明在HNSCC中也存在PD-1和PD-L1表达,但结果差异较大。PD-L1在HNSCC中的表达为40%~87%[10]。Yu等[11]研究发现,与正常口腔黏膜标本相比,HNSCC患者标本中PD-1的表达增加。Kansy等[12]通过检测HNSCC标本发现,PD-1在肿瘤浸润性CD8+T细胞中多数呈高表达状态。PD-1 与PD-L1 结合导致PD-1 CD8+T细胞功能受损,因此尽管肿瘤微环境中存在肿瘤特异性CD8+T 细胞,但仍可能促进肿瘤生长。PD-1 和PD-L1 在人乳头状瘤病毒(human papillomavirus,HPV)相关的HNSCC中表达均高于HPV阴性的HNSCC组织标本。
3 分子机制
PD-L1 是自身反应性T 细胞的关键负性调节因子,并以多种方式发挥维持外周免疫耐受和抑制自身免疫的作用,促使T 细胞耗竭和功能障碍,肿瘤细胞逃避免疫监视[13]。在激活的T 细胞上,PD-L1 和PD-1结合后与TCR信号共同导致胞质结构域的酪氨酸磷酸化,并招募SH2 区的酪氨酸磷酸酶2(src homology 2-containing tyrosine phosphatase,SHP-2)至ITSM,从而抑制下游信号传导,包括阻断磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)和Akt活性,扰乱葡萄糖代谢和IL-2 分泌[14]。除了作为PD-1 的配体外,PD-L1可诱导IL-10的分泌,可能促使活化T细胞凋亡[15]。
PD-1/PD-L1单克隆抗体通过阻断PD-1与PD-L1的结合从而恢复肿瘤特异性T细胞的功能,实现增强抗肿瘤免疫的作用,现已用于治疗多种肿瘤。研究表明,单独阻断PD-1或PD-L1可导致肿瘤部位的T细胞和IFN-g 增加,同时骨髓来源的抑制性细胞(myeloidderived suppressor cell,MDSC)的占比降低。效应-抑制细胞比率的增加通常有利于发挥抗肿瘤作用。上述结果表明,PD-1/PD-L1单抗可以通过改变CTL与Treg比率,促进效应T细胞增殖和功能恢复,进而达到有效控制肿瘤生长的目的[16]。
4 PD-1/PD-L1单抗
HNSCC的死亡率多年保持不变,主要与早期局部复发和转移有关。自从在黑色素瘤中首次使用检查点抑制剂临床获益以来,研究人员对其治疗HNSCC寄予厚望。临床研究正在评估多种检查点抑制剂的疗效,其关注重点主要集中于PD-1/PD-L1轴上[17]。近年来,已经研发出多种PD-1和PD-L1生物抑制剂,并用于各期临床试验(表1,2)。PD-1/PD-L1检查点在肿瘤免疫中的作用得到广泛认可。此外,据报道阻断PD-1/PDL1通路联合CTLA-4抑制剂、化疗和放疗等治疗手段可能会达到更好的疗效[17]。
4.1 派姆单抗
派姆单抗(lambrolizumab)是一种完全人源化的IgG4-kappa型抗PD-1单克隆抗体。2014年9月FDA批准派姆单抗(KEYTRUDA,Merck Sharp & Dohme Corp)用于治疗Ⅲ期或Ⅳ期转移性黑色素瘤,作为伊匹单抗(ipilimumab)和BRAF抑制剂治疗后疾病进展的二线治疗,剂量为每3 周1 次静脉注射2 mg/kg[13]。其成为首个被FDA 批准用于临床的PD-1 单克隆抗体。具有可控的安全性和耐受性,在多种实体肿瘤中显示出良好且持久的抗肿瘤活性。
在R/M HNSCC(Keynote 012)的Ⅰb期试验中,PD-L1高表达患者每2周静脉注射1次派姆单抗(10 mg/kg),有效率为20%。Keynote 012的扩展队列共132例患者,其中28例HPV阳性。患者每3周静脉注射1次200 mg派姆单抗,治疗持续24个月或者疾病进展、出现无法耐受的不良反应或患者主动退出。此研究的长期随访显示,应用派姆单抗治疗的R/M HNSCC患者的总体客观缓解率(objective response rate,ORR)为18%,HPV阴性患者ORR为16%,HPV阳性患者ORR为24%。PD-L1表达阳性和阴性组的ORR分别为22%和4%[18]。中位缓解时间为2 个月,24%患者为完全缓解(complete response,CR)。最值得关注的是,派姆单抗疗效持久,中位随访5.7个月时仍有86%患者用药有效。85%患者缓解持续时间为6个月以上,71%患者缓解持续12个月以上。中位无进展生存期(median progression-free survival,mPFS)为2个月,中位总体生存期(median overall survival,mOS)为8个月。随访6个月时,总体无进展生存期(progression-free survival,PFS)和总生存期(overall survivanl,OS)分别为23%和59%;PD-L1表达阳性和阴性组的PFS 分别为37%和20%,OS 分别为70%和56%[18]。约25%患者在治疗期间疾病稳定,总体疾病控制率(disease control rate,DCR)约为50%。62%患者发生治疗相关的不良反应,最常见的是疲劳(15%)、甲状腺功能减退(9.1%)、食欲下降(7.6%)和皮疹(7.6%)。9%患者发生3级或以上治疗相关的不良反应,最常见的是食欲下降、面部肿胀和肺炎。共4例患者出现严重的免疫相关不良反应,其中2例为肺炎和2例为结肠炎[19]。总体而言,派姆单抗治疗R/M HNSCC具有良好的耐受性,并获得具有临床意义的ORR和持续缓解,该临床试验支持派姆单抗用于治疗晚期HNSCC患者。
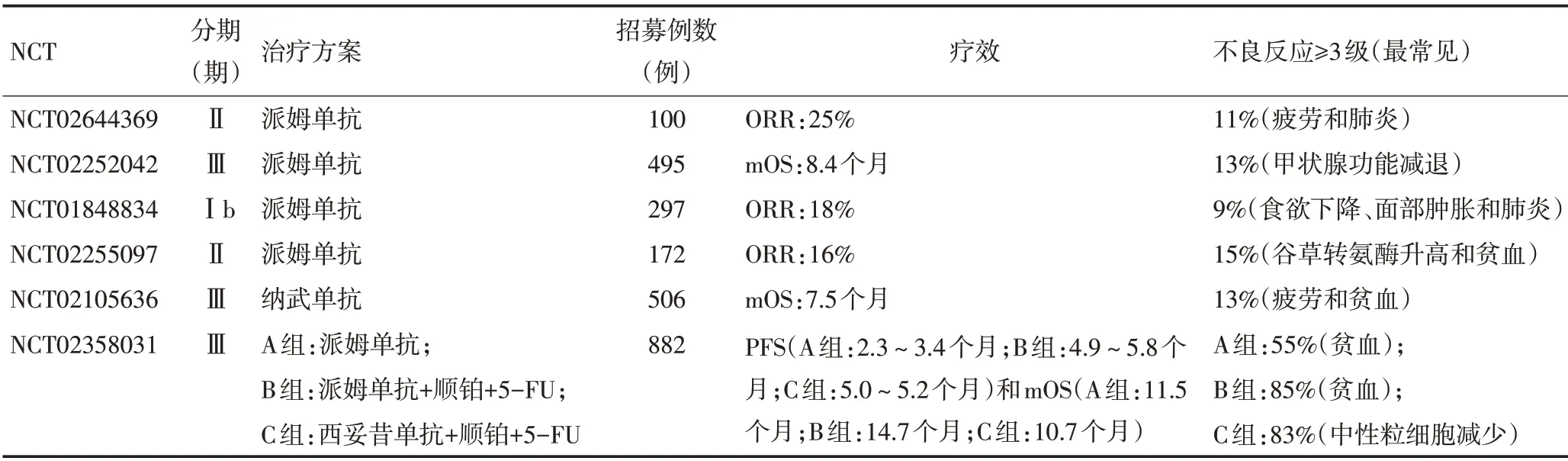
表1 抗PD-1治疗的HNSCC临床试验

表2 抗PD-L1治疗的HNSCC临床试验
在单臂Ⅱ期Keynote-055 研究中,评估派姆单抗治疗铂类化疗和西妥昔单抗难治性患者的临床疗效。共171例患者参与临床试验,其中82%患者PDL1阳性。患者每3周静脉输液派姆单抗200 mg,直至连续使用24 个月或出现其他停药指征。患者总体ORR 为16%,中位缓解持续时间为8 个月;在最后一次随访时,仍有75%患者为疾病缓解。mPFS为2.1个月,mOS为8个月。然而与此前研究不同的是HPV和PD-L1 各个亚组的缓解率未出现明显差异。109 例患者(64%)发生与治疗相关的不良反应;26例(15%)出现≥3 级不良反应。7 例(4%)因不良反应停止治疗,1例死于治疗相关的不良反应。派姆单抗在使用铂和西妥昔单抗治疗失败的R/M HNSCC中仍然显示出有临床意义的抗肿瘤活性和可接受的安全性[20]。
此外有两项关于派姆单抗的Ⅲ期临床试验,分别为Keynote 040和Keynote 048。Keynote 040试验用于比较派姆单抗和标准治疗(甲氨喋呤、多西他赛或西妥昔单抗)治疗R/M HNSCC 疗效和安全性的差异。随访截止时,派姆单抗组73%患者死亡,mOS 为8.4 个月;标准治疗组83%患者死亡,mOS 为6.9 个月[21]。Keynote 048试验支持派姆单抗单药或联合化疗用于一线治疗R/M HNSCC[22]。
4.2 纳武单抗
2014年12月美国FDA 批准纳武单抗(百时美施贵宝公司,Opdivo)用于治疗一线治疗失败的不可切除或转移性黑色素瘤。纳武单抗是第二种获得FDA批准的PD-1单抗。随后,纳武单抗又被FDA批准用于二线治疗晚期鳞状非小细胞肺癌(2015年3月)[13]。纳武单抗是一种全人源IgG4抗PD-1单克隆抗体。对PD-1有很高的亲和力,能阻止其与配体结合。与派姆单抗一样,在治疗多种实体瘤中获得了优异的临床疗效,且具有良好的安全性和耐受性。
在随机、开放性Ⅲ期试验(Checkmate 141)中,共361例口腔癌、咽癌或喉癌的R/M患者,分别接受纳武单抗治疗(240例)和标准治疗(西妥昔单抗、甲氨蝶呤或多西紫杉醇)(121例)。所有参与临床试验的患者在最后一次铂类化疗后6个月内疾病进展。每2周静脉注射3 mg/kg纳武单抗或甲氨蝶呤(40~60 mg/m²)、多西他赛(30~40 mg/m²)、西妥昔单抗(250 mg/m²),直至疾病进展、不可耐受的不良反应或主动退出临床试验。纳武单抗组患者的mOS为7.5(5.5~9.1)个月,而标准治疗组的mOS为5.1(4.0~6.0)个月。纳武单抗治疗明显提高了患者的生存期(P=0.010 1),并且纳武单抗组的1年生存率比标准治疗高约19个百分点(36%vs.16.6%),纳武单抗降低了R/M HNSCC患者的死亡风险[23]。值得关注的是,HPV阳性和HPV阴性的HNSCC患者均可从纳武单抗治疗中获益。在HPV阳性的HNSCC患者中,纳武单抗组的mOS为9.1个月,标准治疗组为4.4个月;在HPV阴性的患者中,纳武单抗组的mOS为7.5个月,标准治疗组为5.8个月[5]。纳武单抗组的mPFS为2.0(1.9~2.1)个月,标准治疗组为2.3(1.9~3.1)个月(P=0.32)。纳武单抗组患者6个月PFS为19.7%,标准治疗组为9.9%。纳武单抗组ORR为13.3%,而标准治疗组为5.8%。纳武单抗治疗组13.1%患者出现3级或4级治疗相关的不良反应,其中最常见的是疲劳和食欲减退,而标准治疗组的发生率为35.1%[5]。
免疫检查点抑制剂发挥作用的模式可能不同于化疗,因此CheckMate 141 试验允许在疾病进展后继续使用纳武单抗治疗。240 例接受纳武单抗治疗的患者中,146 例出现疾病进展,其中62 例接受首次疾病进展后治疗(treatment beyond first RECIST-defined progression,TBP),84 例停止治疗。60 例可评价疗效的TBP 患者中,15 例(25%)肿瘤负荷无变化,15 例(25%)肿瘤缩小,3 例(5%)肿瘤缩小>30%。TBP 患者的mOS为12.7(9.7~14.6)个月[24]。
在评价新药的疗效时,考虑临床疗效的同时,需要考虑患者的用药体验。同时考虑临床和患者报告的结果(PRO),才能判断药物治疗的总体获益[25]。因此,在临床结果公布后PROs 结果至关重要。在Checkmate 141试验中,研究者未忽略此问题,表明关于核心生存质量(QoL)评估结果[26]。在第9 周和第15周随访时,两组患者生存质量存在显著差异,纳武单抗组患者的角色功能障碍、社交功能障碍、疲劳、呼吸困难、食欲减退、疼痛和感觉障碍均显著少于标准治疗组。纳武单抗单抗治疗延缓了患者生存质量恶化发生的时间[26]。
为了探索纳武单抗治疗HNSCC疗效的预测标志物,Nishikawa 等[27]回顾分析2017年4月至2018年3月接受纳武单抗治疗53例患者的OS和PFS。mOS和mPFS 分别为2.5 个月和8.7 个月。单因素分析显示,患者的行为状态评分(PS)>3 分、相对中性粒细胞计数≥0.65、相对淋巴细胞计数≥0.17和相对嗜酸性粒细胞计数(REC)>0.015均与PFS 和OS 显著相关。多因素分析显示,PS≥3 分和REC≥0.015 与PFS 和OS 显著相关。因此,低REC 和低PS 是纳武单抗治疗R/M HNSCC患者PFS和OS的独立预后不良因素。
4.3 阿特珠单抗
阿特珠单抗(atezolizumab)是一种人源化的免疫球蛋白G1单克隆抗体,可阻断PD-L1与PD-1和B7-1的结合,从而恢复抗肿瘤T细胞的活性以及被抑制的免疫细胞活力。阿特珠单抗在治疗多种肿瘤中显示出良好的疗效和可控的安全性[28-29]。
NCT01375842是一项用于研究阿特珠单抗治疗头颈部肿瘤疗效和安全性的临床试验。该试验共32例患者,其中原发肿瘤位于口腔7例(22%)、口咽18例(56%)、下咽1 例(3%)、喉2 例(6%)、鼻咽4 例(13%)。17 例(53%)患者曾接受过2次以上的一线治疗。21例(66%)出现与治疗相关的不良反应,其中4例出现3/4级治疗相关的不良反应。22%患者客观缓解,中位缓解持续时间为7.4(2.8~45.8)个月。mPFS为2.6(0.5~48.4)个月,mOS为6.0(0.5~51.6)个月。无论HPV和PD-L1表达水平,均可观察到阿特珠单抗可耐受的安全性和令人振奋的抗肿瘤活性。
4.4 度伐单抗
度伐单抗(durvalumab)(MEDI4736)是一种选择性、高亲和力的人IgG1单克隆抗体,能阻断PD-L1与PD-1和CD80的结合。度伐单抗的Fc片段包含一个突变,该突变用于降低抗体依赖的细胞介导的细胞毒性(antibody-dependent cell-mediated cytotoxicity,ADCC)和(或)补体依赖的细胞毒性(complement dependent cytotoxicity,CDC),该作用可以降低药物所有潜在的副作用[14]。度伐单抗在美国被批准用于治疗晚期或转移性尿路上皮癌和不可切除的Ⅲ期非小细胞肺癌,在多个晚期实体瘤中显示出令人鼓舞的抗肿瘤活性[30]。
一项Ⅰ/Ⅱ期多中心、开放性临床试验评估了度伐单抗治疗包括HNSCC在内的多种R/M实体瘤的安全性和有效性(包括HNSCC、非小细胞肺癌、胰腺癌、黑色素瘤、胃食管癌、三阴性乳腺癌、肝细胞癌和其他8种类型的肿瘤,NCT01693562)。该研究最终评估了62例R/M HNSCC患者,中位年龄为57岁;40.3%患者HPV阳性;32.3%患者肿瘤细胞PD-L1表达≥25%,62.9%患者有吸烟史。ORR为6.5%(PD-L1≥25%的亚组为15.0%,<25%的亚组为2.6%)。中位缓解时间为2.7(1.2~5.5)个月;中位缓解持续时间为12.4(3.5~20.5+)个月。mPFS为1.4个月,mOS为8.4个月。6个月和12个月的OS分别为62%和38%,其中PD-L1≥25%和<25%分别为42%和36%。全组不良反应发生率为98.4%,药物治疗相关不良反应发生率为59.7%,Ⅲ~Ⅳ级治疗相关的不良反应发生率为9.7%。无与治疗有关的停药或死亡。该试验证明度伐单抗治疗HNSCC安全有效,支持其进一步开展Ⅲ期试验[31]。与上述研究结果一致,Zandberg等[16]的试验(NCT02207530)也证实度伐单抗治疗PD-L1高表达的R/M HNSCC患者的疗效。
度伐单抗虽然是一种PD-L1的单克隆抗体,但部分PD-L1阴性的患者用药同样有效。因此,在另一项Ⅱ期试验(NCT02319044)中,267例PD-L1低表达/阴性的R/M HNSCC患者用于评估度伐单抗的疗效,其中133例联合应用度伐单抗(20 mg/kg,每4周1次)和替西木单抗(tremelimumab,1 mg/kg,每4周1次);67例使用度伐单抗单药治疗(10 mg/kg,每2周1次);67例使用替西木单抗单药治疗(前7个周期10 mg/kg,每4周1次,后2个周期每12周使用1次)。随访结果显示联合用药组(129例)的ORR和mOS分别为7.8%和7.6(4.9~10.6)个月,度伐单抗组(65例)为9.2%和6.0(4.0~11.3)个月,替西木单抗组(63例)为1.6%和5.5(3.9~7.0)个月。联合治疗组21例(15.8%)患者发生3/4级治疗相关的不良反应,度伐单抗组8 例(12.3%),替西木单抗组11 例(16.9%)。上述结果表明3种治疗方案均表现出可控的安全性,度伐单抗组和联合用药组均获得了良好的临床效果,两者之间的差异较小。因此即使是PD-L1低表达/阴性的R/M HNSCC患者也可以尝试使用度伐单抗治疗[32]。Bahig 等[33]开展的Ⅰ/Ⅱ期临床试验(NCT03283605)也联合应用了上述两种检查点抑制剂治疗转移性HNSCC,同样获得了积极的结果,再次证实度伐单抗的临床价值。
5 PD-1/PD-L1单抗的不良反应
与传统治疗方式相比,PD-1/PD-L1 单抗治疗发生各个级别和3级或以上的不良反应的概率均较低,因治疗相关不良反应而停药的患者也少于铂类化疗。大多研究显示PD-1/PD-L1 单抗治疗相关不良反应的发生率约60%,其中大部分为1~2 级,而3 级或以上不良反应的发生率8%~15%,最常见的3 级或3级以上不良反应为贫血、疲劳以及消化和代谢系统异常[16,18,21,25-27,31-32]。虽然PD-1/PD-L1单抗具有良好的安全性和耐受性,但仍有少数患者因药物相关的不良反应死亡,如KEYNOTE-048试验中有高达25例(8%)患者死于派姆单抗单药治疗产生的不良反应。因此PD-1/PD-L1单抗用药仍需谨慎。
6 结语
PD-1/PD-L1 单抗治疗治疗某些实体瘤良好的疗效使部分晚期患者重获希望。虽然通过阻断PD-1/PD-L1轴,在多种恶性实体瘤的临床治疗中取得突破性的成就,但也存在部分问题。1)目前可用的PD-1单抗和PD-L1单抗之间存在的疗效差异,是否与受体-配体相互作用和Fc 片段的差异有关。目前正在进行的Ⅰ期试验(NCT02118337)着眼于探讨这一问题。2)抗体类药物在人体内具有较长的半衰期,而且其自身还具有免疫原性,所以易导致药物相关的免疫性不良反应。由于PD-1/PD-L1 单抗的分子量较大,所以限制其进入瘤内发挥作用,影响其疗效。3)PD-1/PD-L1 单抗在治疗过程中出现的“超进展”现象已成为一个亟待解决的关键问题。部分患者使用PD-1/PD-L1单抗治疗后非但未获益,反而出现疾病快速进展的现象。虽然研究表明“超进展”与患者年龄和EGFRv Ⅲ突变等因素相关,但确切的发生机制尚不明确。除了阻断PD-1/PD-L1外,近期有报道称HNSCC 中也表达PD-L2,并且其表达水平可能高于PD-L1[34]。总之,PD-1 及其配体轴在肿瘤中的作用值得进一步探究,其应用前景值得期待。
