60例阑尾源性高级别黏液腺癌生存预后分析*
2020-07-01
阑尾上皮源性肿瘤非常罕见,约占阑尾切除标本的1%[1],约70%阑尾上皮肿瘤为黏液组织学类型。阑尾黏液性肿瘤常见于中年或老年人,多数无腹痛、腹胀等特异症状。阑尾黏液性肿瘤通常会导致腹膜假黏液瘤(pseudomyxoma peritonei,PMP),表现为腹腔进行性黏液性肿瘤积聚的临床综合征[2]。2016年,腹膜表面肿瘤国际联盟(peritoneal surface oncology group international,PSOGI)将阑尾黏液性肿瘤分为4 类:低级别阑尾黏液性肿瘤(low-grade appendiceal mucinous neoplasm,LAMN)、高级别阑尾黏液性肿瘤(high-grade appendiceal mucinous neoplasm,HAMN)、黏液腺癌(mucinous adenocarcinoma,MAC)、低分化黏液腺癌伴印戒细胞。目前国内报道的阑尾黏液性肿瘤多为个案报道。本研究搜集2013年1月至2017年12月航天中心医院收治的60 例阑尾源性高级别黏液腺癌患者的临床资料进行回顾性分析,以寻求影响预后因素,对临床工作提供一定借鉴。
1 材料与方法
1.1 一般资料
收集航天中心医院2013年1月至2017年12月期间经病理确诊为阑尾源性高级别黏液腺癌60 例,其中男性29例(48%),女性31例(52%);年龄38~74岁,中位年龄57 岁;术前化验血清CEA 阳性39 例(65%),CA199 阳性35 例,CA125 升高42 例;术中腹膜癌指数(peritoneal cancer index,PCI)评分>26 分41例;48 例(80%)患者术后联合腹腔热灌注化疗治疗(表1)。临床表现主要为腹胀、腹围增大和腹部包块,其他表现为右下腹疼痛及肠梗阻等。入院后给予完善腹部CT、全消化道造影及胃肠镜等检查。
1.2 方法
1.2.1 治疗方式 治疗方式包括肿瘤细胞减瘤术(cytoreductive surgery,CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)。根据国际共识,CRS包括脏器切除和腹膜切除,这些切除步骤包括全腹膜切除、左上腹膜切除、大网膜切除加脾切除、右上腹膜切除、盆腔腹膜切除加直肠乙状结肠切除、胆囊切除加小网膜切除及网膜囊剥除,或需要进行右半结肠切除或全结肠切除。其中手术达到细胞减灭程度(completeness of cytoreduction,CC)0为2例,CC 1为22例,CC 2为25例,CC 3为11例。CRS完成后行闭合式HIPEC,12例患者术后因发热、引流液呈红色、心率过快、血压低等因素未行HIPEC治疗。操作方法:放置4根腹腔引流管,分别置于左上腹、右上腹及下腹部,加热至(43.0±0.5)℃,以800 mL/min的流速持续循环灌注60 min。用药为顺铂80 mg,HIPEC完成后进行消化道等重建,术野止血放置腹腔引流管后关腹。
1.2.2 随访 术后每3~6个月监测血清肿瘤标志物(CEA、CA125、CA199),每6个月进行1次腹盆腔CT扫描。生存时间从手术之日计算,至患者死亡或最近一次随访时截止。所有患者均进行随访,采用电话及入院复查相结合的方式,随访终点为2017年12月。
1.3 统计学分析
采用SPSS 20.0 软件进行统计学分析,统计学方法选用Kaplan-Meier 法、Log-rank 检验及Cox 回归模型分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 预后
本研究60例阑尾源性高级别黏液腺癌总体术后1、2、3年生存率分别为80%、58%、30%,中位生存时间29个月(图1)。
单因素分析显示,性别(P=0.828)、年龄(P=0.436)、术前血CEA(P=0.113)及是否灌注(P=0.386)对总生存率无显著影响。而术中PCI评分的高低(P=0.039)及CC(P=0.002)对术后总生存有统计学意义(图2,3)。
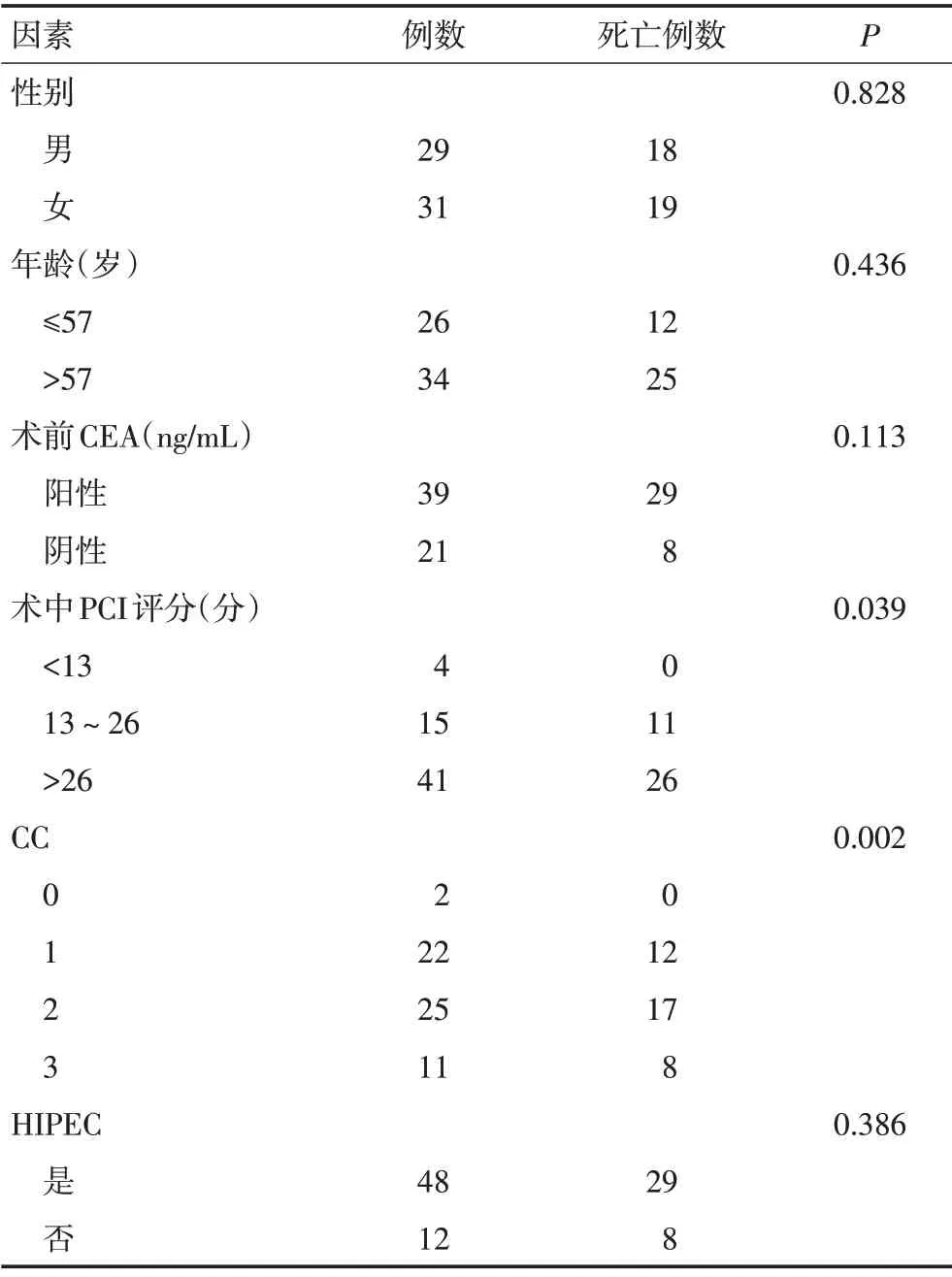
表1 60例阑尾黏液腺癌患者生存期单因素分析 例

图1 患者整体生存情况
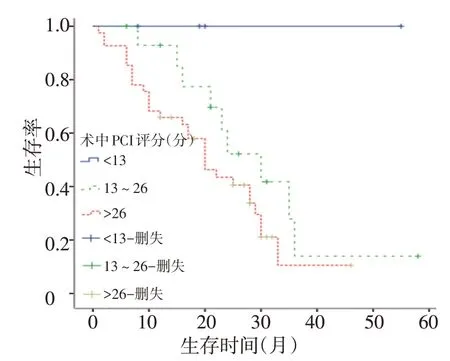
图2 不同PCI评分患者总体生存情况
多因素分析表明CC(P=0.037)可作为影响生存预后的独立因素。CC 0患者较CC 3患者生存期显著延长。而术中PCI 评分在多因素分析中无统计学意义(表2)。
2.2 并发症分析
2例出现肠瘘,其中1例出现围手术期死亡,另1例术后发现较早再次手术给予修补,恢复良好。2例出现输尿管瘘,均给予经膀胱镜双侧输尿管双J管置入手术逐渐好转。1 例上消化道出血,给予止血、输血、胃注冰盐水等处理,病情好转。

图3 不同CC患者总体生存情况
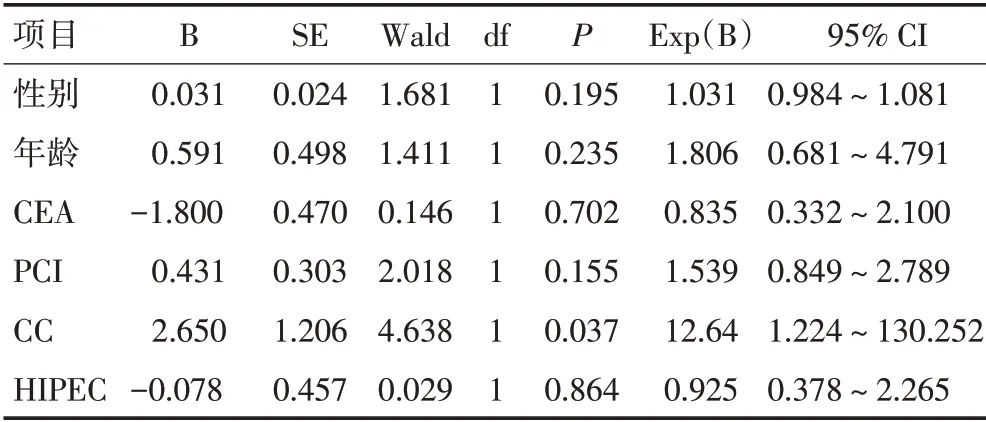
表2 60例阑尾黏液腺癌患者生存预后的多因素分析
3 讨论
腹膜假黏液瘤是临床上罕见疾病之一,主要为黏液性肿瘤细胞在腹腔内种植所形成的以黏液性腹水、腹膜种植及大网膜和卵巢受累为主要表现的临床综合征[3-5]。整体发病率约为2/1 000 000[6],近年来PMP 发病率有上升趋势,约为3~4/1 000 000/年[7]。大部分PMP来源于阑尾,呈现出恶性肿瘤生长态势,一少部分来源于卵巢、胃结肠、胰腺、脐尿管、胆囊[3,7]、畸胎瘤、肠重复等脏器。目前,国内外学者已对PMP 的治疗方式-肿瘤细胞减瘤术加腹腔热灌注化疗达成共识,而且已经逐渐开展诊疗与研究[8]。其中Jacquet 等[9]将腹部分成13 个区进行PCI 评分,具体方法为:将腹部分成13 个区,按腹部九分法分为9个区和回肠上段、回肠下段、空肠上段和空肠下段4个区。对每个区域的肿瘤负荷进行评分:0分为无可见癌组织,1 分为癌组织直径≤0.5 cm,2 分为癌直径0.5~5.0 cm,3 分为癌组织直径>5.0 cm 或融合,总分39 分。CRS 后行CC 评分[10],标准为CC 0 分:细胞减灭术后未见肿瘤组织;CC 1分:残余肿瘤直径<2.5 mm;CC 2分:残余肿瘤直径2.5 mm~2.5 cm;CC 3分:残余肿瘤直径>2.5 cm,或残余肿瘤无法切除或姑息切除病灶。术后病理报告已被腹膜表面肿瘤国际联盟达成共识[5],AJCC 第8 版推荐使用PMP 的诊断术语分为4类:1)无细胞性黏液;2)低级别黏液性肿瘤;3)高级别黏液性腺癌;4)高级别黏液性腺癌伴印戒细胞[11]。本研究入组的患者术后均经病理证实为阑尾黏液腺癌。
目前,国内外专家共识推荐CRS+HIPEC为治疗PMP的最佳治疗方法,并于2014年第9届腹膜癌大会上正式提出CRS+HIPEC 作为PMP 的标准治疗[12]。CRS+HIPEC主要通过手术切除+腹腔热灌注化疗使腹盆腔脏器充分接触化疗药物及持续循环灌洗而达到最大治疗剂量强度,此外还可以冲刷各个角落,去除组织碎屑、脱落细胞及癌细胞等。HIPEC还可以杀灭有活性的血小板、嗜中性粒细胞和单核巨噬细胞,既可防止术后黏连,也可降低新生肿瘤细胞的生长。化疗药物与热疗有协同抗肿瘤效应,高温状态下,癌细胞膜及肿瘤血管通透性增强,使药物的渗透深度从1~2 mm增至5 mm,该作用在43℃时明显增强,从而提高抗肿瘤药物的反应率,使化疗药物更易进入肿瘤细胞。Omohwo等[13]报道高级别阑尾黏液性肿瘤3年总生存率为60%,其中CC评分为0~1分的患者占78%,CC评分为2~3分的患者占28%(P=0.01)。肿瘤组织学生存分析显示,80%患者为低级别肿瘤,52%患者为高级别肿瘤(P=0.024)。CRS+HIPEC治疗后预后情况主要受病理学类型决定,腹膜弥漫性黏液腺瘤病(disseminated peritoneal adenomucinosis,DPAM)比腹膜黏液癌(peritoneal mucinous carcinomatosis,PMCA)有更长的生存期,PMCA的5年生存率为40%~45%。Halabi等[14]研究显示PMCA患者减瘤术后PCI 评分<20 分的患者5年总生存率比PCI 评分>20 分的5年总生存率更高,分别为66%和45%。Sugarbaker[15]报道PCI评分是影响阑尾低级别黏液性肿瘤的重要预后因素,PCI评分<20分的20年预后较好者占94%,而组织学含侵袭成分者,PCI评分对生存的影响截然不同。本研究显示术中PCI评分低及细胞减灭程度愈小者对延长生存期有统计学意义。多因素分析显示细胞减灭程度可作为影响总生存的独立预后因素。术后1、2、3年生存率分别为80%、58%、30%。与国外报道相比3年生存率低的原因,本研究认为与术前PCI评分较高、减瘤程度受限有关。今后还需进行更大样本量研究或多中心及前瞻性研究,以得到更可靠的预后因素。
