雌激素通过上调COX-2的表达影响宫颈癌Hela细胞的增殖及化疗敏感性
2020-07-01蔡海瑜刘爱珍宋芷霜刘路玖李幔刘志超
蔡海瑜 刘爱珍 宋芷霜 刘路玖 李幔 刘志超
河南大学附属妇产医院,郑州市妇幼保健院妇科(郑州450012)
宫颈癌是女性生殖系统常见的恶性肿瘤之一,在15 ~44 岁女性中发病率高[1],其发病率仅次于乳腺癌,此外,其在发展中国家的发病率远高于发达国家,在中国,每年有超过13 万女性被确诊为宫颈癌,且宫颈癌的发病年龄呈现年轻化趋势[1]。由于宫颈癌患者早期症状不明显,导致诊断存在一定的延后和困难[2],患者不能及时治疗,此外,化疗是临床治疗宫颈癌的主要手段之一,但化疗治疗宫颈癌的有效率只有50%左右,且随着用药周期的延长,会出现不同程度的耐药,进而影响化疗效果甚至导致治疗失败[2],因此,对宫颈癌的有效抑制及增加化疗敏感性始终是该领域关注的热点和亟待解决的难点。
近年来,有研究证实宫颈癌的发生与人乳头瘤病毒有关,而雌激素与人乳头瘤病毒的感染存在一定关系[3],因此,笔者猜测雌激素与宫颈癌的发生是否存在一定联系。炎症相关基因环氧合酶-2(COX-2)在慢性炎症启动致癌信号通路过程中发挥重要作用,可促进肿瘤的增殖、凋亡及转移,现已发现,COX-2 与宫颈癌的发生发展密切相关[4]。基于上述理论基础,本研究旨在研究雌激素对人宫颈癌Hela 细胞增殖和化疗敏感性的影响,及该影响是否与COX-2 相关,从而探讨雌激素在宫颈癌发展过程中可能起到的作用及作用机制,为宫颈癌的临床治疗提供理论支持。
1 材料与方法
1.1 细胞株与试剂人宫颈癌Hela 细胞株购自中科院上海细胞库。含双抗的1640 培养基,胎牛血清购自美国Gibco 公司;Trizol、逆转录试剂盒、CCK-8试剂盒购自Sigma公司;脂质体Lipofectamine 2000 购自美国Invitrogen 公司;COX-2、GAPDH 鼠抗人单克隆抗体购自购自美国Corning Life Sciences公司。
1.2 SiRNA 的构建抗人COX-2 SiRNA 由广州锐博生物公司合成,COX-2SiRNA 序列正义:5′-GCA UUCGAUUCAGCUUCGUtt-3′;反 义:5′-UACGUC GAUCUUACGUACUtt-3′。
1.3 细胞复苏与培养将人宫颈癌Hela 细胞株解冻复苏,用含有10%双抗及10%胎牛血清的1640 培养液重悬,置于37 ℃、5%CO2细胞培养箱中培养。待细胞铺满培养瓶底部70%以上时,将细胞用胰蛋白酶消化、重悬,按1∶3 比例进行传代培养,取传代后对数期细胞进行后续实验。
1.4 SiRNA 的转染取对数期Hela 细胞将其接种于96 孔板,调整细胞密度为2 × 105个/mL,继续培养24 h,按照说明书操作要求,用Lipofectamine 2000将含COX-2 Si RNA的质粒及空白质粒(COX-2 normal control,COX-2 NC)转染至细胞,继续培养以进行后续实验。
1.6 CCK-8 法检测细胞增殖能力将培养中的人宫颈癌Hela 细胞与不同浓度的雌二醇(E2)共培养,共设置5 个浓度梯度,分别为0、10、50、100、500、1 000 nmol/L,各组分别设置6 个复孔,将各组细胞与E2 共培养48 h 后,向细胞培养孔中加入10 μL 的CCK-8 溶液,将细胞在培养箱中继续孵育4 h,用酶标仪检测每孔细胞悬液在490 nm 波长处的吸光度(A490),以此来表示细胞的增殖活性。
同样的方法,将正常Hela 细胞、转染COX-2 Si RNA和COX-2 NC的细胞各组分别设置6个复孔,转染48 h 后用CCK-8 法检测各组细胞增殖活性。
1.7 化疗敏感性检测将培养中的人宫颈癌Hela细胞与不同浓度的E2共培养,共设置5个浓度梯度[5],分别为0、10、50、100、500、1 000 nmol/L,加入顺铂(0.5 μg/mL),每组设置6 个复孔,将各组细胞与E2 共培养48 h 后,以空白细胞(即不与药物共培养的人宫颈癌Hela 细胞)作为对照组,CCK-8 法检测各组细胞存活率。细胞存活率=实验组A 值/对照组A 值×100%。
将转染COX-2 Si RNA、COX-2 NC 的细胞与正常组细胞培养24 h 后,分别加入顺铂(0.5 μg/mL),每组设置6 个复孔,继续培养48 h,以空白细胞作为对照组,同样的方法检测细胞存活率。
1.8 Western blot检测Hela 细胞COX-2蛋白表达将培养中的人宫颈癌Hela 细胞与不同浓度的E2共培养,共设置5个浓度梯度[5],分别为0、10、50、100、500、1 000 nmol/L,加入顺铂(0.5 μg/mL),每组设置6 个复孔,将各组细胞与E2 共培养48 h 后,蛋白裂解液冰浴中裂解,离心取上清液,电泳条件分离蛋白,将蛋白转移至NC 膜,用含5%脱脂奶粉的TBST 封闭孵育NC 膜,按顺序加入一抗、二抗,TBST 洗涤NC 膜,ECL 显色,将胶片扫描后用Bandscan 5.0 软件进行灰度分析。
1.9 统计学方法采用SPSS 21.0 进行统计分析,计量资料采用均数±标准差表示,多组间比较采用单因素方差分析,方差分析有差异时,则进一步采用LSD-t检验进行组间差异的两两比较;计数资料用百分比表示,采用χ2检验;P<0.05 则认为差异具有统计学意义。
2 结果
2.1 E2 能刺激Hela 细胞增殖用不同浓度的E2与Hela 细胞共培养,CCK-8 检测细胞增殖情况,结果显示,10、50 nmol/L 组与正常组细胞增殖活性差异无显著性,100、500、1 000 nmol/L E2 与Hela 细胞共培养后,增殖活性显著高于低剂量组(P<0.05),且增殖活性呈现剂量依赖性增长。见表1。
表1 不同浓度E2 处理后Hela 细胞增殖活性Tab.1 Hela cell proliferation activity after treatment with different concentrations of E2±s

表1 不同浓度E2 处理后Hela 细胞增殖活性Tab.1 Hela cell proliferation activity after treatment with different concentrations of E2±s
注:a,与0 nmol/L 组相比,P<0.05;b,与10 nmol/L 组相比,P<0.05;c,与50 nmol/L 组相比,P<0.05;d,与100 nmol/L 组相比,P<0.05;e,与500 nmol/L 组相比,P<0.05
组别0 nmol/L 10 nmol/L 50 nmol/L 100 nmol/L 500 nmol/L 1 000 nmol/L样本量6 6 6 6 6 6 A490 0.420±0.012 0.463±0.016 0.531±0.025 0.963±0.021abc 1.123±0.034abcd 1.422±0.036abcde
2.2 E2 能抑制Hela 细胞顺铂化疗敏感性将不同浓度的E2 与Hela 细胞和顺铂共培养,结果发现,与正常细胞相比,添加顺铂后细胞存活率显著下降,说明Hela 细胞对顺铂有一定的敏感性;当不同浓度的E2 与添加顺铂的Hela 细胞共培养后,发现除10 nmol/L 和0 nmol/L 组的细胞存活率差异无显著性外,其余各组细胞存活率均随着E2 浓度的增加而增加,说明随着E2 浓度的增加,Hela 细胞对顺铂的敏感性降低。见表2。
表2 不同浓度E2 处理后Hela 细胞顺铂化疗敏感性Tab.2 Sensitivity of cisplatin to Hela cells treated with E2 at different concentrations ±s
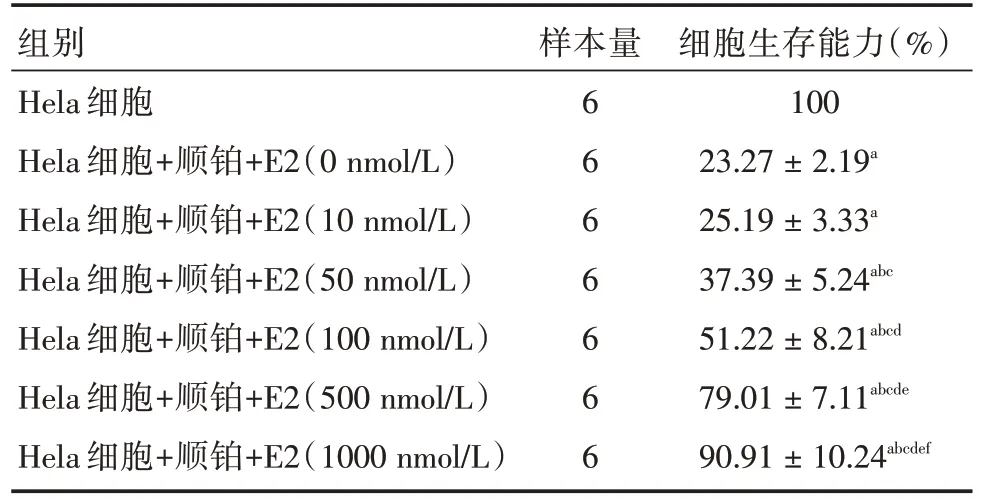
表2 不同浓度E2 处理后Hela 细胞顺铂化疗敏感性Tab.2 Sensitivity of cisplatin to Hela cells treated with E2 at different concentrations ±s
注:a,与Hela 细胞相比,P <0.05;b,与Hela 细胞+顺铂+0 nmol/L E2 组相比,P <0.05;c,与Hela 细胞+顺铂+10 nmol/L E2 组相比,P <0.05;d,与Hela 细胞+顺铂+50 nmol/L E2组相比,P <0.05;e,与Hela 细胞+顺铂+100 nmol/L E2 组相比,P <0.05;f,与Hela 细胞+顺铂+500 nmol/L E2 组相比,P <0.05
组别Hela 细胞Hela 细胞+顺铂+E2(0 nmol/L)Hela 细胞+顺铂+E2(10 nmol/L)Hela 细胞+顺铂+E2(50 nmol/L)Hela 细胞+顺铂+E2(100 nmol/L)Hela 细胞+顺铂+E2(500 nmol/L)Hela 细胞+顺铂+E2(1000 nmol/L)样本量6 6 6 6 6 6 6细胞生存能力(%)100 23.27±2.19a 25.19±3.33a 37.39±5.24abc 51.22±8.21abcd 79.01±7.11abcde 90.91±10.24abcdef
2.3 COX-2基因沉默后Hela细胞增殖活性降低与正常Hela 细胞相比,转染COX-2 NC 后的细胞增殖活性无显著改变,而转染COX-2 SiRNA 的细胞增殖率显著降低(P<0.05),说明COX-2 基因沉默后Hela 细胞增殖活性降低。见表3。
表3 转染后Hela 细胞增殖活性Tab.3 Hela cell proliferation activity after transfection ±s
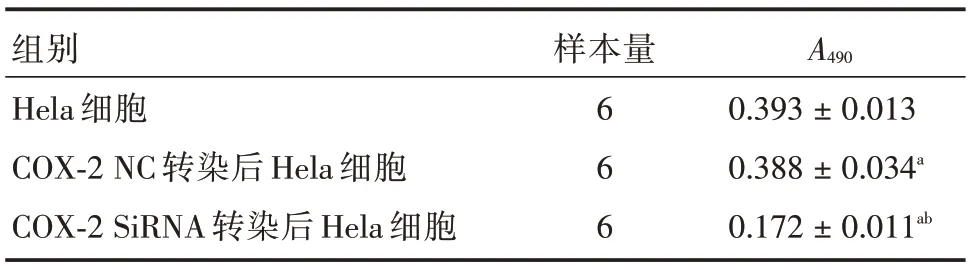
表3 转染后Hela 细胞增殖活性Tab.3 Hela cell proliferation activity after transfection ±s
注:a,与Hela 细胞相比,P <0.05;b,与COX-2 SiRNA 转染后Hela 细胞相比,P <0.05
组别Hela 细胞COX-2 NC 转染后Hela 细胞COX-2 SiRNA 转染后Hela 细胞样本量6 6 6 A490 0.393±0.013 0.388±0.034a 0.172±0.011ab
2.4 COX-2 基因沉默后Hela 细胞顺铂化疗敏感性增加正常Hela 细胞与顺铂共培养后,存活率显著下降,说明Hela 细胞对顺铂有一定的敏感性;转染COX-2 NC 后,细胞存活率较未转染细胞无明显变化(P>0.05),而转染COX-2 SiRNA 后细胞存活率显著下降,说明COX-2 基因沉默后能使Hela细胞顺铂化疗敏感性增加。
2.5 E2 能刺激Hela 细胞内COX-2 蛋白表达用不同浓度的E2与Hela细胞共培养48 h后,检测各组细胞内COX-2 蛋白表达,结果显示,10、50 nmol/L组与正常组COX-2表达水平无显著差异,100、500、1 000 nmol/L 组细胞COX-2 表达显著高于低剂量组,且表达水平随着E2 浓度呈增高趋势。见图1。

表4 转染后Hela 细胞的顺铂化疗敏感性Tab.4 Sensitivity of cisplatin to Hela cells after transfection
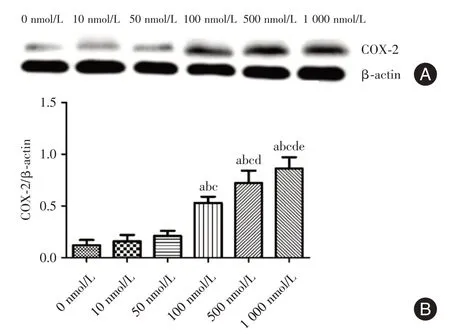
图1 COX-2 蛋白表达Fig.1 Expression of COX-2 protein
3 讨论
雌激素是一类固醇类化合物,在女性生理周期中扮演重要角色,其主要作用是促进女性生殖器官的发育,并维持女性的第二性征。女性体内从月经初潮至绝经期最主要的雌激素为E2[5]。有报道证实,在体内高雌激素的刺激下,E2 可延长宫颈癌细胞S 期时间,而使G2/M 期比例下调[6]。有研究发现,宫颈癌组织内E2 水平显著高于子宫肌瘤组织和正常人群的子宫组织,无论患者是否绝经,E2 与宫颈癌的关联都具有统计学意义,且呈现剂量依赖关系[7]。另有研究显示,在宫颈癌细胞内,E2 能刺激E6/E7 原癌基因的增殖、转录[8]。LI等[9]研究结果显示雌激素对Hela 细胞有促进生长的作用,且随着激素浓度的增高其促进增殖的作用增强,认为雌激素对宫颈癌细胞有促进作用。CHEN 等[10]研究结果亦显示E2 对Hela 细胞的增殖有促进作用,且浓度越大,促进作用越强。根据本研究结果,笔者发现,低浓度E2 对Hela 细胞的增殖没有显著影响,而高浓度的E2 能刺激Hela 细胞的增殖,且这种作用呈现剂量依赖性,该结论与田丽波等的研究结论一致[10]。同时,笔者检测了E2对Hela 细胞化疗敏感性的影响,结果显示,E2 能显著降低Hela 细胞对顺铂的化疗敏感性,且随着E2 浓度的增加,Hela 细胞对顺铂的敏感性降低,此结果表明高浓度E2 能促进Hela 细胞的增殖,并抑制其化疗敏感性。
COX-2 是调控花生四烯酸生成的前列腺素,能促进血管内皮因子的激活,促进肿瘤新生微血管的形成,增强肿瘤细胞的侵袭力[11-14],COX-2 表达增加亦能增强柱状上皮细胞突破基底膜的能力,促进了癌细胞的转移[15-17]。COX 是参与机体前列腺素生成的主要限速酶,催化花生四烯酸转化成各类前列腺素[18],在正常组织中一般不表达,当细胞受到促癌剂、炎性介质等刺激后会出现高表达[19]。研究发现,COX-2 在宫颈癌细胞中表达异常升高,免疫组化结果显示其主要在癌变上皮细胞及恶性上皮细胞中表达,提示COX-2 可能参与宫颈癌的发生[20]。COX-2 为宫颈癌发生的危险因素之一,与宫颈癌临床分期、转移、肿瘤生长浸润等都有密切联系,贯穿宫颈癌病变的整个过程[21-23]。有研究显示,COX-2 SiRNA 抑制COX-2 的表达后癌细胞的增殖也相应受到抑制[24-25]。本研究发现,当沉默COX-2 基因时,Hela 细胞增殖活性降低,顺铂化疗敏感性增加,这一发现与文献报道一致[24],说明COX-2 的活化能促进Hela 细胞的增殖,而抑制其化疗敏感性。
为了进一步确认E2 对Hela 细胞增殖活性和化疗敏感性的影响与COX-2 之间的关系,笔者将不同浓度的E2 与Hela 细胞共培养后,检测了细胞内COX-2 蛋白表达,结果显示,随着E2 浓度的增加,细胞内COX-2 蛋白表达随之增加,提示E2 对Hela 细胞内COX-2 的表达有刺激作用,而E2 对Hela 细胞增殖的刺激和化疗敏感的抑制作用,很可能与刺激COX-2 的表达有一定关系,笔者猜测E2 刺激COX-2 后,很可能是启动了某个与宫颈癌细胞增殖相关的信号通路,但其具体作用机制还需笔者下一步探索和验证。
综上所述,高浓度E2 能促进宫颈癌Hela 细胞的增殖,并抑制其化疗敏感性,这种作用可能是通过调节COX-2 的表达而实现的。
