血清胱抑素C与新型冠状病毒肺炎患者预后的相关性
2020-07-01张长升胡晶占志兵董铮柳琦陶佳意
张长升 胡晶 占志兵 董铮 柳琦 陶佳意
黄冈市中心医院(湖北黄冈438000)
新型冠状病毒肺炎(COVID-19)患者分型多为轻型和普通,约20%的患者病情严重。研究[1]显示,COVID-19 重型患者病死率高于普通型和轻型,诊断时间越晚,死亡风险越高。胱抑素C(Cys-C)作为早期肾损伤、心血管事件的预测指标已被广泛应用,且文献[2]报道Cys-C 可用于评估脓毒血症的患者生存率。本研究通过分析ICU 32 例确诊COVID-19 患者的资料,探讨Cys-C 与COVID-19 患者预后的相关性。
1 资料与方法
1.1 一般资料选取大别山区域医疗中心南二ICU 病区2020年1月30日至2月14日收治的32 例重 症 确 诊COVID-19 患者,年龄35 ~81 岁,平均(58.16±12.04)岁。其中男20 例,女12 例。32 例COVID-19 患者,26 例转入普通病房,死亡6 例。收集纳入患者的性别、年龄、吸烟史、有无冠心病、高血压、脑卒中、糖尿病、慢性阻塞性肺疾病(COPD)等资料。
1.2 研究方法所有患者确诊后收入院当日采集静脉血,测定血肌酐(Scr)和Cys-C 值。
1.3 统计学方法采用SPSS 22.0 软件进行统计分析。计量资料用均数±标准差表示,两组间比较行独立样本t检验;计数资料用百分比表示,行χ2检验;采用Kaplan-meier 法绘制生存曲线,组间比较行Log-rank 检验;对变量与预后的关系型多因素Cox 回归分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 两组一般临床资料与A 组比较,B 组糖尿病患病率较高(P<0.05),且B 组的Scr、Cys-C 水平明显高于A 组(P<0.01)。而两组在性别、吸烟史、慢性疾病(高血压、COPD)史及肿瘤个人史上比较差异无统计学意义(P>0.05,表1)。

表1 两组一般临床资料比较Tab.1 Comparison of general clinical data of 2 groups
2.2 Cys-C水平与COVID-19患者ICU住院15 d的预后Kaplan-meier 生存分析将纳入研究患者的Cys-C 平均值分为Ⅰ组(Cys-C <1.2 mg/L)、Ⅱ组(1.2 mg/L≤Cys-C<1.9mg/L)、Ⅲ组(Cys-C≥1.9mg/L)。Kaplan-meier 生存分析显示,Ⅲ组在诊疗过程中,住院时间明显大于Ⅰ组、Ⅱ组(P<0.05,图1),同时Cys-C水平高的COVID-19患者死亡事件发生率高。
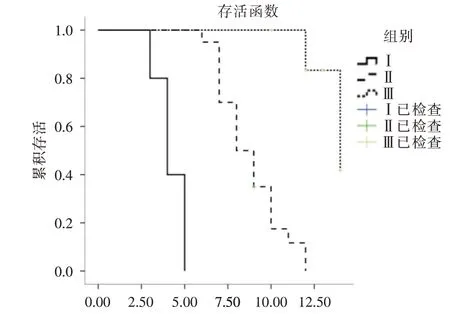
图1 COVID-19 患者的Kaplan-meier 生存曲线Fig.1 Kaplan-meier survival curve for COVID-19 patients
2.3 COVID-19 患者死亡事件发生影响因素分析将年龄、吸烟史、高血压病史、糖尿病史、COPD 史、恶性肿瘤个人史和Cys-C 水平引入多因素Cox 风险回归模型,结果显示糖尿病、COPD、Cys-C 是COVID-19 患者转归时间及预后的独立危险因素(P<0.05,表2)。
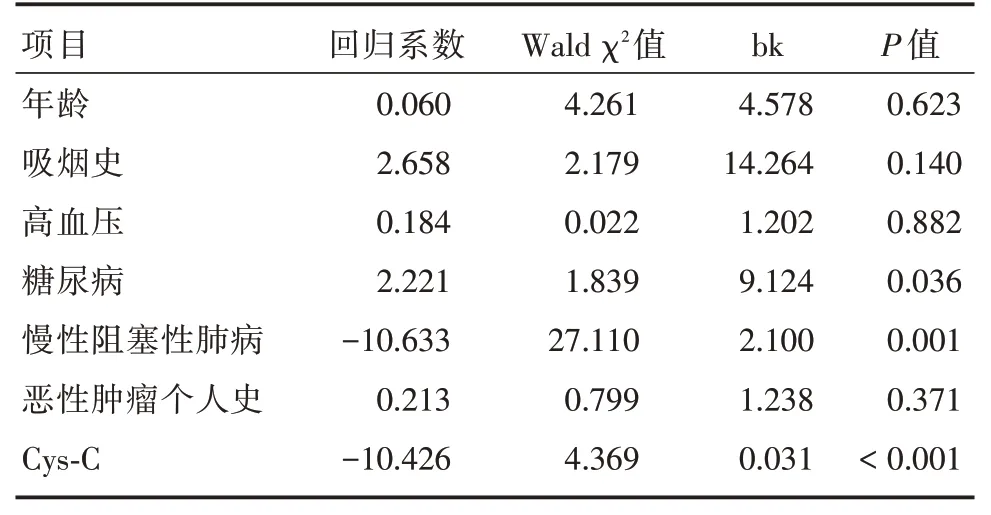
表2 COVID-19 患者死亡事件发生影响因素分析Tab.2 Analysis of influencing factors of death events in COVID-19 patients
3 讨论
COVID-19 属于新发呼吸道传染病,具有潜伏期长、传染性强特征。由于对该疾病认识不够,且尚无特效针对性药物治疗,防控仍是现阶段的主要工作。
Cys-C 是一种生成速度稳定且只通过肾脏代谢的低分子量非糖基化碱性蛋白,血液中Cys-C 水平不受年龄、体质量、性别、种族、饮食和肌肉含量等因素的影响[3-4]。Cys-C 涉及衰老、细胞死亡、细胞的增殖与迁移、白细胞介素和NO 的合成,参与炎性反应以及抗原加工和呈递的过程[5-6]。ZHANG 等[7]研究表明,在COPD 恢复期和急性加重期,Cys-C 与C 反应蛋白(CRP)呈正相关,且急性加重期COPD 患者Cys-C 水平显著升高。
新型冠状病毒属于冠状病毒谱系B(β-coronavirus Lineage B),其基因序列显示与严重急性呼吸系统综合征冠状病毒(SARS)、中东呼吸综合征冠状病毒(MERS)相似。研究[8-9]证实,新型冠状病毒可通过其表面刺突的S 蛋白与肺组织细胞膜上的血管紧张素转换酶2(ACE2)结合,侵袭宿主细胞,引起严重的炎症反应、氧化应激、细胞缺氧等。炎症损伤肺泡和肺毛细血管内皮细胞,导致肺泡微血管膜通透性增加,肺泡腔内渗出富含蛋白质的液体,进而导致肺水肿及透明膜的形成,这与XU 等[10]报道的COVID-19 患者死亡肺组织病理学检查结果一致,同时刘茜等[11]解剖COVID-19 死亡患者,发现其肺部炎性病变重,肉眼观呈斑片状,可见灰白色病灶及暗红色出血,切面可见大量粘稠的分泌物从肺泡内溢出,并可见纤维条索。生理条件下,Cys-C 的主要功能是抑制内源性的半胱氨酸蛋白酶的活性,参与细胞内外蛋白水解的调控,发挥胶原代谢作用,影响中性粒细胞的吞噬性和趋化性,参与并调节炎症反应。研究[12]发现,Cys-C 水平与IL-1β、IL-6、TNF-α及hsCRP 等微炎性反应指标呈正相关,并促使炎性反应的发生、发展。炎症介质的刺激促进弹性组织蛋白离解酶快速生成,使得具有促弹性组织离解特性的Cys-C 在动脉弹力蛋白损伤处过度表达[13]。因此在新型冠状病毒侵袭肺组织的这种病理状态下,Cys-C大量合成、释放,血清Cys-C 水平增加,调节从坏死或炎症细胞释放出来的组织蛋白酶活性。本研究结果显示,B 组患者中,确诊当日的Cys-C 水平明显高于A 组,且Cys-C 水平低的患者在ICU 住院时间较短,预后较好。Cox 风险回归分析也显示,Cys-C 是COVID-19 患者转归时间及预后的影响因素。另外,COVID-19 患者由于缺氧或高碳酸血症降低肾血流量,引起急性肾损伤(AKI);也有研究指出COVID-19 相关的炎症效应可直接损伤心脏、肾脏等器官[14-15],Cys-C 是早期肾损伤的敏感指标,可用于判断肾脏受损情况,警惕早期肾损伤,及时进行临床干预。本次研究发现B 组Cys-C、肌酐水平显著高于A 组。
此外,本次研究发现COPD 和糖尿病是COVID-19 患者预后情况的独立危险因素。无论COPD 处于稳定期或急性加重期,肺部本身存在不同程度的炎症反应,一旦感染新型冠状病毒,炎症介导急性肺损伤,发生呼吸衰竭、急性呼吸窘迫综合症(acute respiratory distress syndrome,ARDS),致使多器官功能障碍甚至死亡。血管病变是糖尿病最为严重的并发症,可累及全身微血管及大血管,COVID-19 患者的血管壁可能某种程度上参与了炎症反应,同时各种炎性因子使血管收缩和末梢毛细血管痉挛,末梢循环障碍,细胞缺氧释放更多炎性因子,加重了靶器官损伤。
目前,对于COVID-19 的认识及治疗,在临床实践中还应不断探索和完善。本研究发现Cys-C水平可提示患者的预后情况,且糖尿病和COPD慢性疾病史可影响COVID-19 患者的预后。笔者建议在COVID-19 的临床诊疗过程中,密切监测Cys-C 水平,同时对于糖尿病、COPD 患者需高度警惕。当然该结论仍需大量的临床资料进一步论证。
