TLR4基因敲除对脓毒症小鼠急性肝损伤的影响
2020-07-01陈赛男谭迎肖筱婵李乾吴起董茂龙
陈赛男 谭迎 肖筱婵 李乾 吴起 董茂龙
南方医科大学南方医院(广州510515)
脓毒症是由感染引起的可导致多器官损伤的全身炎症反应性综合征,是重症监护病房患者死亡的最常见原因。脓毒症所致的急性肝损伤是一个复杂的病理生理过程,涉及一系列分子和信号传导途径,包括炎症,细胞凋亡和坏死[1]。研究[2-3]表明Toll样受体(TLR)家族是介导脓毒症急性肝损伤发生损伤作用的重要分子机制之一。Toll样受体4(TLR4)可通过结合脂多糖(LPS),激活肝内的库普弗细胞释放各种炎症介质,引起肝细胞的凋亡或坏死,从而导致肝损伤[4-5]。因此,本研究通过建立LPS诱导的脓毒症小鼠模型来研究TLR4基因敲除对脓毒症急性肝损伤的影响,并探讨其中的相关机制。
1 材料与方法
1.1 实验动物及模型制备雄性C57 小鼠和雄性TLR4基因敲除小鼠各32只,体质量为20~25 g,C57小鼠购于南方医科大学实验动物中心,TLR4 基因敲除鼠购于南京大学模式动物研究所。所有小鼠在实验前均寄养在南方医科大学动物实验中心饲养,整个实验遵从南方医科大学动物实验伦理委员会要求进行。将64 只小鼠随机均分为普通小鼠对照组(WT),普通小鼠模型组(WT-LPS),TLR4基因敲除小鼠对照组(TLR4-/-),TLR4基因敲除小鼠模型组(TLR4-/--LPS)。模型组按LPS(4 mg/kg)予以该组小鼠腹腔内注射,对照组予以等量体积的生理盐水腹腔注射。给药6 h 后处死所有小鼠[6],并进行以下所有检测。
1.2 主要试剂脂多糖(美国Sigma 公司),蛋白氧化羰基检测试剂盒(索莱宝生物科技有限公司),天冬氨酸蛋白水解酶3 活性检测试剂盒(贝博生物科技公司),抗GAPDH、BAX 和BCL-2 抗体(CST 公司),GOT(AST)、GPT(ALT)试剂盒(南京建成生物工程研究所)。
1.3 实验方法
1.3.1 一般生理特征检测
1.3.1 体质量、肝重及肝体比测定采用ES-500E电子天平对小鼠进行称重并记录,然后取出实验小鼠的肝组织,对肝组织称重并记录,计算肝体比(肝体比=肝重/体质量)。
1.3.2 肝生化指标检测无菌条件下,在腹腔注射LPS或生理盐水6 h后抽取小鼠心脏血液2 mL[6],在4 ℃,3 000 g 转速的离心机中离心15 min 后取得血清样品,按试剂盒操作说明书将血清样品加入96 孔板中,室温放置15 min,然后用酶标仪测量510 nm处的OD值,由标准曲线求得AST/GOT、ALT/GPT 活力单位。
1.3.3 肝脏HE 染色无菌条件下取新鲜右叶肝组织2 g,PBS 清洗,经4%多聚甲醛溶液固定,常规石蜡包埋,连续切片,厚度约4 μm,行HE 染色,荧光倒置显微镜下观察肝组织病理学改变。参照SUZUKI 等[7]的标准进行肝脏组织学评分。
1.3.4 蛋白氧化羰基检测用蛋白氧化羰基检测试剂盒检测肝组织中氧化羰基蛋白水平,操作严格按照试剂盒说明书进行。
1.3.5 Caspase3 活性检测用Caspase3 活性检测试剂盒检测肝组织中Caspase3 活性水平,操作严格按照试剂盒说明书进行。
1.3.6 Western Blot 检测将500 mg 肝组织在1×RIPA 裂解缓冲液中充分匀浆并在4 ℃下以12 000 r/min 离心15 min。采用BCA 蛋白测定法用于测量上清液中的蛋白质浓度。定量为50 μg的蛋白质上样,经12%SDS-PAGE 凝胶上分离,并转移到PVDF膜上,经牛奶封闭后分别加入兔抗小鼠Bcl-2 抗体(1∶1 000),BAX 抗体(1∶1 000)以及GAPDH 抗体(1∶1 000),4 ℃过夜,取出PVDF 膜后用TBST 漂洗3 次,每次15 min,然后分别加入山羊抗兔型IgG(1∶10 000)在室温下孵育1 h。洗膜后进行显影,测定其灰度值,并用对应的GAPDH 条带强度对目的蛋白条带进行归一化,目的蛋白的相对表达强度=目的蛋白的吸光度值/GAPDH 的吸光度值。
1.4 统计学方法采用Graphpad 统计软件对数据进行分析,计量资料表示为()。 数据服从正态分布及方差齐性,行单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 一般生理特征与肝功能比较与WT 组相比,WT-LPS 组小鼠的肝重和肝体比以及血浆ALT、AST 均显著升高(P<0.05),TLR4-/--LPS 组较WTLPS 组明显降低(P<0.05),WT 组与TLR4-/-差异无统计学意义(P>0.05)。见表1。
表1 4组小鼠体质量、肝重和肝体比以及肝生化指标比较Tab.1 Comparison of body weight,liver weight,BW/LW and biochemical biomarkers of mice in 4 groups ±s

表1 4组小鼠体质量、肝重和肝体比以及肝生化指标比较Tab.1 Comparison of body weight,liver weight,BW/LW and biochemical biomarkers of mice in 4 groups ±s
注:与WT 组比较,*P <0.05;与WT-LPS 组比较,#P <0.05
组别体质量(g)肝重(g)肝体比(mg/g)AST(UI/L)ALT(UI/L)WT 组22.70±0.50 1.32±0.02 58.10±1.30 24.30±6.87 28.90±9.26 WT-LPS 组22.90±0.80 1.57±0.03*68.40±1.40*189.25±25.16**215.98±27.99**TLR4-/-组23.10±0.20 1.33±0.03 57.50±1.40 16.24±5.05 24.39±7.40 TLR4-/--LPS 组23.60±0.40 1.43±0.04#60.60±1.20#88.44±23.99##88.19±30.42##
2.2 肝脏病理检查结果分析WT组小鼠肝脏基本正常(图1A)。WT-LPS 组小鼠肝脏细胞排列紊乱,体积增大伴炎性浸润,肝组织内可见明显点灶状坏死(图1B)。TLR4-/--LPS 组小鼠肝脏细胞坏死病灶缩小,脂肪空泡和炎性细胞浸润减少(图1C、D)。与WT组相比,WT-LPS 组病理分数显著增高(P<0.01),WT 组与TLR4-/-差异无统计学意义(P>0.05),而TLR4-/--LPS组较WT-LPS组降低(P<0.05,图1E)。

图1 4 组小鼠的肝组织形态学比较(HE 染色)Fig.1 Comparison of liver histomorphology in 4 groups of mice(HE staining)
2.3 蛋白氧化羰基检测和Caspase3 活性检测结果分析与WT 相比,WT-LPS 组小鼠肝组织中的蛋白氧化羰基含量和Caspase3 活性水平明显增高(P<0.05),而TLR4-/--LPS 组较WT-LPS 组显著降低(P<0.05,图2、3)。

图2 4 组小鼠的肝脏组织蛋白氧化羰基含量比较Fig.2 Comparison of carbonyl proteins of liver tissue in 4 groups of mice

图3 4 组小鼠的肝脏组织Caspase-3 活性水平比较Fig.3 Comparison of caspase3 activity of liver tissue in 4 groups of mice
2.4 凋亡相关分子BCL-2 和BAX 的表达比较与WT 组相比,WT-LPS 组小鼠的BCL-2 表达显著降低(P<0.05),相反,其BAX 表达显著升高(P<0.05);而与WT-LPS 组对比,TLR4-/--LPS 组小鼠的BCL-2 表达升高(P<0.05)。相反,其BAX 表达降低(P<0.05,图4、5)。
3 讨论
随着临床诊疗技术的不断发展,重症患者的治愈率得到了很大提高,但感染所引起的全身多器官衰竭即脓毒症(Sepsis)仍然是造成重症患者死亡的重要原因。肝脏作为人体免疫、代谢、解毒等重要功能的器官,是脓毒症早期易侵及损伤的器官之一[8-9]。众所周知,TLR4 是固有免疫中炎症信号转导途径中的关键因素[10]。本研究成功运用LPS 建立脓毒症急性肝损伤模型,并首次使用TLR4 基因敲除小鼠来观察TLR4 在脓毒症急性肝损伤中产生的作用。结果显示野生型LPS 组小鼠肝损伤表现明显;与WT-LPS 组比较,TLR4-/--LPS 组小鼠肝损伤减轻,Caspase3 活性和氧化羰基水平下降,凋亡蛋白标志物表达比值下降。
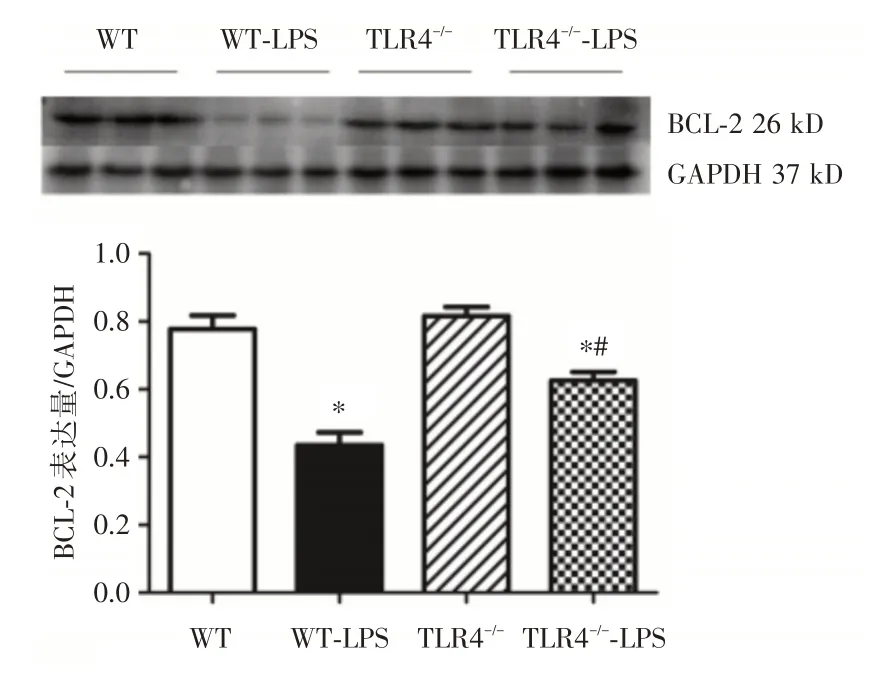
图4 4 组小鼠的肝脏组织BCL-2 表达的结果(Western Blot检测)Fig.4 BCL-2 expression of liver tissue in 4 groups of mice(Western Blot assay)
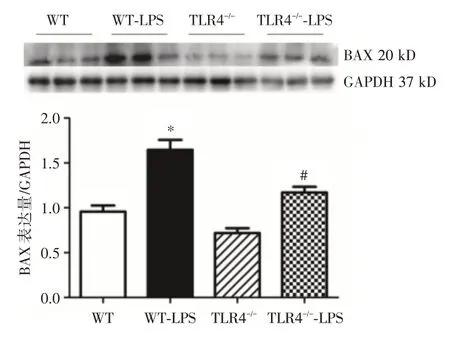
图5 4 组小鼠的肝脏组织BAX 表达的结果(Western Blot 检测)Fig.5 Bax expression of liver tissue in 4 groups of mice(Western Blot assay)
TLR4 通过与脂多糖结合可以识别外源病原体,刺激抗菌肽的产生并诱导非特异性免疫反应[11-12]。脓毒症时内毒素进入血液循环后识别Toll 样受体,从而启动靶基因的转录和表达,继而刺激血管内皮系统和免疫系统,并激活下游通路释放多种炎性反应因子,形成瀑布式反应,使得组织凋亡增加,最终导致肝脏甚至全身多器官功能损伤[13]。最近的研究已证实TLR4的抗体,抑制剂、拮抗剂或基因敲除会影响其乙酰化,二聚化以及上游配体的识别,也可能会抑制下游信号的激活,从而影响细胞功能[14]。也有研究表明可以通过抑制肺组织中TLR4 下游信号分子NF-κB 信号通路的异常激活来减轻LPS 诱导的小鼠肺组织炎症反应和损伤[15]。本研究在肝脏HE 染色中观察到WT-LPS 组大量肝细胞变性,而TLR4-/--LPS 组肝细胞变性减轻中,这提示TLR4 基因敲除可以减轻LPS引起的急性肝损伤。
细胞凋亡是细胞死亡的形式之一,是机体维持自身稳定的一种基本生理机制。细胞凋亡的发生有赖于相关基因的表达和蛋白质的合成。脓毒症时内毒素首先刺激肝库普弗细胞分泌TNF-α,再通过其下游多条信号通路转导将凋亡信号传递至Caspase3 并使其活化,最终诱导肝细胞凋亡[16]。细胞凋亡是由多种因子或蛋白参与的复杂的病理生理过程,其中抗凋亡蛋白(Bcl-2、Bcl-xl 等)与促凋亡蛋白(如Bax、Caspase3 等)相互作用失衡尤为重要[17-19]。在LPS 诱导的脓毒症急性肝损伤模型中,经典的TLR4/MyD88/NF-κB 通路可通过刺激炎症因子的释放导致细胞和组织的凋亡和坏死增多,从而发挥组织损伤作用[20]。本研究结果显示,对比WT 组,WT-LPS 组小鼠肝组织中的Caspase3活性增高以及Bax 表达增高,而Bcl-2 表达降低;TLR4-/--LPS 组小鼠的Caspase3 活性水平和Bax 较WT-LPS 组降低,Bcl-2 表达增高,这提示LPS 可诱导凋亡,而TLR4 基因敲除可能通过抑制凋亡通路的激活来减轻LPS 诱导的脓毒症小鼠肝脏的损伤。
综上,本研究首次证实了TLR4 敲除可以通过抑制凋亡减轻LPS 诱导的脓毒症小鼠急性肝损伤,为靶向干预TLR4 基因治疗脓毒症急性肝损伤提供了有力的依据,亦为深入探讨脓毒症急性肝损伤的疾病发展提供了参考。但本课题组对TLR4 基因敲除后通过何种信号通路抑制凋亡尚未明确,因而,深入研究相关的分子机制是本课题组接下来着重的研究方向。
