主髂动脉瘤合并恶性肿瘤治疗方式与时机的选择
2020-07-01孙继翔李追任为
孙继翔,李追,任为
(重庆医科大学附属第一医院 血管外科,重庆)
0 引言
腹主动脉瘤/髂动脉瘤(AAA/IAA)与恶性肿瘤均为威胁我国老年患者的重要疾病,具研究表明,50 岁以上人群中AAA 患病率男性4%-8%,女性0.5%-1%[1-2],IAA 的发病率约 0.1%-1.9%[3], 2018 年我国共有 480万新增肿瘤患者,290 万因肿瘤死亡患者[4]。约0.49%-2.1%主/髂动脉瘤患者合并有恶性肿瘤[5],目前缺乏询证医学证据来指导这一患群的治疗。本研究回顾性分析我科历年收治的腹主动脉/髂动脉瘤合并恶性肿瘤患者的治疗策略,旨在于为这一疾病的治疗提供参考。
1 资料与方法
1.1 一般资料
选取2012 年10 月至2018 年12 月重庆医科大学附属第一医院血管外科经治的腹主动脉/髂动脉瘤合并恶性肿瘤患者20 例。其中男性17 人,女性3 人。平均年龄(75.47±8.17)岁,具体构成可见表1。
泌尿系统肿瘤6 例,胃肠道肿瘤6 例,喉癌2 例,肝癌、卵巢癌、颅内肿瘤、鼻前庭细胞癌、肺癌、腹膜后软组织肉瘤各1 例。
1.2 诊断标准
腹主动脉瘤:腹主动脉局限性扩张至3.0 cm 以上,或较原直径增大1.5 倍以上。
髂动脉瘤:髂动脉局限性扩张至2.5 cm 以上,或较原直径增大1.5 倍以上。
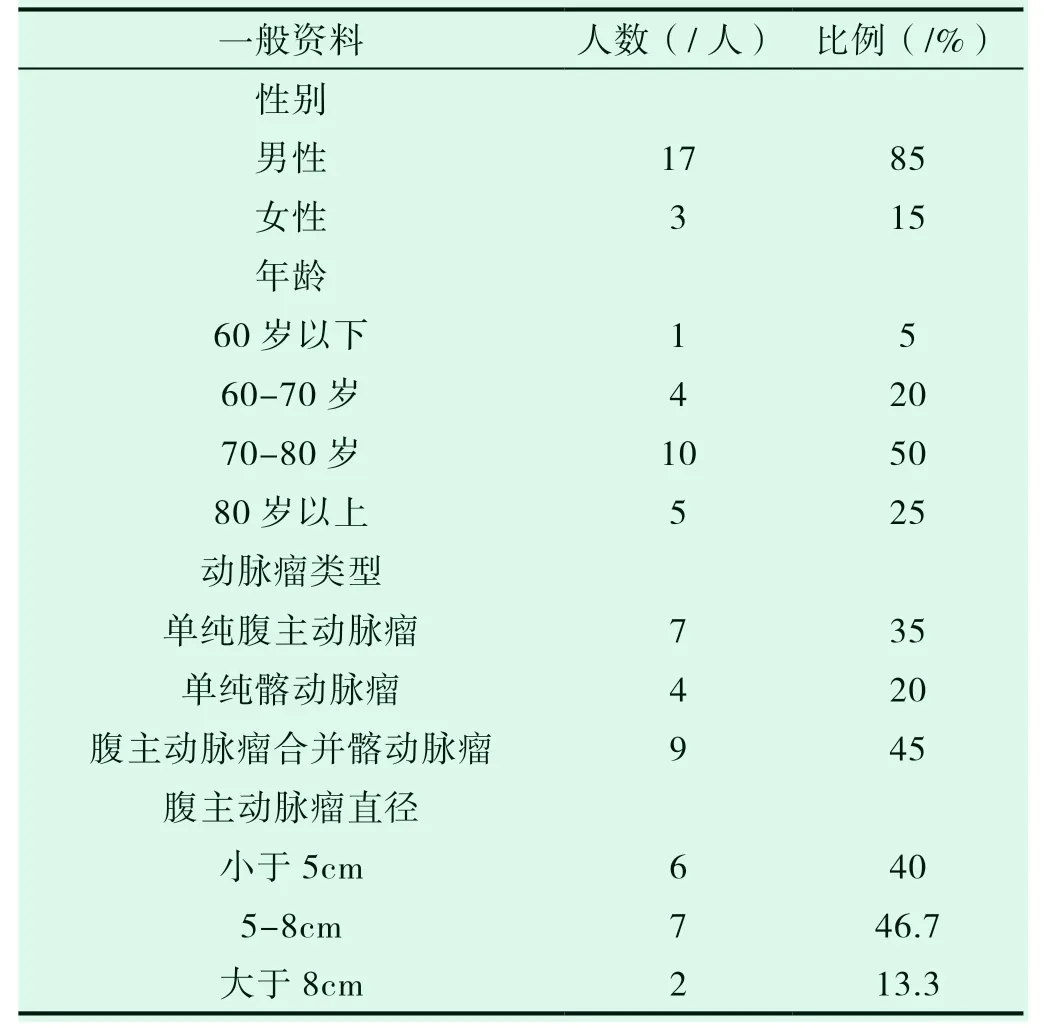
表1 AAA/IAA 合并恶性肿瘤患者构成比
恶性肿瘤:CT/MRI 等影像学资料诊断,接受手术者通过术后病检确诊。
1.3 治疗方式:
动脉瘤:开放手术(open repair, OR)动脉瘤切除+ 人工血管置换/ 介入手术(endovascular aneurysm repair, EVAR)动脉瘤腔内隔绝术,恶性肿瘤:开放/腔镜下的肿瘤根治/减瘤手术
1.4 典型病例
1.4.1 双髂动脉瘤合并卵巢癌一例
患者67 岁老年女性,因“反复活动后心悸、胸闷6+月,加重5 天”入院;既往有高血压病史20+年,CT:双髂动脉瘤样扩张。盆腔可见巨大囊性包块。先于我科行双髂动脉支架置入术。后于妇科先行肿瘤部分减体术以明确肿瘤性质及来源,术后病检示:<右附件>高级别浆液性腺癌。后经两次化疗后,再次腹腔镜下再次行广泛全子宫+ 双侧附件切除。术后每3 月复查CT:各支架支撑良好,管腔通畅,盆腔未见肿瘤复发征象。
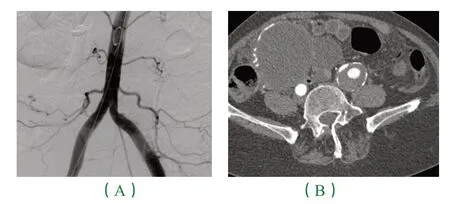
图1注:(A)术前CT 可见左髂总动脉瘤样扩张,同时可见盆腔内巨大包块;(B)术后造影可见双髂动脉分别置入覆膜支架后血流通畅,未见明显内漏。
1.4.2 喉癌合并腹主动脉瘤一例
患者78 岁老年男性,因“突发剧烈腹痛2 天”入院。3 年前发现喉癌伴腹主动脉瘤,当时于外院喉癌根治术,入院体格检查:血压90/50mmHg,脐左侧可轻触及明显搏动性包块,大小约10×10cm。CT 提示腹主动脉瘤,先兆破裂。立即于我科急诊行腹主动脉造影+腹主动脉支架植入+双髂动脉支架置入+弹簧圈栓塞术。手术顺利,术后血压稳定。

图2注:(C) 术前CT 可见其腹主动脉明显彭大;(D) 术后造影可见支架位置良好,未见明显内漏。
1.5 研究方法
回顾性研究2012.10 至2018.12 重庆医科大学附属第一医院血管外科经治的腹主动脉/髂动脉瘤合并恶性肿瘤患者20 例,搜集分析其临床表现,CT、DSA图像,手术方式等临床资料,并随访至2019 年12 月。
2 结果
本组腹主动脉/髂动脉瘤合并恶性肿瘤患者共20例,6 人放弃治疗,14 例接受治疗,仅1 例腹膜后恶性肿瘤与腹主动脉人工血管置换术同期手术。先处理动脉瘤(EVAR 术)一周后处理肿瘤6 例,先处理恶性肿瘤后择期处理动脉瘤(EVAR 术)2 例。仅处理动脉瘤(EVAR 术)3 例,仅处理恶性肿瘤 2 例。
接受治疗的14 例患者,1 例腹膜后恶性肿瘤与腹主动脉人工血管置换术术后3d 死于多器官功能衰竭。13 例出院患者,随访率100%。随访时间5-53 月,平均随访时间31.2(±11.8)月。总生存率84.2%(11/13),随访期内死亡 2 例(15.8%)。1 例患者术后2 月出现支架远端新发夹层,保守治疗1 年后夹层自行消失,余患者均无支架内血栓形成、内漏等并发症。具体治疗及随访情况见表2。
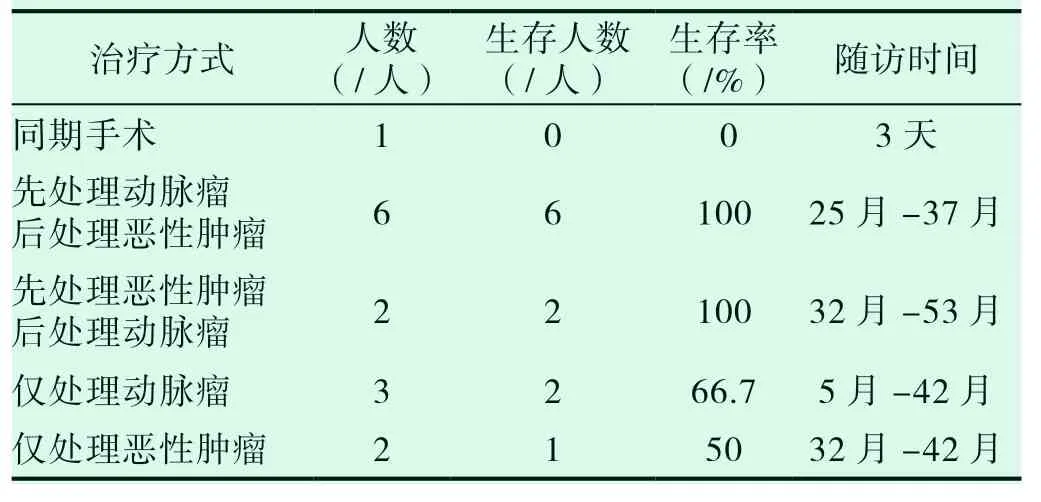
表2 AAA/IAA 合并恶性肿瘤患者随访结果
3 讨论
腹主动脉瘤/髂动脉瘤(AAA/IAA)与恶性肿瘤均为威胁人民生命健康的重大疾患,治疗难点首先在于治疗方案的选择:首先处理动脉瘤或处理恶性肿瘤,亦或是同期处理;对于动脉瘤,使用DSA 下腔内隔绝术还是开放人工血管置换;对于恶性肿瘤是采取开放/腹腔镜下根治性切除还是姑息性处理,都是考验外科医生对患者病情的正确把握。
通常情况下,对于同时存在两种疾病的患患者,因首先处理对生命威胁较大的疾病。而AAA/IAA 一但发生破裂,死亡率高达80%[6]。其治疗方式主要分为OR 及EVAR,而OR 需要全身麻醉,手术时间长,创伤大,出血多等风险,其围手术期死亡率高达25%[7]。根据国内外包括邹君杰、安乾、Desgranges、Burgers 等人的研究均显示EVAR 术围手术期死亡率,并发症发生率,均较OR 术明显降低,而术后远期生存率无明显差异[8-11]。故对于基础疾病多,一般情况差,对手术创伤耐受能力差的老年患者而言,腔内隔绝术相对于开放手术而言,手术创伤小,术后恢复快,内脏缺血时间短,故腔内介入治疗应该作为优先选择。最新的AAA 治疗循证指南也推荐EVAR 作为首选[12]。
对于同时患有AAA/IAA 及恶性肿瘤的患者,以本文中的病例为例,腹腔、盆腔内恶性肿瘤占了大部分,肿瘤位置与腹主动脉、髂动脉毗邻,若优先处理恶性肿瘤,那么在手术过程中,无论是腔镜手术中填充气腹,亦或是开放手术过程中的牵拉、术中出血导致的血压波动等,都容易导致动脉瘤破裂出血,危及患者生命。因此,为了降低动脉瘤破裂出血,增加肿瘤切除手术的安全性,我们大多会优先处理动脉瘤,后处理恶性肿瘤。本文中共有6 例患者先通过介入治疗处理动脉瘤,而后行恶性肿瘤的手术治疗,手术成功率100%,术后随访期生存率100%。Zhangbo、宁俊杰、lllumitnati Giulio 等也报道了先行动脉瘤,而后处理恶性肿瘤的病例[5,13,14]。
有学者认为可以通过开腹手术同时处理动脉瘤及恶性肿瘤,国内外包括Yoshihiko Tsuji、候铸等学者报道均过相关病例[15-16],但无法否认的是,同期手术可能面临的麻醉时间长,手术创伤大,术中出血多,围手术期并发症多,以及术中、术后人工血管感染等风险,本研究中仅一例患者采用了同期手术,术后3 天因MODS死亡。
亦有学者认为,对于直径小、破裂风险较低的动脉瘤(AAA/IAA),我们可以优先处理恶性肿瘤,同时定期随访动脉瘤的发展过程。但正如上文提到的在恶性肿瘤的手术过程中,动脉瘤破裂风险大大提高,且动脉瘤的增长不可逆,增长速度平均2.5mm/年[17],与瘤体直径正相关,瘤体直径越大,增长速度越快,当在瘤体直径>6cm, 瘤体增长将达到7-8mm/ 年[18],瘤体最终破裂率也增加到40%。本文中的典型病例2 即为一例先行恶性肿瘤术后未处理动脉瘤,后腹主动脉瘤进行性生长,最终发生先兆破裂,危及患者生命。
对于通过腔内治疗动脉瘤后,间隔多久行恶性肿瘤的治疗,目前国际上无明确共识,根据现有的Kihara Kazuki、Bruno Amato 等人的个案报道,在不考虑恶性肿瘤术前新辅助化疗的情况下,间隔时间在1d-30d 不等[19-20]。肾功能正常患者血肌酐 (creatinine, Cr) 、血尿素氮 (blood urea nitrogen, BUN) 在术后3-7 天可降至术前水平。同时大动脉支架无需常规抗凝治疗,考虑恶性肿瘤为限期手术,应及早进行,且腔内治疗具有创伤小、恢复快的有点,可在腔内治疗处理AAA/IAA后1 周左右处理恶性肿瘤。
综上所述,恶性肿瘤的治疗,目前仍以根治/姑息性切除为主要手段,动脉瘤则存在开放手术及EVAR两种治疗方式。对于AAA/IAA 同时合并恶性肿瘤的患者目前世界上尚未有一个公认的指南或治疗原则。同期行人工血管置换及肿瘤根治术,手术时间长、出血风险高、术后感染发生率高,而先行肿瘤根治术,后处理动脉瘤,则面临术中、术后动脉瘤破裂风险。故对于腹主动脉/髂动脉瘤同时合并恶性肿瘤患者,采取先行EVAR 术处理动脉瘤,后行肿瘤切除术更具备优势。
