胎盘间充质干细胞外泌体对大鼠卵巢早衰修复作用的研究
2020-07-01马丽丽杨玲玲杨海燕黎跳宁
马丽丽,杨玲玲,杨海燕,黎跳宁
(1.宁夏医科大学总医院,宁夏 银川;2. 宁夏医科大学生育力保持教育部重点实验室,宁夏 银川)
0 引言
随着肿瘤患者的治愈率和存活率的逐渐提高,放化疗引起的卵巢早衰(POF)严重影响育龄女性肿瘤患者的生殖及心理健康。目前尚无有效的治愈办法。近年来,外源性间充质干细胞( MSC) 疗法为包括POF 在内的各种难治性疾病带来了希望。国内外研究证实MSCs 携带的外泌体(exosomes)能够进入体内减轻组织损伤程度,促进受损组织的修复,是干细胞领域具有重要研究价值的新兴热点。本研究通过对POF 模型大鼠腹腔注射人胎盘间充质干细胞(human placenta derived mesenchymal stem cells,hpMSCs)外泌体,检测POF 大鼠卵巢功能,分析 hpMSCs 外泌体对大鼠卵巢功能的修复作用,为临床治疗POF 提供新的理论基础。
1 材料与方法
1.1 材料
本实验选择具有正常动情周期的SPF 级 SD 雌性大鼠60 只,10 周龄,体重200-220g。胎牛血清(Hyclone公司),exoEasyMaxiKit(德国 QIA-GEN 公司),ELISA试 剂盒购自R&D 公司,苏木精染色试剂盒(北京博奥森生物有限公司),其他试剂购自sigma 公司。
1.2 实验方法
按照实验室常规程序,SD 大鼠每日腹腔注射环磷酰胺,腔注射环磷酰胺首剂量为50mg/kg,维持剂量为8mg/kg,连续注射 14ds,建立 POF 模型组。
实验分为对照组,模型组和hpMSCs-EXO 治疗组。模型建造成功后,hPMSC-EXO 治疗组腹腔内隔日注射 150ug 外泌体蛋白(约 1×106hPMSC 产生),2周处死检测各种指标。
1.3 外泌体的提取与鉴定
培养P3 代hpMSCs 细胞融合至70-80% 时,更换无血清培养基,培养48h,收集细胞培养上清。取 10mL培养上清,采用 ExoQuickTM 按5:1 比例提取 Exosome;BCA 蛋白定量试剂盒检测 Exosome 蛋白含量;透射电镜下观察Exosome 的形态。
1.4 卵巢功能的测定
1.4.1 ELISA 法测定血清激素
取各组大鼠眶静脉血,严格按照ELISA 试剂盒测定各组大鼠血清 FSH 和E2 的浓度。按照仪器灵敏度和批间、批内变异系数测定各组样本,经仪器得出读数,于标准曲线中读出相应的浓度。
1.4.2 HE 染色法
颈椎脱位法处死大鼠,取卵巢,收集的卵巢经4% 多聚甲醛固定,石蜡包埋,切片常规苏木素- 伊红(HE)染色,观察卵巢组织及卵泡的形态,同时在光学显微镜下计数各个时期的卵泡数量,进行比较。
1.4.3 统计学方法
2 结果
2.1 HpMSCs 外泌体透射电镜下形态及蛋白表达
透射电镜下观察 Exosome 呈圆形或椭圆形的膜性小囊泡,大小不一,包膜完整,直径30~100nm,囊泡内有低密度电子存在,其周围有类脂膜性结构(图1)。经Western Blotting 分析后,hpMSCs 外泌体表达表面抗原标记物CD9、CD63 等,不表达Lamp1(溶酶体标志物)和Calnexin(内质网标志物),说明本研究提取的外泌体,无溶酶体与内质网成分(图2)。
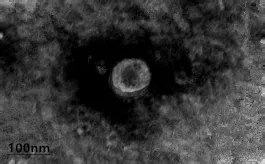
图1 透射电镜下 Exosome 形态(×25000)

图2 胎盘间充质干细胞及exsomes 相关标记物的 Western Blotting 条带图注:a 胎盘间充质干细胞;b 提取出的exsomes
2.2 HpMSCs 移植前后大鼠血清FSH、 E2 测定
HpMCs-EXO 治 疗 组 FSH 明 显 低 于 模 型组(P<0.05),E2 值明显高于模型组(P<0.05),二者与对照组相比均无显著性差异(P>0.05)。表明治疗组FSH、 E2 值均接近对照组水平。见表1。

表1 各组大鼠血清FSH、E2 水平
2.3 hpMSCs 移植前后各组卵巢卵泡计数
由表2 可以看出,相比POF 模型组,hpMCs-EXO治疗组卵巢内各级卵泡数目均有明显增加,组间差异有统计学意义(P<0.05)。

表2 各组大鼠卵巢卵泡计数比较
2.4 卵巢结构 HE 染色
HE 染色结果显示,hpMSCs-EXO 治疗组可见各级卵泡,成熟卵泡存在,见间质纤维化,坏死;未移植组结构混乱,有闭锁卵泡存在,组织开始纤维化,坏死(见图 3)。
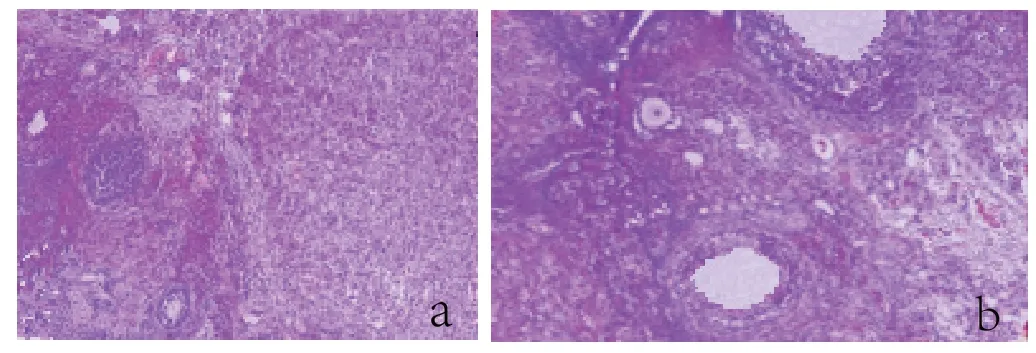
图3 卵巢HE 染色(×400)(a POF 组 b hpMSCs 治疗组)
3 讨论
干细胞移植治疗越来越多的被应用于改善及治疗某些疾病。hPMSCs 目前证实是干细胞的最佳来源。相较于其他干细胞,hPMSCs 具有来源方便,细胞数量充足,易于分离、培养、扩增和纯化,传代扩增30 多代后仍具有干细胞特性。研究证明[1-2]:hPMSC 分泌的细胞因子如血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、碱性成纤维细胞生长因子(bFGF) 和胰岛素样生长因子(IGF) 等可抑制已受损靶细胞的凋亡,修复已受损的组织细胞。NaYi[3]等研究报道hPMSC 可以使Akt 磷酸化,激活PI3K/Akt 信号通路,减少POF小鼠卵巢中颗粒细胞凋亡,从而改善卵巢功能。另有实验结果显示[4-5],hPMSC 在体内外能抑制化疗药物诱导的卵巢颗粒细胞凋亡,通过分泌抗氧化物质修复化疗所致卵巢损伤,部分改善卵巢发育微环境及内分泌功能,之后发现给环磷酰胺所致POF 的大鼠移植hPMSCs 后,可通过SIRT1/PGC1-a/Nrf2 信号通路激活,改善卵巢内分泌的功能,减少卵巢纤维化,提高卵巢抗氧化功能[6]。但与正常的卵巢功能还存在一定差距。
近年来有关细胞分泌的外泌体(exosomes)的功能和作用机制的研究已成为热点。exosomes 是一类直径在30-100nm,含有RNA 和蛋白质的囊泡,具有脂质双层膜结构,存在于机体几乎所有的体液中。SUN L 等[7]研究发现人脐带间充质干细胞(UCMSC)分泌的外泌体可以融入顺铂损伤的卵巢颗粒细胞,通过上调抗凋亡蛋白 Bcl-2 表达,下调促凋亡蛋白 Bax 表达,加速卵巢功能的恢复。Xiao 等[8]报道在化疗药物导致的POF大鼠模型中,来源于羊水间充质干细胞的外泌体,富含miR-146a 和 miR-10a 两种 microRNA(miRNAs),其中miR-146a 通过下调Irak1 和traf632 表达,miR-10a通过抑制Bim 表达,下调Caspase-9 表达,从而抑制颗粒细胞凋亡和减少卵泡闭锁,恢复损伤卵巢的功能。也有学者发现[9]人羊膜上皮细胞(hAEC) 外泌体通过转移功能性miRNA(如miR-1246)抑制化疗诱导的颗粒细胞凋亡,恢复POF 小鼠卵巢功能。
目前尚无hpMSCs 外泌体对POF 大鼠卵巢功能修复的研究报道。本实验用hpMSCs 外泌体移植修复化疗损伤大鼠卵巢,结果显示卵巢内各级卵泡数目均有明显增加,证实了hpMSCs 外泌体能够通过旁分泌的方式发挥对化疗所致卵巢损伤的保护作用。但外泌体究竟通过何种机制发挥其改善卵巢功能的生物学效应,需要后续进一步的实验研究。
