哈茨木霉协同秸秆对马铃薯黑痣病及根际土壤微生态的影响
2020-07-01郭成瑾沈瑞清张丽荣王喜刚张树武徐秉良
郭成瑾 沈瑞清 张丽荣 王喜刚 张树武 徐秉良
(1甘肃农业大学植物保护学院/甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070;2宁夏农林科学院植物保护研究所/宁夏植物病虫害防治重点实验室,宁夏 银川 750002)
木霉属(Trichoderma)真菌广泛分布于自然界,可通过竞争、重寄生和诱导抗性等多种途径对植物病原菌产生抑制作用[1]。在人为可控条件下,木霉菌对多种植物病害具有良好的控制效果。然而,在实际应用中却存在着防治效果不稳定的现象。这主要是因为土壤普遍对真菌存在抑制作用,降低了木霉菌孢子的萌发率,影响了木霉菌在土壤中的定殖和生防效果[2]。研究表明,通过添加外源营养物质,可在一定程度上减轻土壤对木霉菌的抑制作用[3]。
我国秸秆资源丰富,秸秆中蕴含着丰富的营养物质,如氮、磷、钾等[4]。研究表明,秸秆还田能够提高土壤有机质含量、土壤酶活性,以及土壤微生物群落数量,增加作物产量[5-6]。木霉菌利用农作物秸秆作为载体,不仅能促进木霉菌产孢[7],而且可加速秸秆腐熟[8],进而产生更多的营养物质,促进植物生长,提高植物抗性[9]。
马铃薯黑痣病是宁夏回族自治区(以下简称“宁夏”)马铃薯主产区重要的土传病害之一,其防治措施主要依靠化学防治,但化学农药对土传病害防治效果却不理想,容易造成农药残留,破坏土壤环境,同时又会使病原菌产生抗药性[10]。研究表明,马铃薯土传病害的发生与植物根际土壤微生物生态失衡密切相关,主要表现在土壤微生物区系由“细菌型”向“真菌型”转变[11],土壤中致病菌数量增加[12],土壤微生物群落多样性发生改变等[13]。农作物秸杆配施生防菌不仅可以改善作物根际土壤微生物群落结构,还能减少病原菌数量,提高病害防治效果[14-15]。本研究以分离自极端干旱沙漠地区的哈茨木霉(Trichodermaharzianum)M-33 菌株为对象,通过测定其对立枯丝核菌(Rhizoctonia solani)的拮抗作用,研究添加秸秆后哈茨木霉M-33 菌株对马铃薯黑痣病的防治效果,及其对马铃薯植株生长和马铃薯根际土壤微生物区系的影响,探讨哈茨木霉M-33 菌株防病促生作用及其机理,以期为哈茨木霉M-33菌株的实际应用提供理论支撑。
1 材料与方法
1.1 试验材料
供试菌株:哈茨木霉M-33(保藏编号为CCTCC NO:M2018537),立枯丝核菌。供试菌株均保存于宁夏农林科学院植物保护研究所病理室。哈茨木霉M-33培养液采用LM 液体培养基,28℃、120 r·min-1培养5~7 d,孢子浓度达到1×108个·mL-1时备用。
供试秸秆:小麦秸秆,取自宁夏银川市平吉堡。
供试马铃薯:品种为大西洋,由六盘山薯业提供。选择表面带有明显立枯丝核菌的种薯,病级为3 级。
供试土壤:壤土,pH 值8.2,有机质含量15.8 g·kg-1,取自宁夏西吉县新营乡。土壤中添加育苗基质(70 g·kg-1)、有机肥(58 g·kg-1)充分混匀后,装入花盆中待用。
供试培养基:LM 液体培养基(蜂蜜20 g、酵母粉5 g、FeSO4·7H2O 0.1 g、MgSO4·7H2O 1.25 g、KH2PO44 g、NaNO37 g、蒸馏水1 000 mL)。木霉选择性培养基(葡萄糖10 g、蛋白胨5 g、MgSO40.5 g、KH2PO41 g、琼脂粉10 g、蒸馏水1 000 mL),将各种成分溶解在水里,加热沸腾后加入1%孟加拉红3.3 mL,然后分装灭菌;使用前待培养基冷却至40~45℃,加入1%链霉素0.3 mL,40%五氯硝基苯可湿性粉剂0.1 g。
1.2 试验设计
本试验于2017年在宁夏农林科学院植物保护研究所日光温室中进行。试验设置协同处理(哈茨木霉M-33 培养液加入小麦秸秆,T33W)、哈茨木霉M-33培养液(T33)、LM 液体培养基加入小麦秸秆(W)、40%五氯硝基苯可湿性粉剂(PN)、对照(CK)共5 个处理。每盆播种3 块薯块,每个处理9 盆,3 次重复。T33W 处理方法:将盆土中部挖直径20 cm、深度15 cm的播种坑,将20 mL 哈茨木霉M-33 培养液浇入50 g灭菌小麦秸秆中,配制成混合物,约含哈茨木霉M-33有效活菌数3.4×105个·g-1,每盆穴施13.5 g 混合物;T33 处理方法:将1 mL 哈茨木霉M-33 培养液加入100 mL LM 液体培养基中混匀进行穴施,哈茨木霉M-33 有效活菌数为1×106个·g-1;W 处理方法:将100 mL LM 液体培养基浇入13.5 g 小麦秸秆中混匀进行穴施。PN 处理方法:40%五氯硝基苯可湿性粉剂按1∶20 比例与土混匀后穴施;CK 不做任何处理。所有处理完毕后,将带菌薯块播入坑中,覆土,于日光温室内培养。白天温度控制在25~28℃,夜间温度控制在18~20℃,每隔3 d 浇水1 次。
1.3 试验方法
1.3.1 哈茨木霉M-33 对立枯丝核菌拮抗作用机制
作者简介:庄顺火,男,汉族,福建南靖人,南靖县船场中心梧宅小学教师,小学语文一级教师,大专学历,研究方向:小学语文教育。
采用平皿对峙培养法,测量立枯丝核菌对照半径(Rc)和处理立枯丝核菌菌落朝哈茨木霉M-33 菌落方向扩展的半径(Rp),计算抑菌率:

用灭菌刀片切取PDA 上两菌接触部位菌丝块,经过多次固定、漂洗、脱水、干燥后,采用离子溅射镀膜法制备电镜测试样本,最后放于SU8100 扫描电子显微镜(HITACHI 公司,日本)下观察采图。
1.3.2 马铃薯黑痣病防治效果测定 于马铃薯播种时调查播种数,播种后30 d 调查各处理出苗数,计算出苗率:

于收获期调查薯块黑痣病发病情况,每个处理按照马铃薯黑痣病分级标准[16]记录薯块病级数,计算病情指数:
1.3.3 马铃薯生长指标测定 于成株期测定马铃薯的株高、茎粗和分枝数。株高用直尺量取主茎从地表到心叶的高度,茎粗用游标卡尺在离地面1 cm 处采用十字交叉法的方式量取,分枝数用目测法。
1.3.4 根际土壤可培养微生物及木霉菌数量测定 于收获期拔出马铃薯植株,将附于根系上的土壤抖落,装入自封袋,4℃保存。采用稀释平板法测定马铃薯根际土壤微生物数量,采用稀释平板涂布法测定木霉菌数量。细菌培养采用牛肉膏蛋白胨琼脂培养基;真菌培养采用改良马丁氏孟加拉红培养基;放线菌培养采用改良高氏1号培养基;木霉菌培养采用木霉选择性培养基。以1 g 鲜土所含微生物菌落形成单位数量(CFU·g-1)表示菌落数量结果。
1.3.5 根际土壤微生物区系变化分析 采集土样方法同上,5 个处理,3 次重复,共计15 个样品,-80℃保存。依托北京诺禾致源生物信息有限公司Illumina Hiseq 平台,对各处理土壤DNA 的真菌内转录间隔区(ITS)的ITS2 区和细菌16S rRNA 基因的V4 区进行扩增测序。
使用QIIME 软件对下机后的原始序列进行拼接、过滤等处理得到有效数据。在UPARSE 中分析后,利用USEARCH Pipline 生成OTU 表格并选取代表性序列,去除质控分数低于0.5、长度低于200 bp 的序列和单序列。使用RDP 数据库对获得的OTU 有效序列分类注释,真菌和细菌分类分别对应UNITE Fungal ITS数据库和RDP 16S rRNA 数据库。将上述获得的OTU 表转化成合适格式后,使用mothur 软件进行多样性分析,α-多样性分析包括菌群多样性指数(Shannon-Wiener 多样性指数)和菌群丰富度指数(Chao1 指数),β - 多样性分析为主坐标分析(principal co-ordinates analysis,PCoA)。同时,根据所有样本在属水平的物种注释及丰度信息,选取丰度排名前20 的属,根据其在每个样本中的丰度信息,制表列出并分析。
1.4 数据处理
采用Microsoft Office Excel 2013 软件进行数据统计,DPS 3.1 软件进行数据分析,Duncan 新复极差法进行方差分析(P<0.05)。
2 结果与分析
2.1 哈茨木霉M-33 对立枯丝核菌拮抗作用机制研究
平皿对峙法测定结果表明,接种2 d 后,哈茨木霉M-33 菌丝与立枯丝核菌菌丝发生明显的接触;接种4 d后,哈茨木霉M-33 占领全部营养空间,并在立枯丝核菌菌落上产生大量孢子(图1-c)。立枯丝核菌处理平均半径为16.67 mm,立枯丝核菌对照平均半径为43.33 mm,抑制率为61.53%。这说明哈茨木霉M-33对立枯丝核菌具有空间竞争作用。
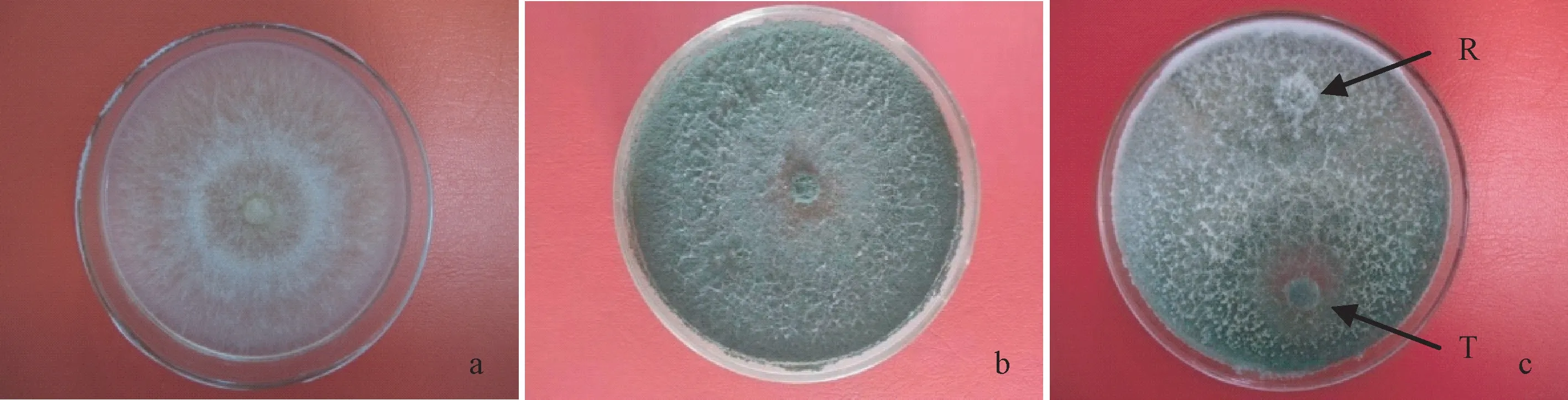
图1 哈茨木霉M-33 与立枯丝核菌的纯培养和对峙培养Fig.1 The single culture and dual culture on T.harzianum M-33 and R.solani
扫描电镜观察发现,哈茨木霉M-33 的菌丝紧贴于立枯丝核菌菌丝上,使立枯丝核菌菌丝表面扭曲、变形(图2-A);哈茨木霉M-33 菌丝缠绕攀附在立枯丝核菌菌丝上(图2-B);哈茨木霉M-33 菌丝侵入立枯丝核菌菌丝内部,入侵口凹陷,立枯丝核菌菌丝萎缩、塌陷(图2-C);立枯丝核菌菌丝断裂、崩解(图2-D)。上述结果表明,哈茨木霉M-33 对立枯丝核菌具有重寄生作用。
2.2 不同处理对马铃薯黑痣病防治效果评价
由表1可知,T33W 出苗率最高,分别较T33、W、PN、CK 提高了7.41、14.81、22.22 和37.04 个百分点,T33W、T33、W、PN 均显著高于CK。T33W 薯块病情指数最低,为5.21,防治效果为70.26%,其次为PN,病情指数为5.64,防治效果为67.81%;T33W 与PN 之间的防治效果差异不显著,但显著高于其他处理,T33W 对马铃薯黑痣病的防治效果达到且超过了化学药剂PN 水平。

图2 哈茨木霉M-33 与立枯丝核菌互作扫描电镜照片Fig.2 Stereoscan photographs of interaction between T.harzianum M-33 and R.solani
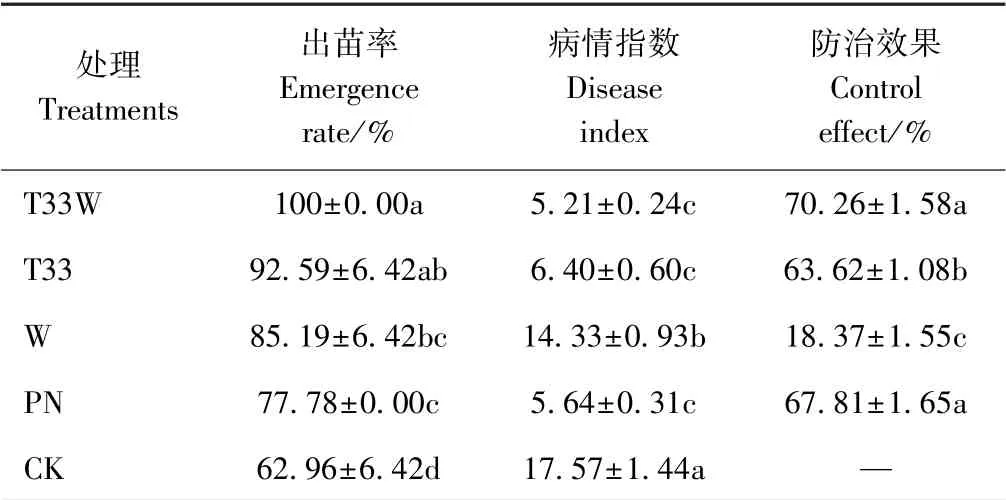
表1 不同处理对马铃薯出苗率的影响及黑痣病的防治效果Table 1 Effect of different treatments on emergence rate and potato black scurf control
2.3 不同处理对马铃薯生长指标的影响
由表2可知,不同处理马铃薯株高、茎粗、分枝数均表现为T33W>T33>W>PN>CK,其中T33W 的株高、茎粗和分枝数分别较CK 提高了186.67%、57.69%和218.85%,T33 分别较CK 提高了106.27%、26.92%和168.85%。T33W、T33、W 和PN 4 个处理的马铃薯株高均显著高于CK;除PN 的茎粗和分枝数与CK 不显著外,其他处理均显著高于CK。上述结果表明,哈茨木霉M-33 处理能够促进马铃薯植株的生长。
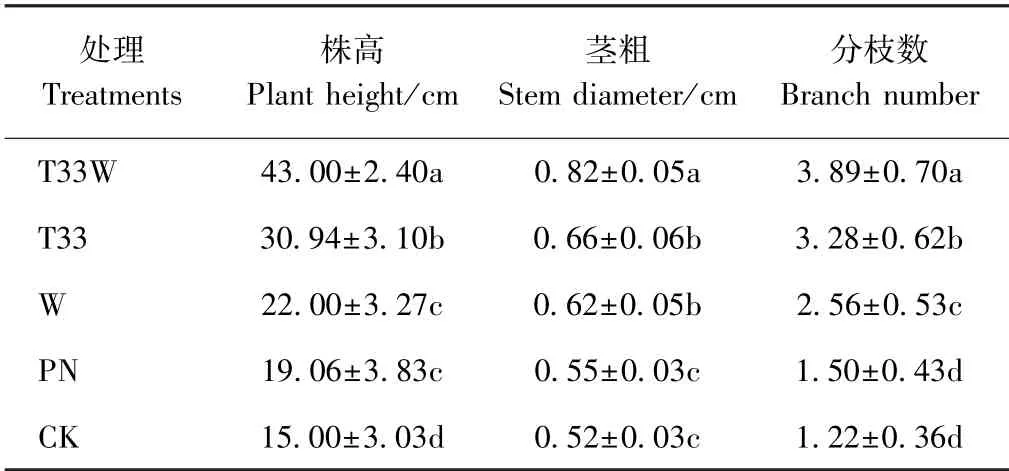
表2 不同处理对马铃薯生长指标的影响Table 2 Effect of different treatments on growth index of potato
2.4 不同处理对马铃薯根际土壤可培养微生物数量与木霉菌数量的影响
由表3可知,与CK 相比,其他处理均显著降低了土壤真菌数量,其中T33W 和T33 土壤真菌数量下降最明显,分别较CK 降低了29.54%和43.73%;同时,与CK 相比,其他处理均提高了土壤细菌、放线菌和木霉菌数量,其中T33W 和W 细菌数量升高最明显,分别较CK 提高了75.36%和44.80%;T33W 放线菌和木霉菌数量升高最明显,分别较CK 提高了60.58%和1 407.27%。由此可见,T33W 能够降低土壤中真菌数量,提高细菌和放线菌数量,促进木霉菌增殖。
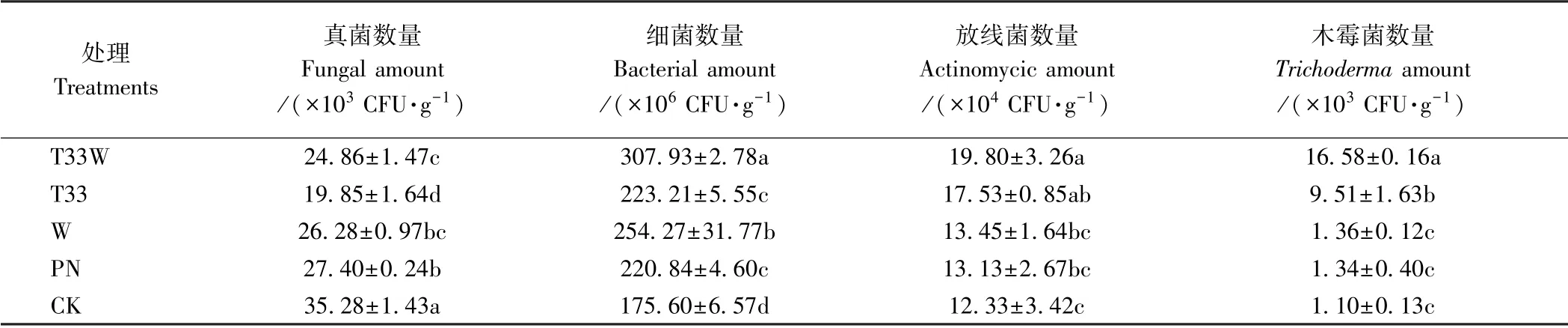
表3 不同处理对马铃薯根际土壤可培养微生物数量和木霉菌数量的影响Table 3 Effect of different treatments on culturable microbe quantities and amount of Trichoderma with potato rhizosphere soil
2.5 不同处理对马铃薯根际土壤微生物区系变化的影响
2.5.1 马铃薯根际土壤微生物群落多样性分析 表4为在3%差异度水平下,不同处理马铃薯根际土壤微生物的α-多样性。真菌群落多样性分析表明,T33W的Shannon-Wiener 指数最高,较CK 提高了12.59%,各处理间差异不显著;T33 和W 的Chao1 指数分别为773.44 和775.93,显著高于其他处理,表明T33W 的根际土壤真菌群落多样性高,真菌种类相对较多,分布均匀。细菌群落多样性分析表明,T33W 的Shannon-Wiener 指数最高,较CK 提高了1.00%,而其他处理均低于CK,各处理间差异不显著;W 和PN 的Chao1 指数高于CK,T33W 和T33 的Chao1 指数低于CK,各处理间差异均不显著,表明各处理根际土壤细菌群落多样性差异均不显著。
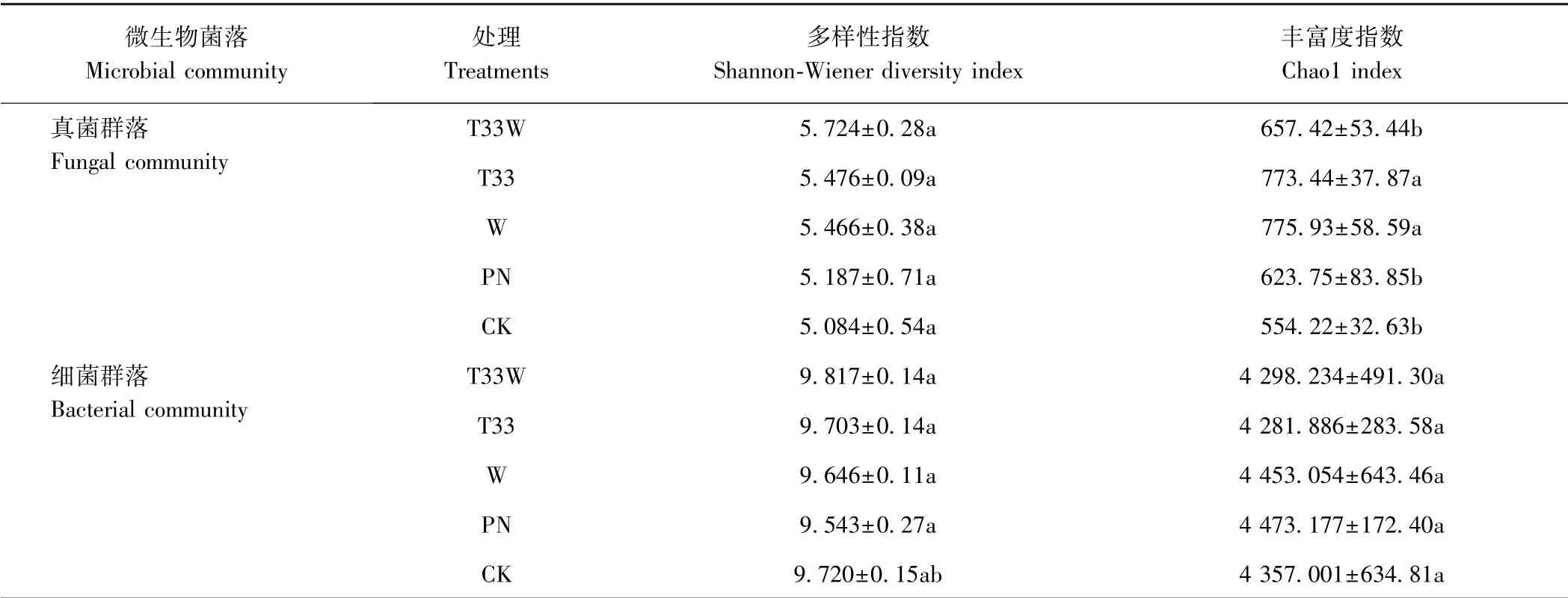
表4 不同处理对马铃薯根际土壤微生物群落多样性的影响Table 4 Effect of different treatments on community diversity index of potato rhizosphere soil microorganisms
2.5.2 马铃薯根际土壤微生物群落结构相似性分析
基于Weighted Unifrac 距离的PCoA 分析了不同处理微生物群落结构相似性。真菌群落结构分析表明(图3-A),PC1 和PC2 解释率分别为23.14%和21.57%,T33W、CK 和W 分别位于第二、第三和第四象限内,三者之间距离较远,而T33 和PN 集中在坐标轴中心位置,二者距离较近。说明T33W、CK 和W 之间真菌群落结构组成差异较大,而T33 和PN 之间真菌群落结构组成相似。细菌群落结构分析表明(图3-B),PC1 和PC2 解释率分别为30.01%和19.34%,PN在第三象限内,与其他处理相距较远,T33W、T33、W和CK 集中在坐标轴中心位置,相距较近。说明T33W、T33、W 和CK 之间细菌群落结构组成相似,与PN 细菌群落结构组成差异较大。

图3 不同处理对马铃薯根际土壤微生物群落结构的影响Fig.3 Effect of different treatments on microbial community structure of potato rhizosphere soil microorganisms
2.5.3 马铃薯根际土壤微生物群落结构组成分析 由表5可知,优势真菌属在各处理中相对丰度均大于1%的仅有2 属,即镰刀菌属和假裸囊菌属,且在T33W中相对丰度最低,在PN 中相对丰度最高。各优势真菌属相对丰度在不同处理中存在差异,其中,木霉属(18.75%)和漆斑菌属(4.96%)在T33W 中相对丰度最高;Rectifusarium(5.31%)、链格孢属(1.76%)、头束霉属(1.43%)、小不整球壳属(1.44%)和枝顶孢属(1.05%)在T33 中相对丰度最高;枝葡萄孢属(3.44%)、毛壳属(3.21%)和沙氏壳属(1.69%)在W 中相对丰度最高;镰刀菌属(50.39%)、假裸囊菌属(6.65%)、马杜拉分枝菌属(2.17%)、枝孢属(1.16%)和赤霉属(1.13%)在PN 中相对丰度最高;杯梗孢属(5.52%)、曲霉属(2.28%)、Chordomyces(1.07%)、壳二孢属(1.23%)和青霉属(0.97%)在CK 中相对丰度最高。

表5 不同处理下马铃薯根际土壤真菌群落的优势属及相对丰度Table 5 The dominant genus and relative abundance of fungal community from potato rhizosphere soil in different treatments
由表6可知,优势细菌属在各处理中相对丰度均大于1%的有6 属,分别为鞘氨醇单胞菌属、多米孢杆菌属、芽孢杆菌属、溶杆菌属、斯科曼氏球菌属和未确定酸杆菌门。各优势细菌属相对丰度在不同处理中存在差异,其中,未确定酸杆菌门(1.88%)、类诺卡氏属(1.19%)、大理石雕菌属(0.80%)和土壤红色杆菌属(1.21%)在T33W 中相对丰度最高;鞘氨醇单胞菌属(3.75%)、溶杆菌属(2.40%)、交替赤杆菌属(0.61%)和藤黄色单胞菌属(0.87%)在T33 中相对丰度最高;斯科曼氏球菌属(2.00%)、链霉菌属(0.65%)、芽单胞杆菌属(0.73%)在W 中相对丰度最高;多米孢杆菌属(3.35%)、亚硝化螺菌属(2.58%)、Woeseia(1.03%)、特吕珀菌属(1.14%)、膨胀芽孢杆菌属(0.69%)和Salinimicrobium(1.49%)在PN 中相对丰度最高;芽孢杆菌属(3.03%)、交替赤杆菌属(0.61%)、微枝形杆菌属(0.86%)和未确定α-变形杆菌纲(0.68%)在CK 中相对丰度最高。

表6 不同处理下马铃薯根际土壤细菌群落的优势属及相对丰度Table 6 The dominant genus and abundance of bacteria community from potato rhizosphere soil in different treatments
3 讨论
本研究结果表明,哈茨木霉M-33 对立枯丝核菌具有较强的拮抗作用,主要拮抗机制为空间竞争作用和重寄生作用,这与谷祖敏等[17]的研究结果相符。倪方方等[18]发现哈茨木霉分泌的细胞壁水解酶有利于木霉菌菌丝侵入病原菌菌丝内部,从而引起病原菌菌丝出现明显的断裂,本研究也发现了类似现象,推测哈茨木霉M-33 可能具有溶菌作用。
本研究结果表明,哈茨木霉M-33 和小麦秸秆协同处理时,木霉菌仍保持了较高的数量,显著高于其他处理,说明有机添加物能为生防木霉菌提供营养,促进木霉菌孢子萌发[19]。盆栽试验结果表明,哈茨木霉M-33 处理后,可显著提高马铃薯出苗率,降低马铃薯黑痣病病情指数,其中协同处理防治效果达到化学药剂防效水平,这与乔俊卿等[20]、肖荣凤等[21]的研究结果一致。此外,本研究还发现,单施哈茨木霉M-33 和单施小麦秸秆对马铃薯植株都具有一定的促生效果,二者协同处理对马铃薯促生效果更显著,这可能因为有机物的添加增强了生防木霉菌在植物根部竞争能力,可快速占领生态位,定殖于植物根表面,引起植物新陈代谢实质性变化,增加养分利用率,增强植物抗病性,进而促进植物生长[22-23]。
大量研究表明,土壤健康与微生物有关[24],施用木霉菌肥能够增加连作土壤中细菌和放线菌数量,降低真菌数量[25]。本研究中协同处理也表现了相似的趋势,这可能是小麦秸秆的添加促进了哈茨木霉M-33 菌株增殖,增强了哈茨木霉M-33 对土壤中病原菌的拮抗作用,从而抑制了病原真菌的繁殖,降低了马铃薯根际土壤真菌的数量。而马铃薯根际土壤中细菌和放线菌数量的增加,可能与秸秆还田显著提高作物根际土壤中微生物数量有关[26]。协同处理后,根际土壤由“真菌型”向“细菌型”转变,保持了土壤微生物区系平衡,从而减轻了病害的发生。
Bonanomi 等[27]研究表明,土壤真菌群落多样性与土壤抑制土传病害能力呈正相关。本研究中马铃薯黑痣病防效显著的协同处理结果印证了这一观点,处理后根际土壤真菌多样性增加,表明根际土壤真菌多样性变化可能响应马铃薯黑痣病的发生。本研究基于OUT 组成的PCoA 分析也表明,协同处理后根际土壤真菌群落结构组成与其他处理不同,而根际土壤细菌群落结构组成与其他处理表现出较高的相似性,以上结论都证实了哈茨木霉M-33 与小麦秸秆协同处理能够改变根际土壤真菌群落,对细菌群落影响不大,胡洪涛等[28]也报道了类似的结果。但也有报道表明,施用木霉菌会使真菌多样性指数明显降低[29],或者对土壤微生物多样性无影响[30],这可能与木霉种类、土壤微环境、采样时间以及作物种类等不同有关。
本研究首次从宏基因组水平上分析了哈茨木霉M-33 与小麦秸秆协同处理对根际土壤微生物群落影响。在属水平上,协同处理显著降低了镰刀菌属的相对丰度,而镰刀菌是引起马铃薯土传病害的重要致病菌,也是造成马铃薯连作的主要因素,镰刀菌相对丰度的下降可能与哈茨木霉M-33 对其具有拮抗作用相关。同时,协同处理增加了木霉属和漆斑菌属的相对丰度。这可能是小麦秸秆的添加促进了哈茨木霉M-33 在马铃薯根际土壤中的增殖,并吸引了能够产生有益酶类、降解植物病原菌菌核的漆斑孢属真菌[31]的聚集。同时,研究发现协同处理促进了具有分解纤维素降解能力的酸杆菌门细菌[32]相对丰度增加,其在抑病型土壤中丰度高于导病型土壤,表现出较大的抑病潜力[33]。
4 结论
哈茨木霉M-33 对病原菌的拮抗机制表现为空间竞争和重寄生作用,其与小麦秸秆协同能显著提高对马铃薯黑痣病防治效果,而且具有促进马铃薯生长,显著增加土壤中细菌、放线菌和木霉菌数量,降低真菌数量的作用。此外,哈茨木霉M-33 能有效改善土壤中微生物群落结构,减少土壤中致病真菌丰度。本研究为开发环境友好型的生防木霉菌剂提供了理论和实践依据。
