山葡萄VaCIPK18原核表达与多克隆抗体制备
2020-07-01张宁波郑巧玲陈卫平徐伟荣
吴 楠 张宁波 郑巧玲 陈卫平 徐伟荣
(1宁夏大学农学院,宁夏 银川 750021;2葡萄与葡萄酒教育部工程研究中心,宁夏 银川 750021;3宁夏优势特色作物现代分子育种重点实验室,宁夏 银川 750021;4宁夏葡萄与葡萄酒研究院,宁夏 银川 750021;5宁夏农林科学院,宁夏 银川 750021)
葡萄(Vitisspp.)是多年生落叶藤本果树类作物,被广泛用于酿酒、鲜食、制汁、制干、制罐。据联合国粮食及农业组织(Food and Agriculture Organization,FAO)统计,截至2016年,我国葡萄栽培面积为84 万hm2,居世界第2 位;产量约1 500 万t,居世界首位。目前,在世界范围内广泛种植的葡萄多数为欧亚种葡萄(V.viniferaL.),其品质优,但抗逆性普遍较差。低温对葡萄的伤害是葡萄栽培中常遇到的问题,严重限制了葡萄的栽培区域。我国北方葡萄栽培地区,如西北、华北和东北地区均属于埋土防寒栽培区,由于低温、空气干燥、多风等气象因子,导致冻旱时有发生。因此,培育在我国北方地区免埋土即可安全越冬的抗寒旱优质葡萄新品系是发展高产、优质寒地葡萄的有效途径,也是葡萄育种中亟待解决的问题。
在低温胁迫下,植物通过信号感知、信号转导、转录调控等激活在冷胁迫下信号通路相关基因的表达,引发相应的生理生化反应,对冷胁迫做出相关抗逆响应。其中,Ca2+作为第二信使感应胁迫信号,当植物受到冷胁迫时,细胞Ca2+浓度增大[1]。Ca2+信号可通过激酶的磷酸化作用[2]或转录因子的调控影响细胞的生理生化反应[3-4]。在高等植物中已发现4 个主要的钙感受器蛋白家族:钙依赖性蛋白激酶(calciumdependent protein kinases,CDPKs)、钙调素(calmodulins,CaMs)、类钙调素蛋白(calmodulin-like proteins,CMLs)和类钙调磷酸酶B 蛋白(calcineurin Blike proteins,CBLs),其中CBLs 必须与CIPKs 互作才能完成Ca2+的信号转导[5]。CIPK 蛋白激酶普遍存在于陆生植物基因组中[5],如拟南芥[6]、水稻[7]、高粱[8-9]、木薯[10]、白杨[11]、苹果[12]和葡萄[13]等。研究表明,CBL-CIPK 复合物参与大范围逆境胁迫条件下的信号转导,如低温、造伤、干旱和高盐等[14]。然而,前期报道多通过目标基因在模式植物中的异源表达研究其功能,有关其调控逆境胁迫的具体机制研究较少。
有关CIPKs参与低温胁迫的研究主要集中在模式植物拟南芥与水稻中。在拟南芥(Arabidopsis thaliana)中,AtCIPK3 受低温诱导表达,且调控CBF/DREB靶基因如RD29A和KIN1/KIN2 的表达[15]。AtCIPK7 通过与负调控因子AtCBL1 相互作用参与植物对低温刺激的信号转导[16]。水稻(Oryza sativa)OsCIPK3 受低温胁迫上调表达,而过表达OsCIPK3 增强转基因水稻的抗寒性[17]。小麦(Triticum aestivum)TaCIPK14 响应低温诱导表达,在烟草中过量表达TaCIPK14 增强了转基因植株的抗盐碱和抗寒性[18]。在水稻中过量表达芜菁(Brassica rapa)BrCIPK1 与OsCIPK7 均能增强低温的耐受性[19-20]。然而,有关葡萄属植物CIPK 蛋白激酶基因参与低温胁迫响应的调控机理尚不清楚。
山葡萄(Vitis amurensis)是葡萄属植物中最抗寒的一个种,挖掘野生葡萄种质抗寒基因资源,开展低温胁迫应答机制的解析,是通过分子手段实现栽培葡萄抗寒性改良的有效途径。Xu 等[21]对中国野生抗寒材料山葡萄进行转录组测序分析,发现参与低温胁迫引发的早期伤害及感知阶段的激酶基因中,涉及CBL-CIPK信号通路的7 个CIPK成员(CIPK3、CIPK12、CIPK13、CIPK14、CIPK17、CIPK18 与CIPK19),均参与低温胁迫诱导,其中VaCIPK18 基因受低温胁迫呈明显上调表达。本研究通过生物信息学分析获取VaCIPK18 胞外结构域中抗原表位丰富的肽段,利用基因工程手段将编码该蛋白C 端230~439 aa 的基因片段构建至原核表达载体pET28a-VaCIPK18230-439,并诱导表达融合蛋白,免疫实验级大耳白兔制备高效价特异性抗血清,并利用该抗血清分析低温胁迫对VaCIPK18 在葡萄叶片内的表达量的影响,旨在为进一步从蛋白水平解析VaCIPK18 参与葡萄低温信号转导中的功能作用奠定基础。
1 材料与方法
1.1 材料与试剂
供试材料为两年生盆栽扦插的山葡萄左山-1(V.amurensiscv.Zuoshan-1),于自然光照条件下温室进行培养。4℃低温培养箱[LT-BIX120L,立德泰克力(上海)科学仪器有限公司]处理2 d 后采集叶片组织,以室温条件下的叶片组织作为对照(CK),液氮速冻,置于-80℃保存备用。
DNA Marker、pMD19-T Vector、PrimeSTAR® Max DNA Polymerase、限制性内切酶、反转录试剂盒、蛋白定量试剂盒均购自宝日医生物工程(大连)有限公司;质粒小提试剂盒、胶回收试剂盒均购自北京天根公司;ClonExpress® ⅡOne Step Cloning Kit 购自南京诺唯赞生物科技有限公司;植物蛋白抽提试剂盒购自上海生工生物工程有限公司;辣根过氧化物酶HRP 标记的羊抗兔抗体购自武汉爱博泰克生物科技有限公司。引物合成和测序由北京奥科生物公司完成。
1.2 目的基因克隆
以欧洲葡萄VvCIPK18(VIT_06s0009g01840)为参考序列,设计特异引物VaCIPK18-F(ATGAATCCACCT AAAGTCAAGCGTCG)和VaCIPK18-R(CTGAGGATGA CATGCAAGAAACGAAATAA)。以山葡萄叶片cDNA 为模板,通过PCR 扩增获得目的片段,建立25 μL PCR反应体系:ddH2O 9.5 μL,cDNA 模板1 μL,上下游引物(10 μmol·L-1)各1 μL,PrimSTAR Max Premix(2×)12.5 μL;离心混匀后,进行PCR 反应。PCR 反应程序:98℃变性10 s,55℃退火15 s,72℃延伸10 s,35 个循环,72℃延伸10 min。PCR 产物经琼脂糖凝胶电泳,胶回收目的片段与pMD19-T 载体连接,转化大肠杆菌(E.coli)Top10,菌液PCR 鉴定后,阳性克隆送北京奥科鼎盛生物科技有限公司测序。
1.3 生物信息学分析
山葡萄VaCIPK18 基因序列经北京奥科鼎盛生物科技有限公司测序后,提交至NCBI 数据库。采用ExPASy(https://www.expasy.org/)在线分析氨基酸的理化性质;MEGA7.0 软件中的邻接(Neighbor-Joining)法构建蛋白系统进化树。运用SMART:Main page(http://smart.embl-heidelberg.de/)进行蛋白结构域分析;通过IEDB analysis Resource(http://tools.immuneepitope.org/main/)进行线性表位预测。运用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构预测。通过SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测。
1.4 原核表达载体构建
根据线性表位预测结果,选择山葡萄VaCIPK18蛋白230~439 aa 相应的区段,设计特异引物,VaCIPK18-SUMO-F:GAACAGATTGGTGGATCCGAATT TACTTGCCCACCTTGGCTCT 与VaCIPK18-SUMO-R:T GCGGCCGCAAGCTTTTTCGTTTCTTGCATGT,以VaCIPK18 重组克隆质粒为模板,通过PCR 扩增获得目的片段。同时使用限制性内切酶BamHⅠ/HindⅢ双酶切原核表达载体pET28a-SUMO,通过ClonExpress® ⅡOne Step Cloning Kit(南京诺唯赞生物科技有限公司)进行同源重组,将连接产物转化E.coliTop10 感受态细胞,涂板,挑取单菌落,摇菌14 h 后,进行菌液PCR 与酶切鉴定。测序正确的质粒命名为pET28a-VaCIPK18230-439。
1.5 重组蛋白原核表达及可溶性分析
将pET28a-VaCIPK18230-439重组质粒转化E.coliRosetta 菌株,挑取单菌落接种培养12 h,进行菌液PCR 鉴定,正确的菌株用于原核诱导表达。37℃、200 r·min-1培养至OD600为0.6~0.8 时,加 入0.8 mmol·L-1异丙基-β-d-硫代半乳糖苷(isopropyl-β-dthiogalactoside,IPTG),诱导4 h 后,取1 mL 菌液,经细菌裂解液处理30 min 后离心,对全菌体蛋白、菌体上清、裂解上清、裂解后的沉淀以及未诱导重组菌和诱导的pET28a 空载体菌,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析,确定重组蛋白的表达形式。
1.6 包涵体蛋白的处理
VaCIPK18230-439重组蛋白以包涵体形式存在,经大量诱导表达后,5 500 r·min-1离心20 min 收集菌体,取50 mL 的1×PBS 缓冲液,重悬菌体,转入50 mL 烧杯中,并加入50 μL β-巯基乙醇。冰浴超声破碎细胞,9 000 r·min-1离心10 min,获得上清液Ⅰ和沉淀;上清Ⅰ转移至50 mL 离心管中,4℃保存。沉淀用8 mol·L-1尿素进行二次破菌;9 000 r·min-1离心10 min得到上清液Ⅱ和沉淀,上清液Ⅱ装于50 mL 离心管中,4℃保存。沉淀先用去离子水洗涤2 遍,再加入6 mL ddH2O,悬浮后平均分装到4 个2 mL 的离心管中,12 000 r·min-1离心2 min,弃上清液。向管中加入1.5 mL 8 mol·L-1尿素溶解沉淀,12 000 r·min-1离心1 min,上清液移入到新的2 mL 离心管中,采用BCA法[22]检测洗脱液中蛋白浓度,进行12% SDS-PAGE 电泳鉴定。
1.7 融合蛋白的抗血清的制备、效价测定
适应性饲养一周后,将符合免疫要求浓度的VaCIPK18230-439融合蛋白乳化后,多点注射2 只实验级大耳白兔背部皮下,按照每kg 体重1 mg 的剂量,分别在第1、第12、第26、第40 天注射一次,共免疫4 次,第4 次注射7 d 后静脉少量采血样,采用酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)测定抗体效价[23],经检测合格后,于第52 天后动脉一次性采血。
1.8 免疫亲和层析柱的制备、兔抗血清的纯化与特异性检测
取8 mg 多肽,用2 mL 偶联缓冲液(50 mmol·L-1Tris,5 mmol·L-1EDTA-NA,pH 值8.5)溶 解;将Sulfolink 偶联凝胶平衡至室温,取2 mL 加入层析柱中,旋转培养2 h。将层析柱静置于层析架,连接恒流泵,分别用40 mL 1×PBS、30 mL 1×Gly、30 mL 1×PBS平衡柱子。将获得的兔抗血清加入1/20 4 mol·L-1NaCl 溶液,过柱2 次,然后加入40 mL 洗脱缓冲液(1×PBS,320 mmol·L-1NaCl)洗脱,再加入1×Gly 收集样品,最后向样品中加入过量的Gly(pH 值2.2)洗脱抗体,并用1×PBS 平衡。将收集的抗体置于透析袋,混匀之后取30 μL 用于抗体浓度测定,其余抗体置于1×PBS 的甘油中透析浓缩过夜,-20℃保存。将不同剂量重组菌诱导表达的蛋白经12% SDS-PAGE 电泳,并凝胶湿转至硝酸纤维素膜(NC)上,以纯化的兔血清为一抗(1∶1 000),以荧光标记的山羊抗兔抗体为二抗,进行蛋白印迹(Western Blot)检测,使用Azure 蛋白成像C400 系统(Azure Biosystems,美国)扫描NC 膜,进行增强化学发光法(enhanced chemiluminescence,ECL)染色,采用电泳系统对电泳图像分析。
1.9 Western Blot 分析
将盆栽山葡萄转移至4℃处理2 d,收集的叶片组织样品为试验组,以室温条件下的叶片组织作为对照(CK),于液氮中进行研磨。取200 mg 粉末,加入300 μL 蛋白提取液[100 mmol·L-1Tris-HCl(pH 值6.8)、2%SDS、10%甘油和0.5% β-巯基乙醇],4℃、10 000 r·min-1离心10 min,收集上清液,进行12% SDSPAGE 电泳及Western Blot 分析。
2 结果与分析
2.1 山葡萄VaCIPK18 克隆与生物信息学分析
本研究克隆获得的山葡萄左山-1VaCIPK18 基因序列全长1 320 bp,编码439 个氨基酸。蛋白结构域预测结果表明,该蛋白激酶包括2 个典型的结构域,分别为N 端的S_TKc 激酶结构域(kinase domain)和C端的调控结构域(junction regulatory domain)(图1)。聚类分析表明,源于植物中与山葡萄VaCIPK18 同源的蛋白可聚为双子叶植物与单子叶植物两类(其中人HsAMPKalpha-2 蛋白为外群);VaCIPK18 与欧洲葡萄VvCIPK18 亲缘关系最近(相似性为99.8%),并与碧桃、甜樱桃、大豆与拟南芥聚为一类;同时发现二穗短柄草、山羊草、日本稻、高粱与谷子聚集在单子叶植物类(图2)。经信号肽预测发现,VaCIPK18 信号肽分值S 平均值(mean S-score)<0.5,表明其不存在信号肽片段,不是分泌蛋白。跨膜结构域预测表明,VaCIPK18不存在跨膜区域。线性表位、亲水性、免疫原性和表位暴露性预测数据表明,C 端氨基酸抗原表位、暴露性及性质优于N 端氨基酸区域,因此,选择230~439 aa 抗原区进行抗体制备(图1)。
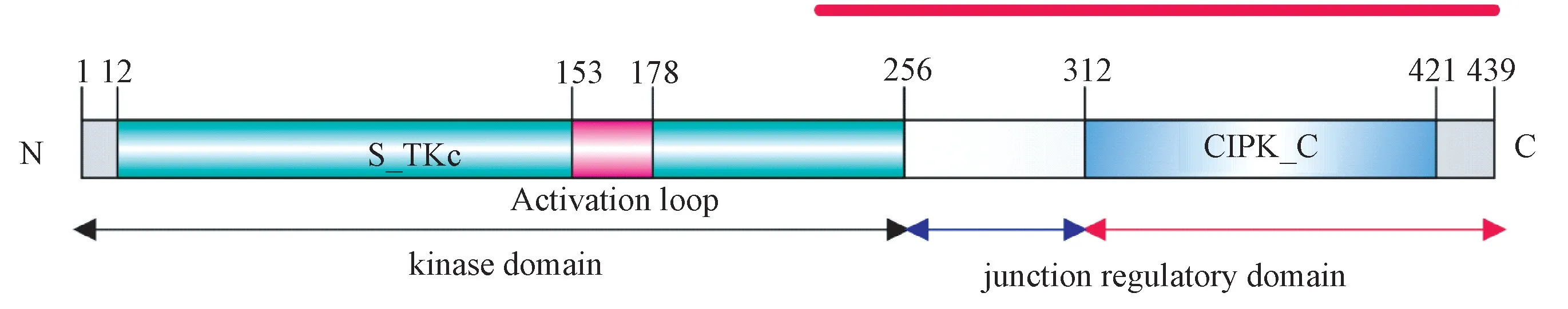
图1 山葡萄VaCIPK18 蛋白结构域预测Fig.1 Prediction of VaCIPK18 protein domain from V.amurensis
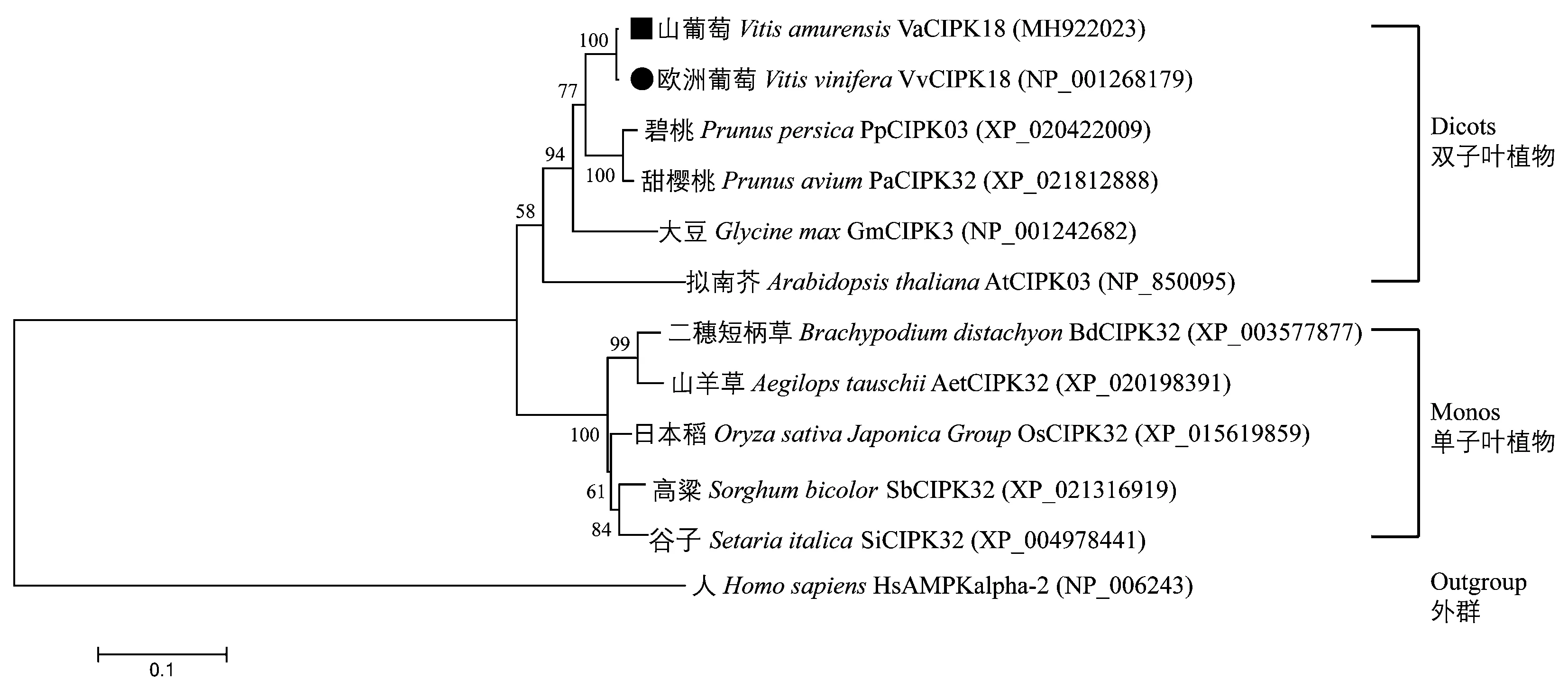
图2 山葡萄CIPK18 与其他植物CIPK 的系统发育树Fig.2 Phylogenetic tree of CIPK18 amino acid sequence of V.amurensis and other related plant species
2.2 VaCIPK18原核表达载体构建
以pMD-19-T-VaCIPK18 质粒为模板,PCR 扩增出630 bp 的目标片段。使用BamHⅠ/HindⅢ双酶切原核表达载体pET28a-SUMO,通过同源重组获得pET28a-VaCIPK18230-439(图3)。经菌液PCR、双酶切鉴定为阳性的克隆进行测序,正确的克隆转化大肠杆菌Rosetta菌株。
2.3 VaCIPK18 激酶融合蛋白原核表达以及可溶性分析
将含重组表达质粒pET28a-VaCIPK18230-439的大肠杆菌Rosetta进行小规模培养,并在37℃条件下,经0.8 mmol·L-1IPTG 诱导4 h 后,离心取菌体裂解液,进行SDS-PAGE 电泳检测。结果表明,空载体与未经IPTG 诱导的重组质粒 pET28a-VaCIPK18230-439的Rosetta 菌体中均未检测到目标条带,而经IPTG 诱导后的菌体中在42 kDa 左右处出现目标条带,同预测的VaCIPK18230-439肽段分子量24 kDa 与His-T7-SUMO 分子量18 kDa 之和大小一致(图4),表明在IPTG 诱导下重组蛋白进行了表达。
取重组菌株进行扩大培养,收集菌体经超声波破碎、离心后,取上清与沉淀进行SDS-PAGE 鉴定。结果表明,重组蛋白主要以不可溶的包涵体形式存在于破菌沉淀中,而上清中未检测到重组蛋白条带(图5)。
2.4 抗血清ELISA 检测
将包涵体溶解后经SDS-PAGE 检测,包涵体蛋白纯度达到90%,目标带清晰,但仍有少量杂带(图6-A)。经检测,获得重组蛋白包涵体浓度为10 mg·mL-1,纯度达到免疫要求。免疫大耳兔后,制备抗血清,通过ELISA 竞争性抑制法检测纯化血清和效价,结果显示,当抗原稀释比例为4 K 和512 K 倍时,纯化血清抗体效价和零标准OD 值为1.983 5 与0.040 7,非纯化血清抗体效价0.034 1,说明被免疫的兔子产生了抗体,效价最高可达到1∶512 000,其抗血清中抗体浓度能满足Western Blot 的效价值(图6-B)。
将重组菌诱导表达的不同剂量蛋白经12% SDSPAGE 电泳后转膜,以制备的兔抗血清为一抗,进行Western Blot 分析检测,10、5、1、0.5 ng 的抗原均可检测到1 条特异性条带,且大小与预期结果相符(42 kDa),表明抗原与anti-VaCIPK18 抗体特异性结合(图7)。
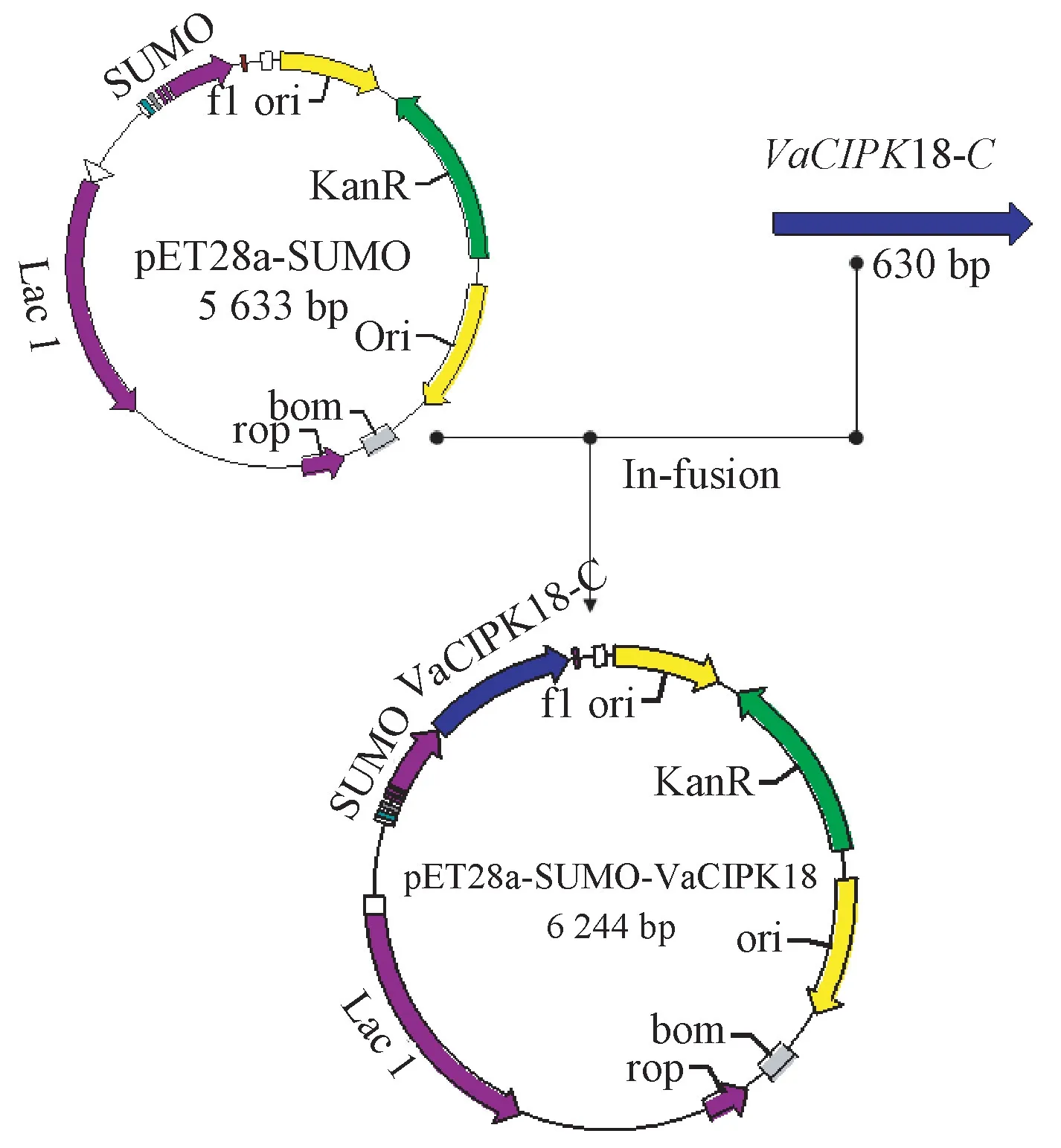
图3 融合蛋白原核表达载体pET28a-SUMO-VaCIPK18构建过程示意图Fig.3 The construction process of fusion protein prokaryotic expression vector pET28a-SUMO-VaCIPK18
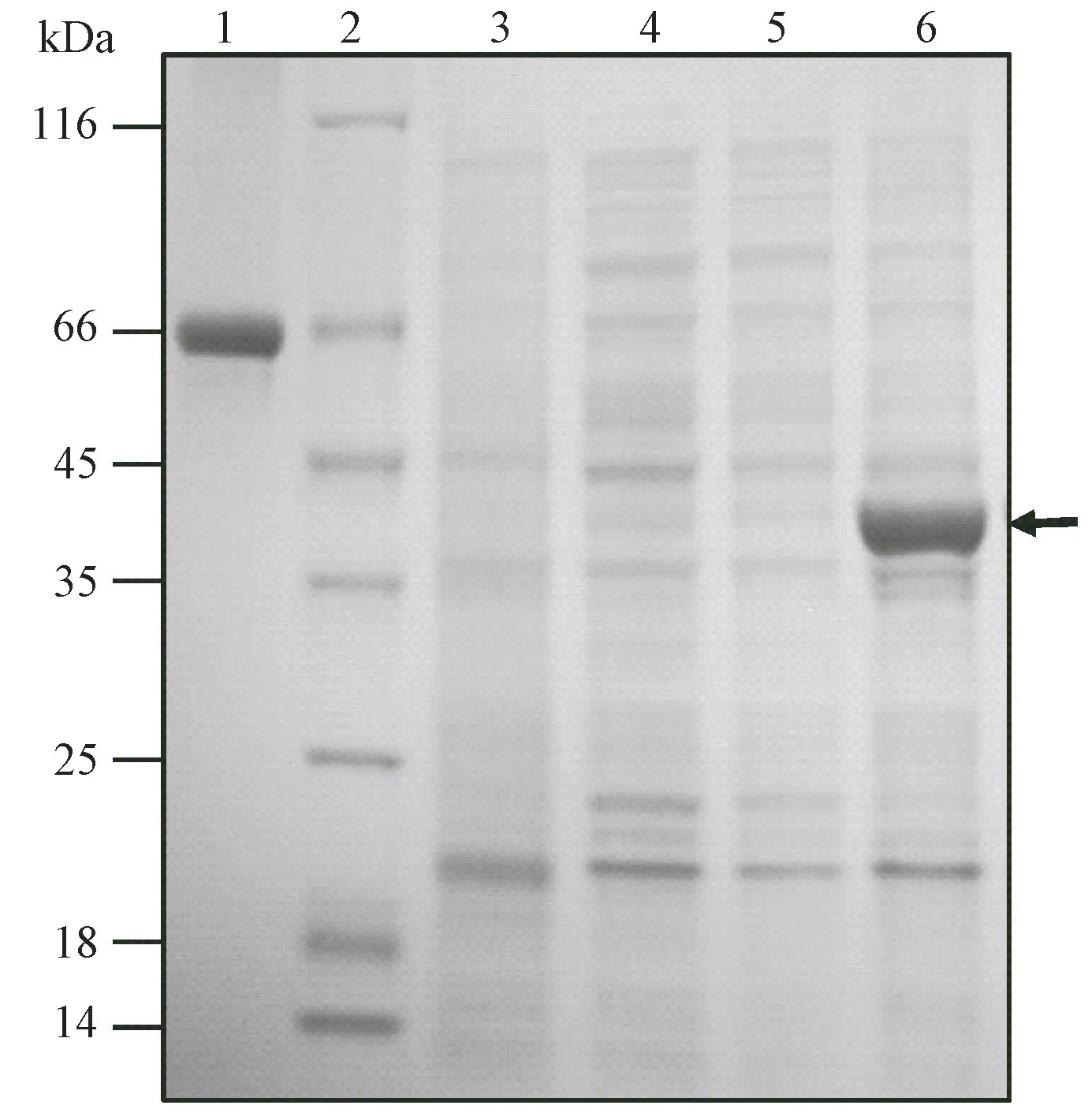
图4 VaCIPK18230-439原核蛋白诱导表达Fig.4 Prokaryotic protein induced expression of VaCIPK18230-439
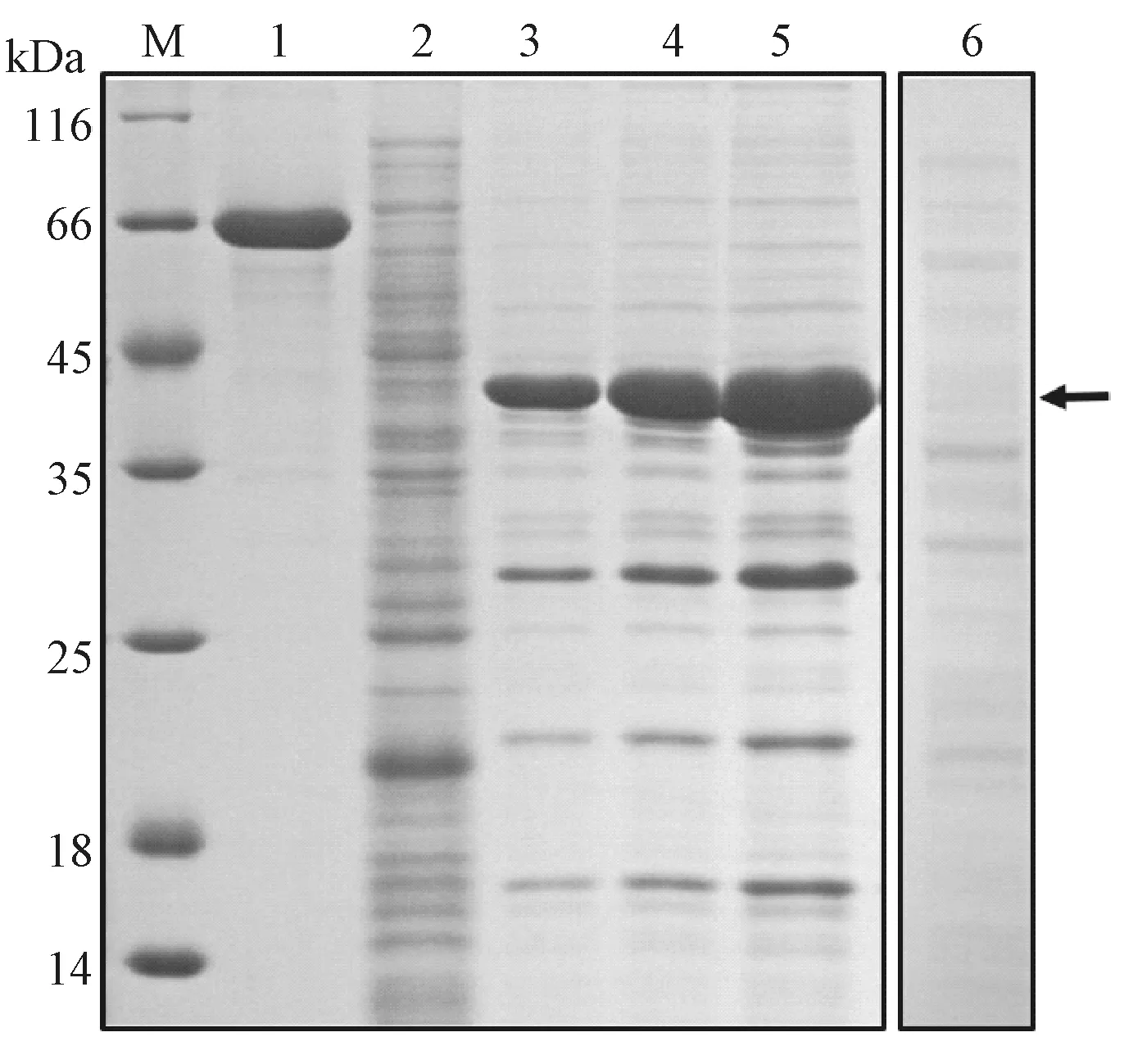
图5 VaCIPK18230-439融合蛋白可溶性分析Fig.5 Analysis of the solubility of VaCIPK18230-439fusion protein
2.5 anti-VaCIPK18 多克隆抗体的检测
为明确山葡萄VaCIPK18 参与低温胁迫的表达模式,提取山葡萄叶片组织在室温与低温胁迫下的叶片总蛋白,进行12% SDS-PAGE 电泳,用制备的anti-VaCIPK18 抗血清进行Western Blot 分析。结果表明,在室温与低温条件下,均能杂交出与预期大小一致的条带(50 kDa);与室温相比,低温诱导对VaCIPK18 蛋白表达无显著差异。除了50 kDa 的特异条带外,还发现在该特异条带上下共3 条弱的条带(图8),推测可能与VaCIPK18 蛋白自磷酸化、蛋白间的磷酸化或泛素化降解有关[24-25]。
3 讨论
植物为了适应环境胁迫,进化出精细的调控机制进行信号识别与转导,从而对非生物胁迫做出一系列的响应,以缓解对植物生长发育产生的不良影响[26]。CBL-CIPK系统是陆生植物特有的Ca2+介导响应非生物胁迫的信号转导途径[27-28]。作为感受器,CBLs 识别并结合Ca2+,激活后的CBLs 与特异的CIPKs 激酶互作形成复合物[29],该复合物磷酸化其下游靶蛋白,如PP2C 磷酸酶[30]、离子转运蛋白[31]、转录因子[32]以及NADPH 氧化酶RBOHF[33]等,继而调控植物响应逆境胁迫。然而,有关葡萄属植物CBL-CIPK 网络中成员参与冷胁迫信号转导中的功能尚鲜见报道。
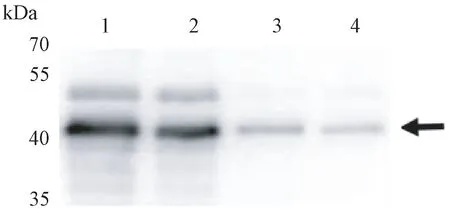
图7 制备的anti-VaCIPK18230-439多克隆抗体Western Blot 分析Fig.7 Western Blot analysis of anti-VaCIPK18230-439polyclonal antibody

图8 anti-VaCIPK18 在山葡萄叶片中Western 的检测Fig.8 Detection of anti-VaCIPK18 in V.amurensis
本研究从抗寒山葡萄种质中克隆获得一个类钙调素B 亚基蛋白的互作蛋白VaCIPK18,其与已报道的拟南芥逆境胁迫基因AtCIPK3 蛋白高度同源,表明其可能在低温胁迫中发挥重要的作用。为了深入了解VaCIPK18 在细胞中的功能以及响应逆境过程中的作用特点,本研究首先通过生物信息学预测,综合分析了该蛋白的跨膜区、信号肽、线性表位、亲水性、免疫原性和表位暴露性数据,选择该蛋白230~439 aa 区间,采取原核表达方法制备了抗血清。在原核表达载体构建中,考虑到小泛素相关修饰物(small ubiquitin-like modifier-1,SUMO)标签具有抗蛋白水解,显著增加重组蛋白表达量以及消化后无氨基酸残留等优势[34],选择pET28a-SUMO 载体进行原核表达。本研究结果表明,在37℃条件下,经IPTG 诱导获得了不溶性的包涵体蛋白。研究表明,通过原核系统进行重组蛋白的表达通常会产生天然的可溶性蛋白与非天然的包涵体形式[35-36]。推测VaCIPK18230-439包涵体蛋白的形成,可能由于该蛋白折叠过程中缺乏所需要的酶和辅助因子,或环境不适,无法形成正确的次级键[37-38]。由于包涵体蛋白是非折叠状态的聚集体,不具有生物学活性,但对后续免疫检测反应影响不大。因此,本研究对重组融合蛋白包涵体8 mol·L-1尿素与6 mol·L-1的盐酸胍溶解包涵体进行变性,经检测获得了较高纯度的重组蛋白,从而用于后续免疫。本研究制备的anti-VaCIPK18 多克隆抗体与菌体总蛋白杂交后,目标条带清晰,背景低;ELISA检测表明,其效价达到1∶512 000,满足抗血清制备要求。
泛素蛋白酶体系统参与众多蛋白的降解,对众多细胞进行调控。泛素依赖性蛋白水解酶在植物激素的形成、感知、信号转导与输出的调节中起着不可或缺的作用[39]。有研究报道,拟南芥CIPK26 是ABA 信号通路中Ring-type E3 泛素连接酶KEG(Keep on Going)的泛素化底物,KEG 靶向CIPK26 激酶与下游转录因子ABI5的结合[40]。同时,CIPK26可在体外磷酸化KEG,活化的CIPK26 增强了KEG 的降解[41]。也有研究表明,未知激酶激活环磷酸化可能是CIPK 激活的替代机制,其独立于与CBL 的互作[42]。本研究在山葡萄叶片蛋白检测的Western Blot 分析中发现,除了与预期大小一致的内源特异条带(50 kDa)外,在30~60 kDa 范围内还存在其他条带。一种可能是葡萄CIPK18 蛋白的泛素化修饰,出现了在30~45 kDa 区间的两条带,推测可能与VaCIPK18 作为某种泛素连接酶的底物被蛋白酶体降解有关;另一种是CIPK18激酶自身磷酸化或未知蛋白对CIPK18 的磷酸化,出现在目标条带上方(50~60 kDa)的蛋白条带,这与已报道的激酶BRI1[43-44]、BAK1[45]、激酶抑制剂BES1[46]以及泛素连接酶PUB13[47-48]等蛋白都有磷酸化现象一致。CIPK18 蛋白是否以二聚体或者多聚体的形式存在于葡萄中也需要进一步研究。在本研究中的原核表达系统中也发现有类似磷酸化条带的现象,进一步表明该蛋白在植物与细菌中具有保守的功能。因此,VaCIPK18 在植物中所存在的功能形式还需进一步通过构建敲除株系,结合质谱分析或泛素化/磷酸化抗体孵育研究确定。
4 结论
本研究克隆了抗寒山葡萄VaCIPK18 基因,经生物信息学分析,获取胞外结构域中抗原表位丰富的肽段,并将其C 端调控结构域(230~439 aa)构建到pET28a-SUMO 原核表达载体,在大肠杆菌Rosetta 中,经37℃、0.8 mmol·L-1IPTG 诱导表达,获得与预期相符的42 kDa 的重组蛋白,经纯化后获得 anti-VaCIPK18 多克隆抗体。Western Blot 结果表明,该抗体可以特异识别葡萄内源的CIPK18 激酶,同时发现该蛋白存在可能的磷酸化与泛素化修饰。本研究为进一步从蛋白水平研究VaCIPK18 蛋白激酶参与低温胁迫中的功能提供了依据。
